添加饲用复合菌剂青贮全株玉米的效果研究
2019-09-05杨梦婷张梦瑶徐养滨郭萌萌王小龙杨雨鑫陈玉林
■杨梦婷 张梦瑶 徐养滨 郭萌萌 张 科 王小龙 杨雨鑫 陈玉林
(西北农林科技大学动物科技学院,陕西杨凌712100)
青贮体系是现阶段开展“节粮型”畜牧业的较优手段[1],乳酸菌在厌氧条件下降低饲料的pH 值,利用可溶性碳水化合物产生CO2,抑制有害微生物的生长,使得青贮饲料进入稳定的贮藏状态,从而达到青绿饲料长期保存的目的[2-4]。乳酸菌可以分为同型和异型发酵两类,同型发酵可产生乳酸,异型发酵在产生乳酸的基础上可产生乙酸、乙醇和CO2等产物[5]。酵母菌可以利用青贮料中的糖分进行生长繁殖,可增加饲料中的蛋白质含量,同时生成乙醇等物质,使青贮饲料具有酒香味。酵母菌只在青贮的发酵初期生长繁殖,随着青贮料中氧气耗尽,乳酸菌数量的增加和有机酸的积累则停止生长。但是酵母菌能分解饲料中的有机物质,降低青贮饲料的品质。因此,青贮饲料中微生物的种类和数量将决定青贮发酵的效果[6-7]。黑曲霉菌和芽孢杆菌在生长过程中可以产生的大量糖化酶、纤维素酶、半纤维素酶、果胶酶、淀粉酶和蛋白酶等酶类,通过降解植物体的多糖和木质素,破坏其连接的共价键。其次,青贮饲料渗出液增多,大量的有机物转化为发酵底物,可供乳酸菌发酵,细胞壁裂解释放的物质可以为青贮发酵提供更多的碳水化合物,作为菌体良好的生长底物,可以促进青贮原料中添加的复合微生物菌剂的大量增加,从而可以提高青贮饲料干物质的含量和提高青贮料中蛋白的含量,并且,饲料中糖类的增加在青贮早期可以加速乳酸菌的繁殖,使青贮饲料的pH值降低[8]。本试验从实验室筛选保存的优势菌株中筛选组合,以乳熟期的全株玉米作为发酵原料,拟筛选出适宜青贮全株玉米的最佳菌株组合,从而有效的提高青贮全株玉米的感官品质和营养价值,以期为饲用复合菌剂的推广应用提供理论依据。
1 材料与方法
1.1 试验材料
试验用全株玉米刈割于西北农林科技大学动物科技学院畜牧站。青贮所使用的菌种来自实验室分离储藏菌种,其中乳酸菌4株、酵母菌3株、芽孢杆菌2株、黑曲霉菌1株。
试验用培养基配方如下:LB 培养基采用10 g 蛋白胨、10 g酵母提取物、10 g氯化钠溶于1 L蒸馏水配置而成。MRS 培养基为:10 g 蛋白胨、15 g 酵母提取物、20 g葡萄糖、5 g牛肉膏、5 g乙酸钠、2 g柠檬酸三铵、2 g KH2PO4、0.25 g MnSO4、0.58 g MgSO4、l ml吐温80溶于1 L蒸馏水,121 ℃高温高压灭菌;查氏培养基采用30 g 蔗糖、2 g 蛋白胨、1 g NaNO3、2 g K2HPO4、0.5 g MgSO4、0.5 g KCl、0.01 g FeSO4溶于1 L 蒸馏水配置而成。试验用PDA 培养基配方为马铃薯去皮洗净后称取200 g切成条形或者块状,蒸馏水煮沸30 min以上,用纱布过滤、再加入20 g 葡萄糖溶于1 L 蒸馏水,121 ℃高温高压灭菌。
1.2 试验设计
试验设计分为对照组(C)和试验组(G),其中试验组分别按照原料的干物质重量添加不同比例的乳酸菌、酵母菌、芽孢杆菌和黑曲霉菌液。为了控制水分含量,各组中添加相应体积的水使每组中加入水分的体积相同。对照组添加等量的水,均匀地喷洒在秸秆上,装入发酵桶中,随机区组设计,每组3 个重复,混合菌种添加比例为0.2%。具体见表1。
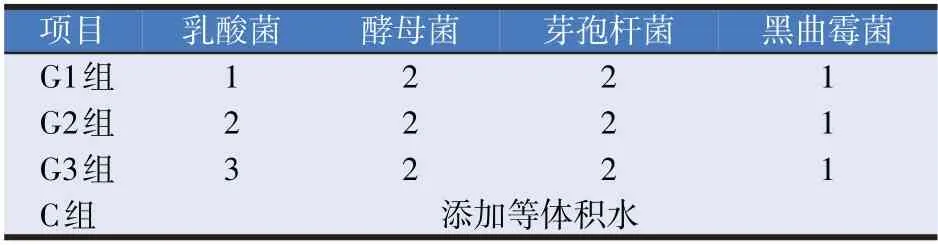
表1 试验设计(%)
1.3 试验方法
将玉米秸秆放入切割机内切成2~3 cm 左右长度,添加如表1所示不同比例的乳酸菌、酵母菌、芽孢杆菌和黑曲霉培养液处理后,以10 kg 为单位装入发酵桶中,压实排除空气密封,置于常温下。于发酵后0、3、7、14、21、28、42 d 和60 d 取样,取发酵到预定时间的青贮饲料,将青贮堆表面5.0 cm左右的一层青贮料去掉后,混匀后采用四分法进行取样,装入自封袋内。取样后,现场进行感官评定,之后在实验室内进行各种成分(干物质、pH 值、粗蛋白质、粗纤维、挥发性脂肪酸和活菌数)的分析。
1.3.1 现场评分
按照我国农业部下发的《青贮饲料质量评定标准》[9],开封时对全株玉米青贮饲料的色泽、气味和质地等感官指标评定,并进行评分。
1.3.2 青贮饲料营养成分测定
利用烘干法检测玉米青贮样本干物质含量:干物质含量(%)=(烘后总重-烘后袋重)×100/烘前样重[10],取50 g 鲜样,置于65 ℃的烘箱中48 h,冷却后称重,粉碎后盛于塑料封口袋中用于粗蛋白质、中性洗涤纤维、酸性洗涤纤维含量的测定。取青贮饲料样品20 g,加入180 ml 蒸馏水密封,4 ℃静置24 h 后,根据青贮饲料理化品质评定标准[11]用pH 计测定pH 值。利用凯氏定氮法测定粗蛋白质的含量。利用范氏法测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量[12]。挥发性脂肪酸用气相色谱法测定[13-14]。活菌菌落数的检验采用生物计数的标准平皿涂布法,将样品稀释至适当浓度,用特定的培养基,在37 ℃培养箱中培养,计数平板中长出的菌落数,对活菌进行计数[15]。
2 结果与分析
2.1 饲用复合菌剂发酵青贮全株玉米的品质评定
根据青贮饲料的质量评定标准,将对照组与试验组进行现场评分,观察得出试验组青贮全株玉米呈酸香味适口性好,亮绿色与黄绿色、质地松软不粘手等,其评分显著高于对照组。具体品质评定指标见表2。
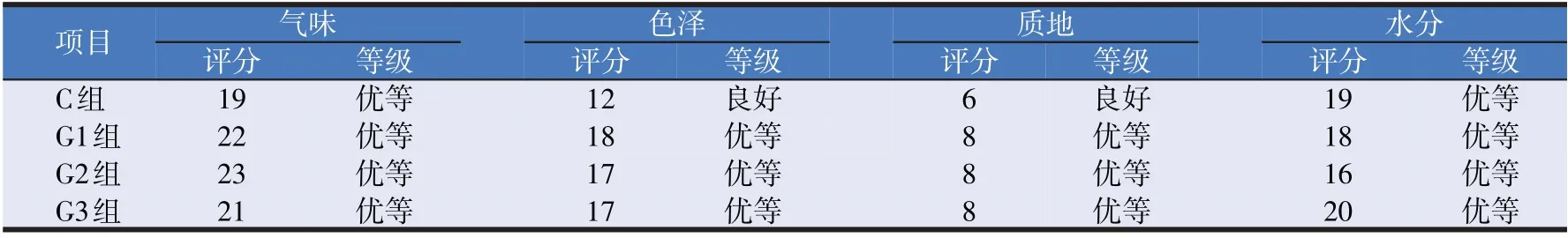
表2 饲用复合菌剂发酵青贮全株玉米品质评定
2.2 青贮全株玉米饲料营养成分测定
2.2.1 饲用复合菌剂发酵青贮全株玉米干物质变化(见图1)
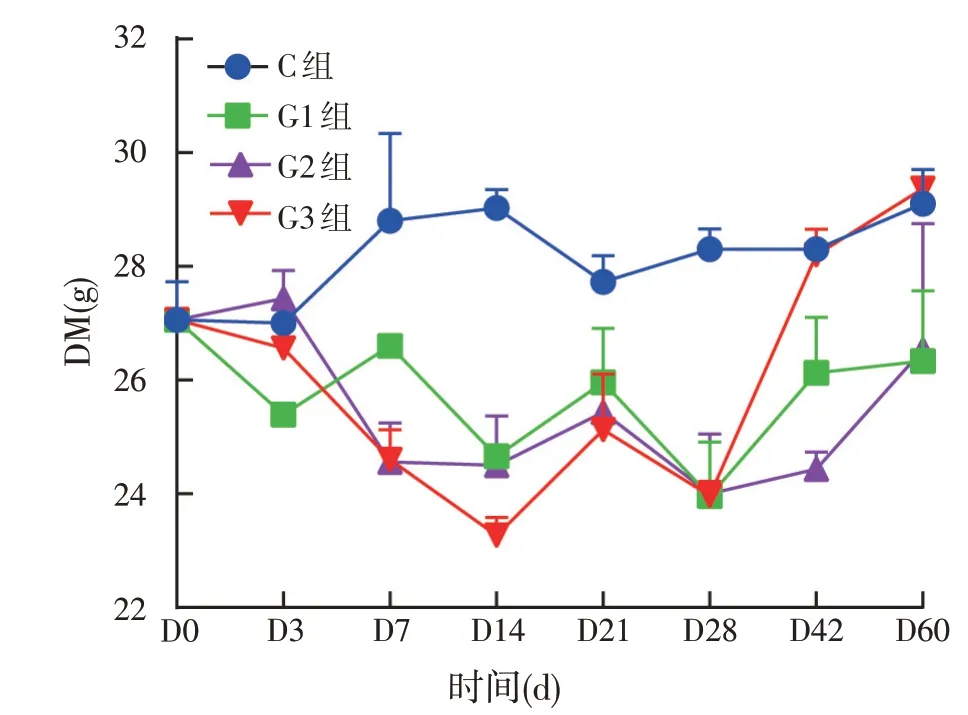
图1 饲用复合菌剂发酵青贮全株玉米干物质变化
如图1所示,在青贮全株玉米的过程中,干物质含量呈现出较强波动变化。其中3个试验组的波动幅度较大,添加复合益生菌使得干物质有轻微的损失。在发酵的3~42 d,添加复合菌剂的发酵青贮全株玉米的干物质含量均小于对照组,且最终差异不显著。
2.2.2 饲用复合菌剂发酵青贮全株玉米pH 值变化(见图2)
如图2所示,在青贮全株玉米发酵前3 d,pH值大幅度下降,第14 d 以后缓慢降低并基本保持稳定,变动范围在3.6~4.5 之间。试验组发酵过程中pH 值变化幅度基本一致,对照组在第42 d 以后pH 值出现升高趋势,各试验组之间pH 值变化差异不显著。在发酵青贮的各个时间点,对照组的pH 值显著高于试验组,保持在4.0以上。
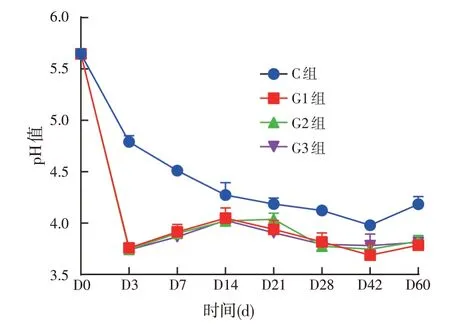
图2 饲用复合菌剂发酵青贮全株玉米pH值变化
2.2.3 饲用复合菌剂发酵青贮全株玉米粗蛋白质的变化(见图3)
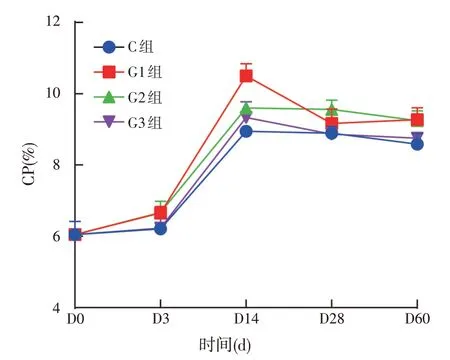
图3 饲用复合菌剂发酵青贮全株玉米粗蛋白质的变化
由图3可得,对照组和试验组粗蛋白质含量在0~14 d 呈现显著上升趋势,第14 d 以后含量降低,第28 d以后含量基本保持稳定。与对照组相比,不同添加比例的复合菌剂对于发酵青贮全株玉米粗蛋白质的含量影响不大,根据ANOVA 单因素分析发现对照组和试验组之间差异不显著,试验组之间含量变化差异不显著,但整体上试验组粗蛋白质含量高于对照组。在青贮第60 d时,各组粗蛋白质含量均超过8%。
2.2.4 饲用复合菌剂发酵青贮全株玉米粗纤维的变化(见图4、图5)
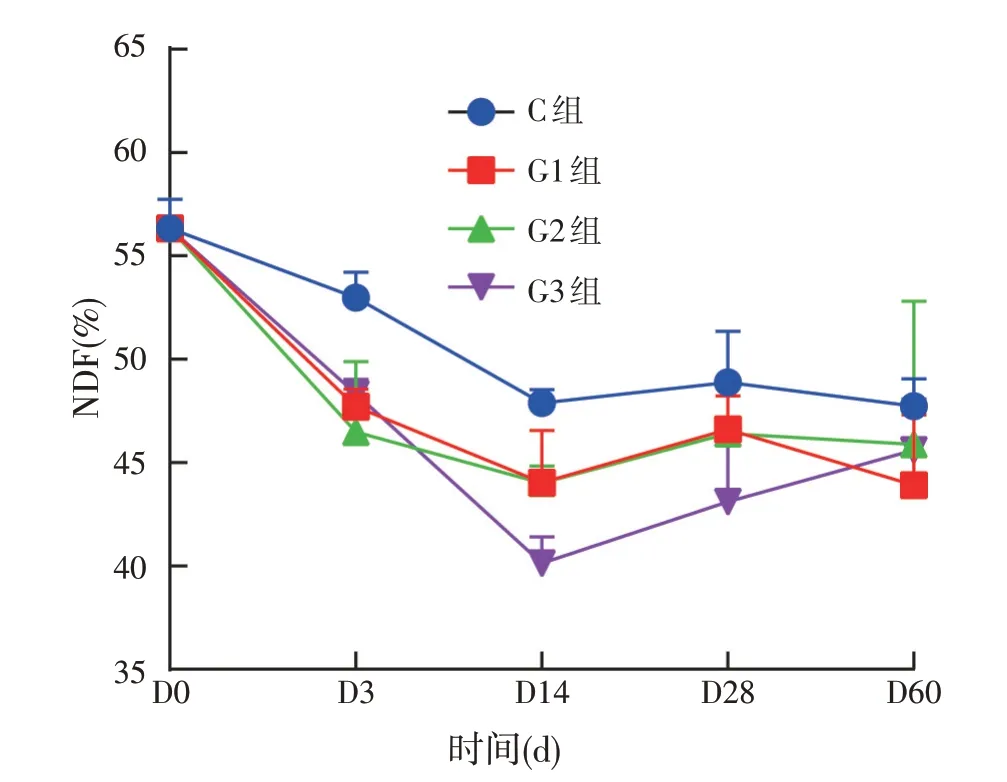
图4 饲用复合菌剂发酵青贮全株玉米中性洗涤纤维变化
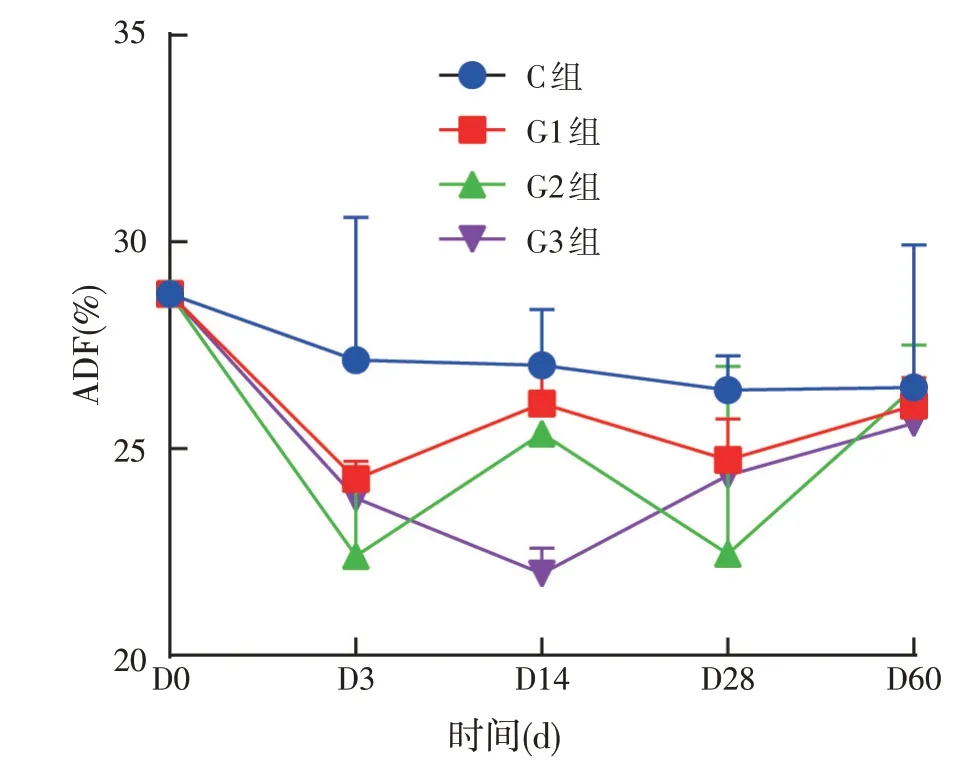
图5 饲用复合菌剂发酵青贮全株玉米酸性洗涤纤维变化
纤维含量的高低直接决定着动物对饲料的利用效率。其中中性洗涤纤维主要包括纤维素、半纤维素、硅酸盐、木质素。酸性洗涤纤维主要包括纤维素和酸性纤维素。通过范氏法系统评价试验中性洗涤纤维和酸性洗涤纤维含量的变化发现:青贮全株玉米中性洗涤纤维含量在0~14 d 出现显著的下降趋势,在14 d 后基本保持稳定。试验组与对照组相比差异显著,其中,G3 组在0~14 d 下降幅度最大。根据ANOVA 单因素分析发现对照组与试验组之间在同一时间点的变化差异显著。具体的变化趋势如图4所示。
如图5所示,青贮全株玉米的酸性洗涤纤维含量在0~3 d 显著降低,之后保持动态的变化过程。就60 d时试验组与对照组相比,差异不显著。说明添加复合益生菌不会导致发酵青贮全株玉米中ADF 的显著降低,但会显著降低NDF含量。
2.2.5 饲用复合菌剂发酵青贮全株玉米挥发性脂肪酸变化(见表3)
有机酸的含量决定青贮全株玉米的品质优劣,其中最重要的指标是乳酸、乙酸和丁酸。优质的青贮全株玉米含有高丰度的乳酸和乙酸,丁酸含量极低。通过气相色谱仪测定不同试验组有机酸含量,更直观地评价复合益生菌剂的添加是否能够显著提高发酵全株玉米的青贮品质。试验结果发现:随时间变化,对照组和试验组乳酸含量明显升高;乙酸含量均明显升高;丙酸含量无明显升高趋势。试验组乳酸含量在第60 d明显高于对照组,总酸量也明显高于对照组,表明试验组的挥发性脂肪酸含量增多。
2.2.6 饲用复合菌剂发酵青贮全株玉米过程中活菌数变化
2.2.6.1 酵母菌变化规律(见图6)
青贮全株玉米中初始酵母菌数为1.3×105CFU/g,由图6 可得前3 d 3 个试验组酵母菌数急速增加,第3 d 以后对照组、G3 组持续增加,而G1、G2 组快速下降,G3组在第7 d以后快速下降,说明前7 d是酵母菌快速增殖期,第7 d 发酵玉米青贮过程中酵母菌数目达到最大。第7 d试验组与对照组的酵母菌数差异显著,试验组的酵母菌数目显著高于对照组,表明添加复合菌剂有助于青贮玉米中酵母菌含量的快速增加。第7 d G3组的酵母菌数目显著高于G1、G2组,表明经不同比例复合菌剂处理后的青贮全株玉米中酵母菌含量变化不同。
2.2.6.2 乳酸菌变化规律(见图7)
发酵青贮全株玉米中初始乳酸菌数为2.0×105CFU/g,由图7 可得青贮初期乳酸菌含量迅速增加,到第14 d以后乳酸菌含量趋于平缓。试验组乳酸菌含量显著高于对照组,表明添加复合菌剂有助于发酵青贮全株玉米中乳酸菌含量的快速增加。多重比较显示乳酸菌含量在前7 d 内试验组之间差异显著,表明经不同比例复合菌剂处理后的青贮全株玉米中乳酸菌含量变化显著。
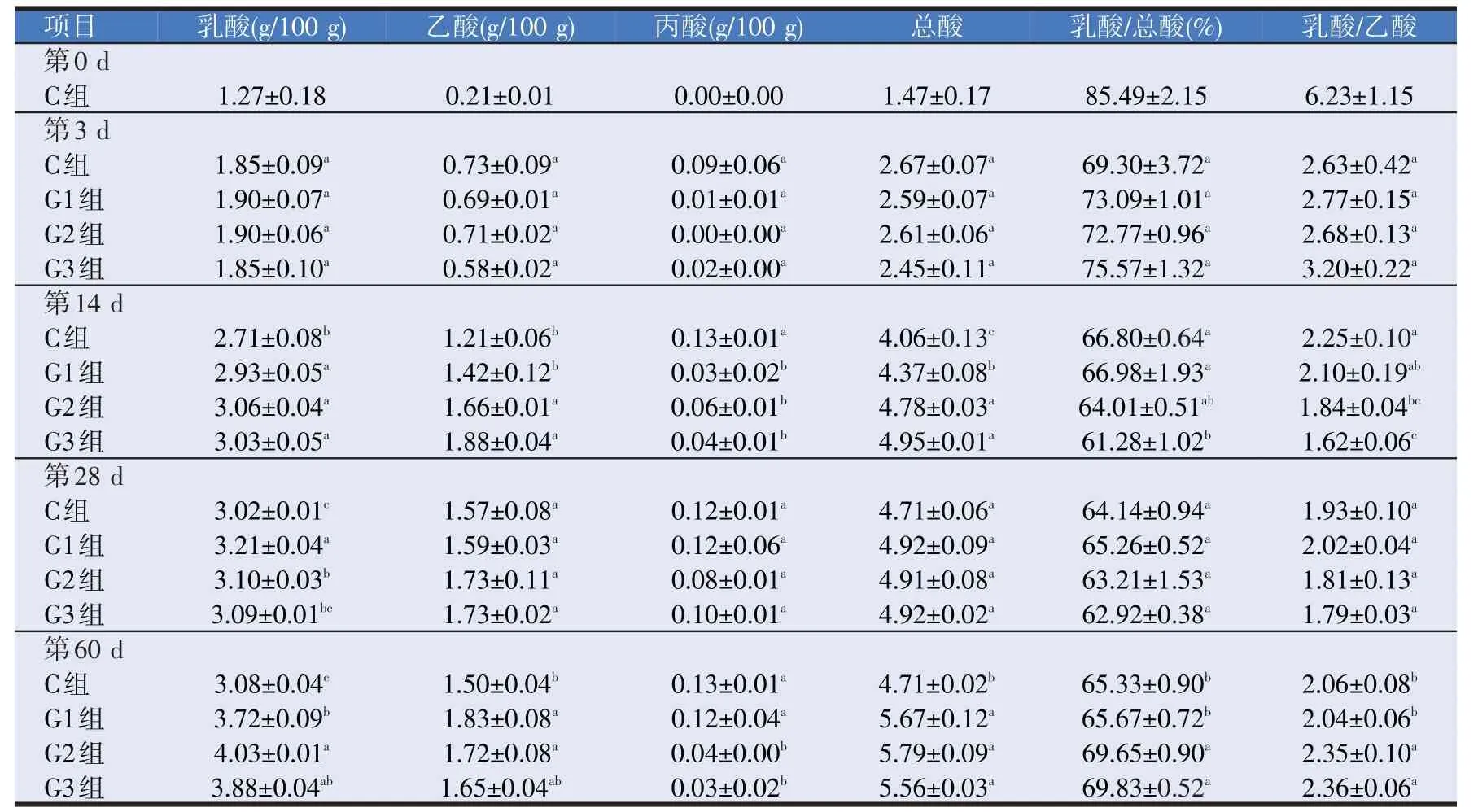
表3 饲用复合菌剂发酵青贮全株玉米挥发性脂肪酸变化
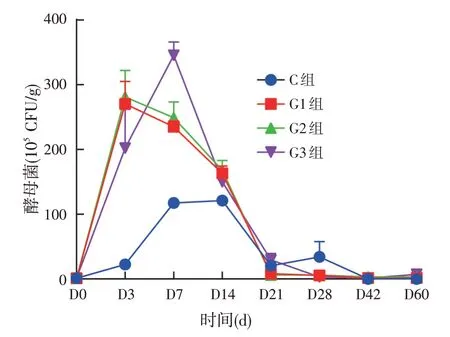
图6 发酵全株玉米青贮过程中酵母菌数变化
3 讨论
本试验利用饲用复合菌剂进行青贮全株玉米的发酵试验,通过检测试验过程中发酵青贮全株玉米的感官指标和营养指标——干物质、pH 值、粗蛋白质、粗纤维、挥发性脂肪酸、活菌数的动态变化来表明添加复合菌剂发酵青贮全株玉米可以显著的提高饲料的品质。与对照相比,添加复合菌剂的发酵青贮全株玉米具有酸香味、较好的口感和良好的色泽和质地,同时提高粗蛋白质和挥发性脂肪酸含量、降低pH 值和NDF 与ADF 含量,该结果与前期相关研究结果一致[8,16-18]。与叶方[19]的研究结果相似的是,在发酵的3~42 d,添加复合菌剂的发酵青贮全株玉米的干物质含量均小于对照组,且最终差异不显著,说明在青贮过程中微生物对原料中营养物质分解较多,干物质有较少比例的损耗。
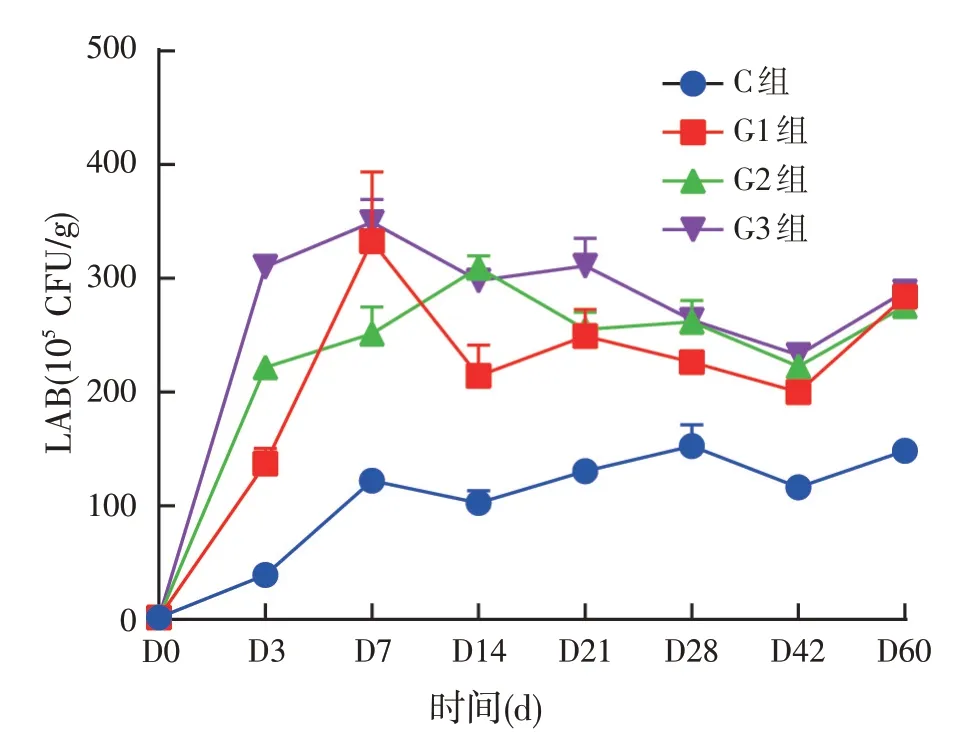
图7 发酵全株玉米青贮过程中乳酸菌数变化
pH 值是评价青贮饲料重要的指标,pH 值越低,酸度越大,说明饲料得到了较好的保存[20]。白元生[21]认为,优良青贮料的pH 值应该在3.8~4.2 之间,当pH值下降到4.0 以下时,乳酸菌等有益菌发挥主要作用,其他各种有害菌被抑制,并且在青贮过程中有大量有机酸产生,其中乳酸菌产生的乳酸和乙酸是青贮过程中pH 值下降的主要因素。本试验中,在发酵的前3 d,青贮全株玉米pH 值大幅度下降,与汪文忠[22]阐述一致。第14 d 以后缓慢降低,变动范围为3.6~4.5。青贮全株玉米发酵时的整体pH 值下降,乳酸菌在发酵的过程中产生乳酸,乳酸使其保持酸性环境,有利于减少有害菌的含量,在60 d 试验组青贮全株玉米pH 值为3.77~3.89,比张淑枝等[23]用乳酸菌剂处理的青贮全株玉米pH 值稍高,闫峻等[24]报道第50 d 玉米全株青贮饲料pH 值为3.59,本试验结果相对也偏高。本研究中对照组pH 值下降幅度显著小于试验组,不同试验组变化不显著,说明不同比例的复合菌剂对青贮全株玉米pH 值的变化影响基本一致。
青贮饲料中的蛋白质通常有很高的瘤胃降解率,粗蛋白质的含量也是衡量青贮饲料品质的一项重要指标。通过上述试验发现,发酵过程中粗蛋白质的含量显著增加,与张淑枝等[23]所报道的一样,与对照组相比,试验组粗蛋白质含量均无显著差异。本试验中,试验组粗蛋白质含量相对于对照组均有增加,第14 d 达到最高峰,之后下降的原因可能是发酵青贮玉米饲料中的微生物开始利用自身粗蛋白质,第28 d 出现小幅度上升可能是由于一些微生物死亡裂解后释放部分菌体蛋白,这与李川东等[25]所报道的一致。
NDF 含量影响饲料的品质,NDF 含量高,青贮玉米适口性差,是目前反映纤维质量好坏的最有效的指标[26]。ADF影响反刍动物对饲料的消化能力,含量越低,饲料的消化率越高。本试验中,在发酵初期复合菌剂中产酶类的菌体产生大量酶类,降解全株玉米中的纤维素,降低了NDF和ADF的含量。在发酵后期,当乳酸菌成为主导发酵的菌体后,乳酸含量增加,pH值降低,原料温度升高,微生物生长被抑制,酶活性降低,所以青贮料发酵14 d 后粗纤维含量变化幅度较小,这说明发酵过程中NDF 和ADF 与微生物的活动变化相一致。复合菌剂处理的试验组青贮全株玉米NDF含量显著低于对照组,其中对照组和试验组均有下降,与田瑞霞等[27]的结果相反,与刘金伟等[16]的结果一致。ADF 含量试验组与对照组相比,差异不显著,李旭业等[28]的研究中ADF 也没有明显的下降。但在王丽学等[29]的研究中,不同微生物菌剂的组合中ADF含量差异显著,而NDF 差异未达显著水平,可能主要与菌种所分泌的纤维素降解酶的种类有关。傅彤[2]的研究中,乳酸菌和纤维素复合酶共同使用使全株玉米青贮(60 d)NDF 和ADF 含量分别减少了15.8%、15.0%,本试验对NDF 的降低效果要优于其研究结果,但对ADF含量的降低效果较差。本试验说明添加此种复合菌剂不会导致青贮全株玉米ADF 的显著降低,但会显著降低NDF含量。挥发性脂肪酸是青贮饲料中可溶性糖厌氧发酵的主要产物,其含量和组成比例是确定青贮饲料发酵特性和评价青贮品质的重要指标[30]。
青贮质量的优劣取决于乳酸菌的作用,并且乳酸是乳酸菌主要的代谢产物[31],它反映了青贮质量的好坏。乳酸也是影响pH值的主要因素,与pH值变化基本一致[32],可以降低pH 值抑制杂菌的生长。本试验中乳酸含量整体呈上升的趋势,试验组乳酸含量始终高于对照组,14 d 以后差异显著,同时也达到稳定水平。有研究发现,添加同型发酵乳酸菌可以促进乳酸发酵,显著增加乳酸含量,加快pH 值的下降,本研究中试验组的乳酸含量始终高于对照组,与其结果一致[33]。杲寿善[34]报道,添加乳酸菌制剂的青贮料比常规青贮料品质进一步提高,适口性好,这也正是由于乳酸含量的提高。本试验中,与G1、G3组相比,G2组的最终乳酸菌含量较高,且与G1组相比差异显著,与G3 组相比差异不显著。乙酸的整体含量升高,且增长速度先快后慢,增速减慢的原因可能是在发酵后期,氧气被耗尽,青贮料温度升高,较高的乳酸含量抑制了乙酸的生成,但最终乙酸含量试验组高于对照组,其中,G1、G2 组显著高于对照组。丙酸由丙酸菌发酵乳酸生成,丙酸的抗真菌效果很强,在抑制青贮饲料的好氧性腐败方面有良好的效果,本试验中丙酸含量各试验组最终含量低于对照组,可能是由于对照组丙酸初始含量高于试验组。
其次,乳酸菌可以在厌氧环境中将碳水化合物转化为乳酸,乳酸菌最适生长的酸度为6.0,最低为4.0[35]。本试验中乳酸菌数在发酵初期迅速升高,减少了腐败菌的生长繁殖,并且在青贮发酵过程中明显高于对照组,一段时间之后缓慢下降,最后趋于平缓,可能是由于营养物质被微生物消耗,随着pH值的降低,乳酸菌的生长被抑制,但试验组乳酸菌总体含量升高,这与任付平[8]试验中乳酸菌数变化结果相似,说明复合菌剂中的其他微生物可以与乳酸菌相互促进生长。酵母菌数在发酵初期均迅速增加,酵母菌数在一段时间之后又迅速下降,最后趋于平缓,试验组酵母菌数始终显著多于对照组。酵母菌数开始增加可能是由于全株玉米最初含水量较为丰富,溢出的汁液较多,加上刚密闭的环境中有氧气残留,故酵母菌数量迅速上升。而当氧气逐渐消耗,乳酸菌和有机酸的积累,酵母菌数开始下降直至最终消失。
综上所述,微生物复合菌剂在一定程度上提高了青贮全株玉米的感官品质并减少了营养损失,提高了饲料的可消化性。不同比例的复合菌剂虽然在整体上对青贮全株玉米的品质的影响一致,但效果仍有显著差异。
4 结论
本次试验采用动态评估的方式表明复合菌剂添加在发酵青贮全株玉米过程中扮演非常重要的作用,并能够有效的降低发酵产物中pH 值与粗纤维的含量,提高粗蛋白质、挥发性脂肪酸的含量和活菌数。经过综合比较分析,乳酸菌、酵母菌、芽孢杆菌、黑曲霉菌的添加比例为3%、2%、2%、1%时发酵过程中各指标综合变化较为理想。
