小白及多糖提取、脱蛋白工艺及抗氧化性研究
2019-09-05宋志姣章金龙罗旺全马前涛
宋志姣,汤 丹,李 悦,章金龙,罗旺全,项 辉,马前涛
保山学院资源环境学院,保山 678000
多糖类化合物是真菌、动物、植物细胞膜和细胞壁的主要成分,研究表明这种高分子聚合物在免疫调节、抑制肿瘤、抗病毒、抗氧化等方面均有显著生物活性[1-3]。多糖类药物毒副作用小、生物活性随着纯度的提高而显著增加[4],我国已有茯苓多糖(国药准字B20050015)等多糖类药物问市。目前,真菌多糖是国内外研究的热点,对药用植物多糖成分的研究较少[5]。对于富含多糖的小白及,其研究主要集中在内生菌[6]、组织培养与快速繁殖[7]、白及属植物鉴定[8]等几个方面。蔡锦源对同属白及Bletillastriata(Thunb.ex A.Murray) Rchb.f.的研究认为:白及多糖和真菌多糖一样具有较好的抗氧化能力[9,10]。
小白及Bletillaformosana(Hayata) Schltr.又名小白芨、三叉白及,是兰科(Orchidaceae)白及属(Bletilla)多年生草本植物[11],以干燥假鳞茎入药,具有消肿止血、收敛和生肌的功效[12]。小白及广泛分布于我国西南各省区,历来为少数民族重要的习用药材[13],其适应能力强、抗逆性好,是易于进行林-药复合经营的药用植物;植株形态优美、花色艳丽,是美丽乡村建设的潜在园林园艺植物。现代医学研究表明小白及含有丰富的白及胶,其中的多糖、联苄类、二氢菲类等是小白及主要药用活性成分[14-16]。本研究以多糖得率为指标,探索微波辅助提取小白及假鳞茎多糖的最佳工艺,并比较3种脱蛋白工艺的效果;初步考察小白及粗多糖和精制多糖的抗氧化活性。研究结果为小白及多糖为主要活性成分的药品和天然食品添加剂的研究应用提供参考,为富含多糖药用植物的综合利用提供借鉴。
1 材料与方法
1.1 材料与试剂
小白及:购于保山市隆阳区农民街药材市场,样品经过保山学院汪建云教授、保山中医药高等专科学院杨发建、广西大学蒙奕奕博士共同鉴定。
无水乙醇、葡萄糖标准品、牛血清蛋白、苯酚、考马斯亮蓝、维生素C、铁氢化钾、DPPH、磷酸二氢钾、磷酸氢二钾、浓硫酸、正丁醇、氯仿、磷酸盐缓冲液、铁氢化钾、三氯乙酸、三氯化铁、Tris-HCl缓冲溶液、邻苯三酚、浓盐酸、茯苓多糖(国药准字B20050015,湖南补天药业有限公司)、胰蛋白酶(酶活力为10 000 U/g,和氏璧生物科技有限公司)等。
1.2 仪器
DHG 9140A烘箱(上海恒一有限公司)、FF-1000A粉碎机(常州市伟嘉仪器制造有限公司)、CP214电子天平(奥豪斯仪器有限公司)、G70F20N2L-DG微波炉(格兰仕微波炉电器有限公司)、HH-4数显电子恒温水浴锅(常州国华电器有限公司)、SHZ-D(Ⅲ)循环水式多用真空泵(上海子华生物科技有限公司)、OSB-2100旋转蒸发仪(上海泉杰仪器有限公司)、TDL 5A离心机(上海安亭)、UV2600紫外-可见分光光度计(日本岛津)、20目标准筛(浙江上虞市道墟五四仪器厂)、YCD-DL259电冰箱(中科美菱低温科技有限公司)、三角瓶、容量瓶等。
1.3 试验方法
1.3.1 小白及多糖提取条件研究
材料预处理:小白及假鳞茎洗净、切片、烘干、粉碎,过20目标准筛后密封备用。单因素实验:精确称取小白及粉末2.000 0 g,置于100 mL三角瓶中,按料液比1∶20(m∶v,g/mL,下同)加入50 ℃温水,其余4个因素设定为微波额定功率700 W的40%,微波时间为60 s,浸提温度80 ℃,浸提时间2 h,固定其中3个因素,依次对微波额定功率700 W的不同百分比(20%、40%、60%、80%、100%)、微波时间(30、40、50、60、70 s)、浸提温度(50、60、70、80、90 ℃)、浸提时间(0.5、1.0、1.5、2.0、2.5 h)进行单因素实验,提取并浸提3次,参考杨翠娴[17]的方法合并、浓缩、沉淀和离心提取物,将离心后所得多糖烘干至恒重,采用称质量法测定小白及多糖的得率,重复3次。
按照下式计算多糖得率:
多糖得率(%)=(多糖干品质量/原料质量)×100%
最优工艺条件正交试验:结合单因素实验结果,参考L9(34)正交试验表进行正交试验,正交试验因素及水平如表1,其余步骤相同。
1.3.2 粗多糖脱蛋白工艺研究
1.3.2.1 脱蛋白工艺
Sevag法脱蛋白工艺参考王琳炜[18]。酶法脱蛋白工艺依次对不同水平的酶解温度(20、30、40、50、60 ℃)、酶加量(0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL)、酶解时间(30、40、50、60、70 min)进行单因实验,酶解后置沸水浴灭酶10 min,常温下离心10 min,5 000 rpm后取上清液测定蛋白含量,探讨不同脱蛋白参数对小白及粗多糖蛋白脱除率及多糖损失率的影响[18];结合单因素实验的结果进行正交试验探讨最佳脱蛋白工艺。酶-Sevag法联用脱蛋白工艺在酶法所得最优条件下进行,离心后的上清液采用Sevag法进行重复多次脱蛋白,直至无明显沉淀,测定蛋白质和多糖的吸光度。

表1 正交试验因素及水平
1.3.2.2 蛋白脱除率和多糖损失率测定
参考文献[18]的方法测定蛋白脱除率,于595 nm波长处测定浓度梯度标准液吸光度(A595nm),以牛血清白蛋白溶液浓度(mg/mL)为横坐标,A595 nm为纵坐标,得一元线性回归方程:Y=17.943X+0.000 5,R2=0.995 9。
蛋白质脱除率按下式计算:
蛋白质脱除率(%)=(Ri-Rj)/Ri×100%
式中:Ri、Rj分别代表所得小白及粗多糖脱蛋白前、后蛋白质含量(mg/mL)。
参考文献[18]的方法测定多糖损失率,于490 nm波长处测定浓度梯度标准液吸光度(A490 nm),以葡萄糖浓度(mg/mL)为横坐标,A490 nm为纵坐标,得一元线性回归方程:Y=10.48X,R2=0.999 1。
多糖损失率按下式计算:
多糖损失率(%)=(Ti-Tj)/Ti×100%
式中:Ti、Tj分别代表所得小白及粗多糖脱蛋白前、后多糖含量(mg/mL)。
1.3.3 多糖抗氧化性研究
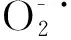
1.4 数据处理
所有数据采用Microsoft Excel 2016绘制图表,用SPSS 16.0对数据进行统计分析。
2 结果与分析
2.1 微波辅助提取小白及多糖
2.1.1 微波功率
测定结果表明,在微波功率小于额定功率的40%时,多糖得率随额定功率百分比的增加而增大;微波功率为额定功率的40%时,多糖得率最大,此时多糖得率为32.50%。微波会使分子的热运动增加,破碎细胞壁,在较短时间内使小白及多糖溶出。当微波额定功率大于40%时,多糖得率显著下降,这可能是由于微波不断增强,部分多糖因过度加热而分解,同时杂质溶出增多,在进行醇沉时小分子糖溶解在95%的乙醇溶液中,从而降低了小白及多糖得率[18]。

图1 额定功率百分比对小白及多糖得率的影响Fig.1 Effect of microwave power percentage on extraction yield of polysaccharide

图2 微波时间对小白及多糖得率的影响Fig.2 Effect of microwave time on extraction yield of polysaccharide
2.1.2 微波时间
微波时间小于40 s时,多糖得率与微波时间呈正比,可能是在提取初期,浓度梯度差大,多糖扩散速率快。微波时间为40~60 s,多糖得率变化缓慢,当微波时间为60 s时,多糖得率最大,为36.17%,可能是浓度梯度差减小,扩散减慢。微波时间大于60 s,多糖得率显著下降,可能是过分加热导致部分多糖水解加大,使多糖得率下降[17]。
2.1.3 浸提温度
浸提温度小于70 ℃,多糖得率与温度呈正比;当浸提温度为70 ℃时,多糖得率达到最大值,为25.33%;浸提温度大于70 ℃,多糖得率显著下降,其原因可能是温度过高造成多糖的降解,温度70 ℃为最佳提取温度。

图3 浸提温度对小白及多糖得率的影响Fig.3 Effect of extraction temperature on extraction yield of polysaccharide
2.1.4 浸提时间
当浸提时间小于2.0 h时,多糖得率随浸提时间的增大而增大,当浸提时间为2.0 h时,多糖得率达到最大值,为30.5%;当浸提时间大于2.0 h时,多糖得率显著下降,其原因可能是长时间浸提使材料糊化,多糖难溶出,故浸提时间2.0 h为最佳。
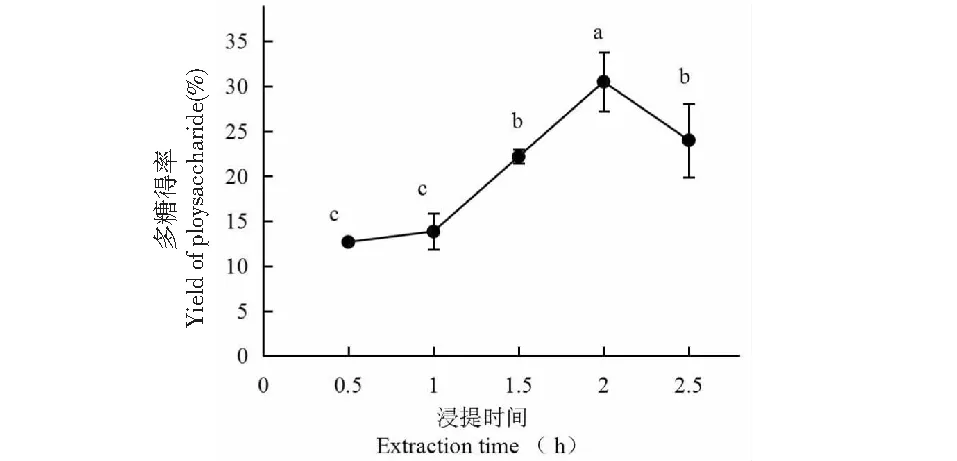
图4 浸提时间对小白及多糖得率的影响Fig.4 Effect of extraction time on extraction yield of polysaccharide
2.1.5 正交试验优化微波辅助提取小白及多糖工艺
正交试验的结果表明,工艺为A2B1C2D3的提取方案小白及多糖得率最高,但是从极差分析的结果来看小白及多糖提取的最佳工艺应为:A2B2C2D3。在相同条件下对A2B1C2D3和A2B2C2D3分别进行3次重复提取实验以验证结果,表明小白及多糖的平均得率分别为37.67%和38.33%,综上所述微波辅助提取小白及多糖的最佳工艺组合为A2B2C2D3,即微波功率为额定功率的40%,微波时间60 s,浸提温度70 ℃,浸提时间2.5 h。
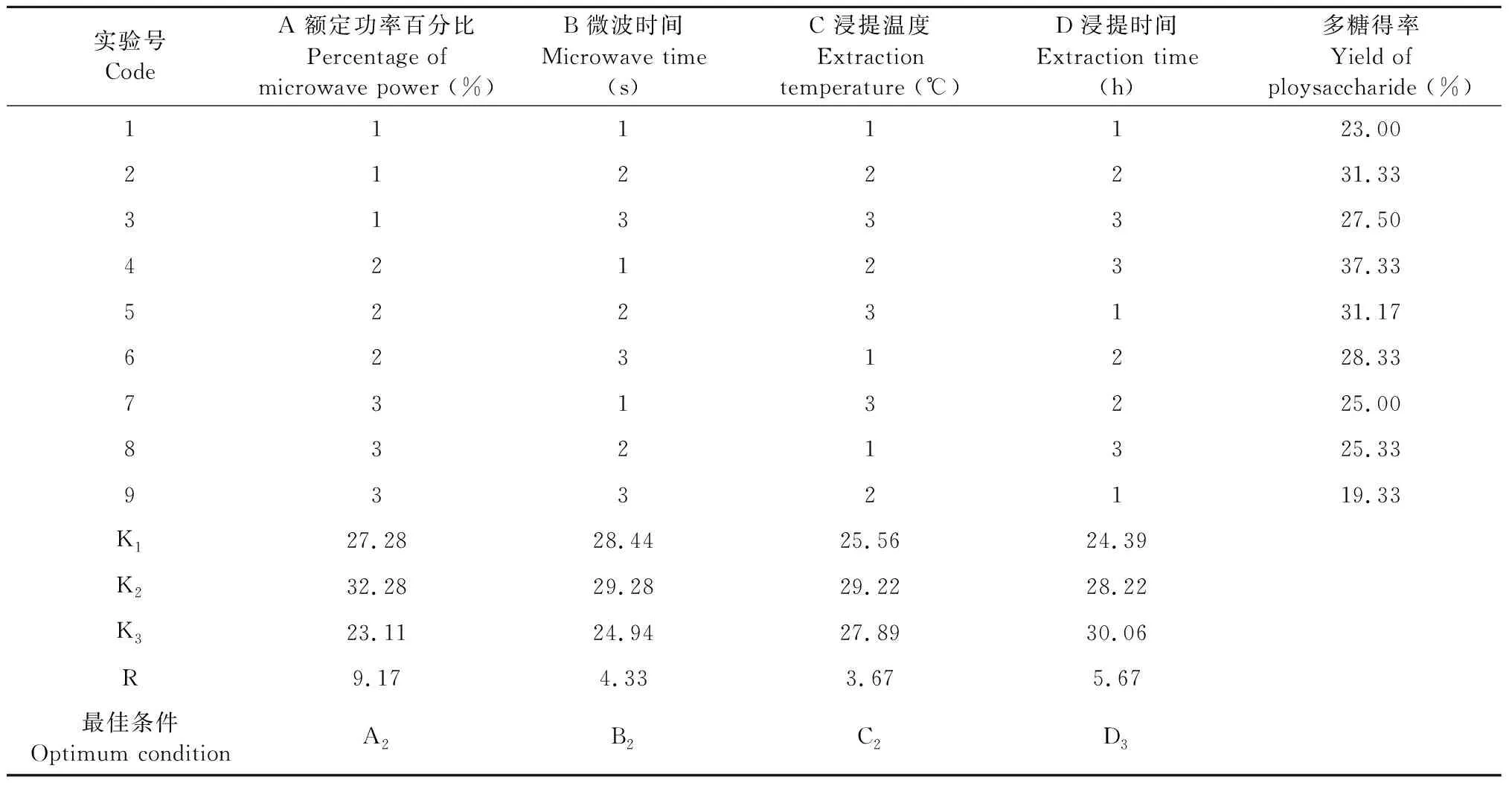
表2 L9(34)正交试验结果
以多糖得率为考察指标(表3),经方差分析可得除了A微波额定功率百分比(%)对多糖得率影响显著以外,B微波时间(s)、C浸提温度(℃)和D浸提时间(h)对多糖得率的影响并不显著,根据显著性可得影响小白及多糖得率的因素顺序为A>D>B>C,即微波额定功率百分比>浸提时间>微波时间>浸提温度。

表3 正交试验结果方差分析
2.2 小白及多糖脱蛋白工艺分析
2.2.1 Sevag法脱蛋白结果分析
小白及粗多糖的蛋白脱除率和多糖损失率随着脱蛋白次数的增加,均呈上升趋势。在第8次处理之后,小白及粗多糖的蛋白质脱除率为81.73%,多糖损失率达31.73%,采用该方法脱去小白及粗多糖中蛋白质的同时,蛋白质的脱除伴随着多糖的损失。

图5 Sevag法脱小白及粗多糖蛋白Fig.5 Efficiency of protein removal by the Sevag method
2.2.2 酶法脱蛋白结果分析
单因素实验结果表明在底物浓度、催化作用接触面积一定的情况下,蛋白质脱除反应不会一直随着酶浓度、酶解时间、酶解温度的增加而增加,酶加量0.5 mL,酶解时间40 min,酶解温度40 ℃的条件下蛋白脱除率最高,在最优单因素条件下小白及粗多糖的蛋白脱除率分别为65.59%、63.43%和67.23%。正交试验结果表明:最佳工艺实验号为6,既A2B3C1D2,但是从极差分析的结果来看小白及多糖提取的最佳工艺应为:A2B2C1D3。在相同条件下对A2B3C1D2和A2B2C1D3分别进行3次重复提取实验以验证结果,两个工艺的综合评分分别为72.58%和73.81%,因此酶法脱蛋白的最佳工艺组合为A2B2C1D3,即酶加量0.5 mL,B酶解时间40 min,酶解温度30 ℃。由极差R分析可知,影响蛋白脱除程度因素按其作用大小排序为B>C>D>A,即酶解时间>酶解温度>酶添加量。方差分析的结果表明(未列出):除了A酶加量(mL)对小白及粗多糖蛋白脱除率影响显著以外,B酶解时间和C酶解温度对蛋白脱除率影响并不显著,根据显著性将影响小白及多糖得率的因素顺序为B>C>A>D,即酶解时间>酶解温度>酶添加量。
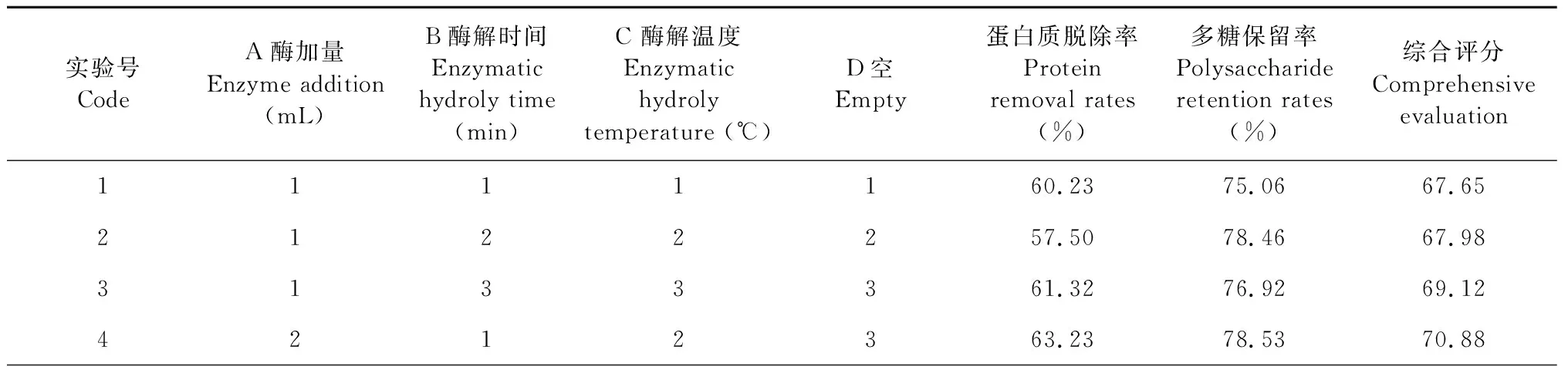
表4 L9(34)胰蛋白酶脱蛋白法正交试验结果
续表4(Continued Tab.4)
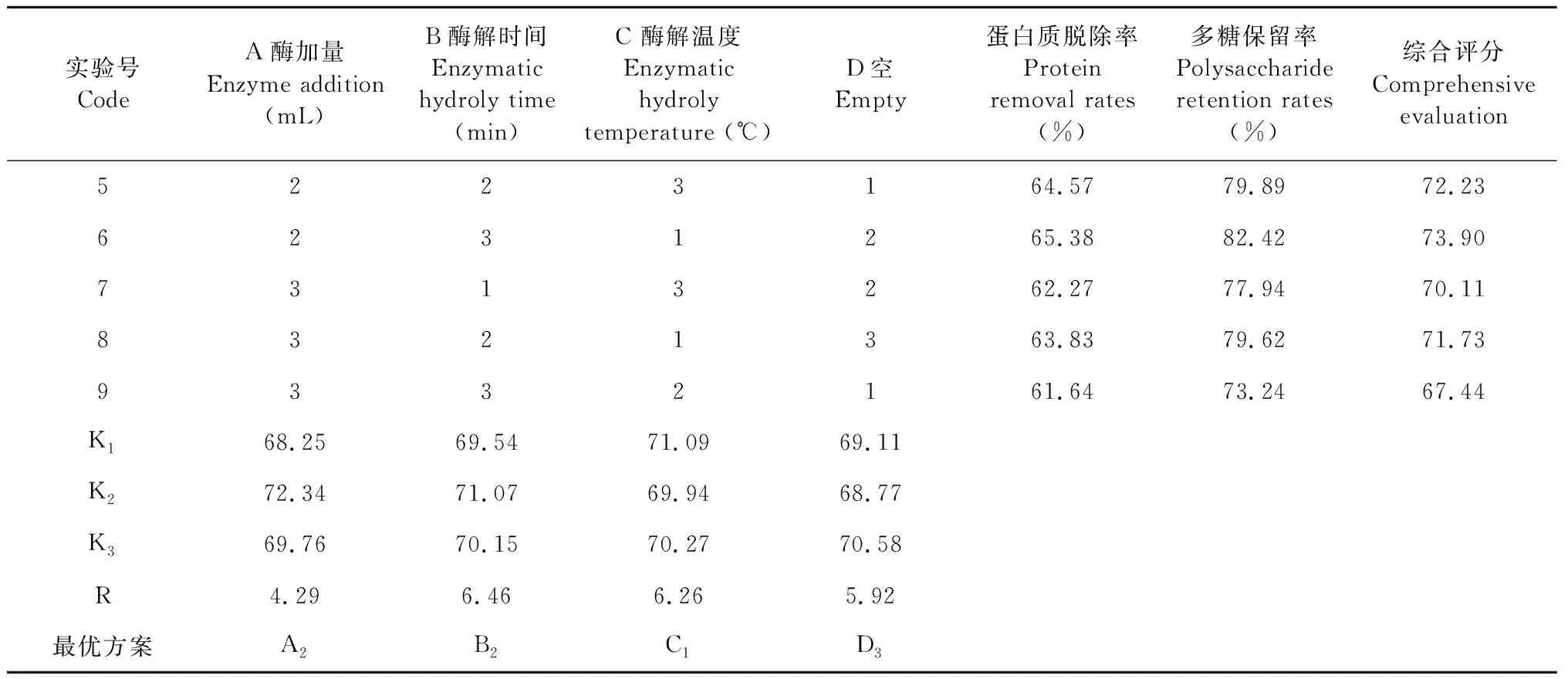
实验号CodeA酶加量Enzyme addition (mL)B酶解时间Enzymatic hydroly time (min)C 酶解温度Enzymatic hydroly temperature (℃)D空Empty蛋白质脱除率Protein removal rates (%)多糖保留率Polysaccharide retention rates (%)综合评分Comprehensive evaluation5223164.5779.8972.236231265.3882.4273.907313262.2777.9470.118321363.8379.6271.739332161.6473.2467.44K168.2569.5471.0969.11K272.3471.0769.9468.77K369.7670.1570.2770.58R4.296.466.265.92最优方案A2B2C1D3
2.2.3 酶-Sevag法联用脱蛋白结果分析
由图6可知,先用酶法处理后蛋白质脱除率为65.38%,多糖损失率为17.58%,脱除次数大于2次以后蛋白质脱除率无明显差异,与之相反多糖损失率仍在增加。因此在第5次处理后停止实验,此时蛋白质脱除率为81.11%、多糖损失率为33.22%。综合考虑蛋白质脱除率和多糖损失率两组数据,酶-Sevag法处理2次时蛋白脱除率较高为80.01%,多糖损失率较低为24.58%。
2.2.4 三种脱蛋白工艺比较
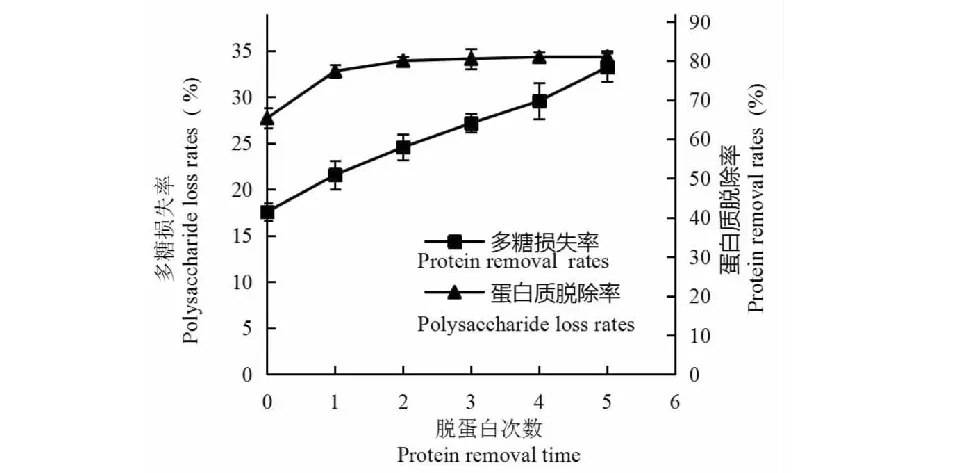
图6 酶-Sevag法脱蛋白Fig.6 Deproteinization efficiency of the combined method

表5 三种脱蛋白工艺最佳参数比较
测定结果表明:采用Sevag法除去小白及粗多糖中的蛋白质,脱除率最高为81.31%,但同时多糖损失率也最高为31.73%;采用酶法除去小白及粗多糖中的蛋白质时,蛋白质脱除率最低为65.41%,同时多糖损失率也最低为17.78%;采用酶-Sevag法时,蛋白质脱除率为80.01%与Sevag法较为接近,同时多糖损失率为24.58%远低于Sevag法的31.73%。采用酶-Sevag法脱去小白及粗多糖中的蛋白质过程中,胰蛋白酶将粗多糖中的蛋白质降解为小分子氨基酸或者多肽,留在溶液中;而分子量较大的多糖则可通过高速离心获得沉淀;再结合Sevag法处理2次,既节约了试剂和时间,又降低了多糖损失率,故酶-Sevag法为小白及粗多糖脱蛋白的最优方法。该方法的参数为:酶加量0.5 mL、酶解温度40 ℃、酶解时间30 min,后置沸水浴中灭酶10 min,取出后离心,上清液采用Sevag法脱蛋白2次。
2.3 小白及多糖的抗氧化性分析
2.3.1 铁还原能力分析
如图7所示,小白及粗多糖、三种方法精制多糖、维生素C和茯苓多糖的铁还原能力皆随浓度的增大而增大,相同浓度的小白及粗多糖、三种方法精制多糖和茯苓多糖的铁还原能力低于维生素C,当浓度达到10 mg/mL时小白及粗多糖在700 nm的吸光度为0.863,Sevag制多糖的为0.583,酶制多糖的为0.763,酶-Sevag制多糖的为0.723,维生素C的为5.602,茯苓多糖的为0.633。同浓度下小白及多糖的铁还原能力低于维生素C,除Sevag法所得多糖以外其余精制方式所得小白及多糖略高于茯苓多糖。
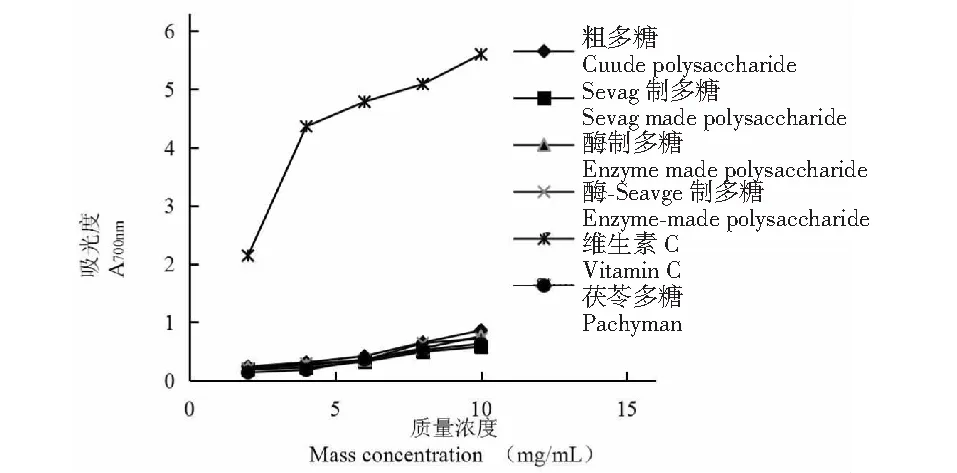
图7 多糖对铁的还原能力Fig.7 Scavenging effect on ferric reducing antioxidant power
2.3.2 DPPH自由基的清除能力
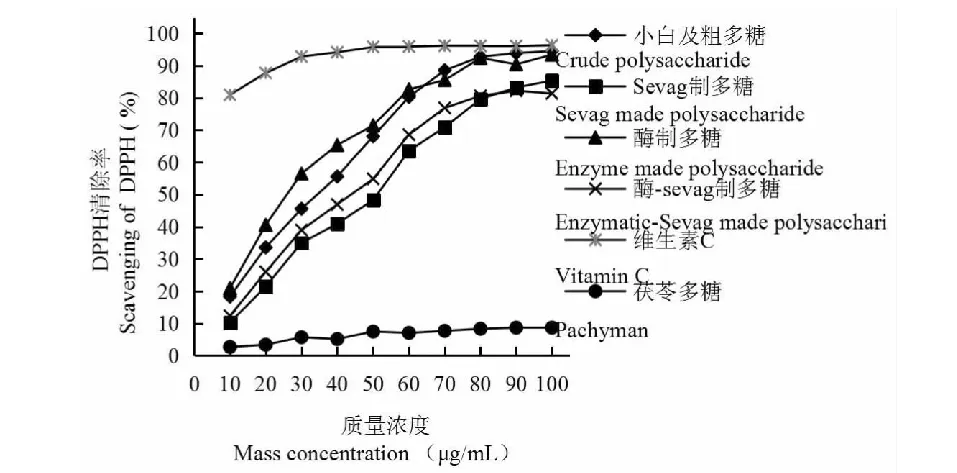
图8 多糖DPPH自由基的清除能力Fig.8 Scavenging effect of WSP on DPPH
5 900.083 μg/mL。说明在相同浓度的情况下,酶法小白及多糖对DPPH自由基的清除能力较好、小白及粗多糖次之。

图9 多糖的清除能力Fig.9 Scavenging effect of WSP on
3 讨论
研究采用微波辅助法提取小白及多糖,在最优工艺条件下小白及多糖的提取率可达38.33%,略高于水提醇沉法提取同属植物白及的粗多糖得率34.7%[22];所得提取物采用Sevag法进行处理时脱蛋白率为81.73%,略高于白及的75.86%[22]。微波辅助提取技术耗时短、效率高,适用于小白及多糖提取,可为植物多糖提取提供参考。
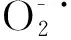
4 结论

致谢:本论文得到保山市第八批创新团队,“药食同源”产品质量及品牌建设研究创新团队项目资助(201911);本论文得到国家留学基金资助。
