CSFV、PRRSV和PCV2多重PCR检测方法的建立及初步应用
2019-09-05兰世捷艳冯万宇王志强朱庆贺金振华
兰世捷 陈 亮 苗 艳冯万宇 王志强 朱庆贺 金振华 李 阳 徐 馨 李 丹
(黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔 161005)
猪繁殖障碍性疾病是危害养猪场尤其是种猪场最为严重的疾病之一,妊娠母猪流产、早产,初生仔猪免疫力差,往往出现弱胎、死胎和木乃伊胎,也有的母猪发生隐性感染不表现任何临床症状[1]。由于母猪的繁殖障碍类疾病隐蔽性强,可发于妊娠期的任何时间,发病猪既能通过环境将其传给其他健康猪,也可通过胎盘将病毒垂直传给胎儿,导致健康猪和新生仔猪发生该类疾病[2]。繁殖障碍类疾病中以猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)和猪圆环病毒2型(PCV2)常见[1],发生这3种疾病的临床症状极为相似。近年来,母猪繁殖疾病以多个病毒混合感染较常见,单纯依据临床症状很难做出确切诊断,传统的血清学、免疫学诊断方法存在操作繁琐、周期长、敏感度差以及检测耗时长等缺点,无法满足目前实验室和临床大批量检测[3]。
多重PCR(multiplex PCR,mPCR),也称为多重引物PCR或者复合PCR,它是在同一个PCR反应体系中加入2对或2对以上引物,从而同时扩增出多个基因片段的PCR反应,也是近些年人类医学、生物医学和动物医学常用的一种分子生物学检测手段。mPCR法具有检测灵敏性高、时间短、节省材料、节约经费等优势,可通过一次反应检测出多个病原,更适合于多种病原混合感染的精确快速诊断[4]。基于兽医科研和临床的需要,且为猪病检测提供一种新的手段,本研究利用多重PCR法建立了一种可以同时检测猪CSFV、PRRSV和PCV2等病毒的新方法。实验室及临床试验表明,该方法操作简单快速、准确性高、时间短,可以一次检测3种病毒,做到确切诊断,为猪繁殖障碍性疾病诊断提供新的手段[5],现将研究结果报道如下。
1 材料与方法
1.1 材料
1.1.1 病毒株和阳性对照
猪瘟病毒、猪繁殖与呼吸综合征病毒、猪圆环病毒2型的阳性毒株均购自上海海利生物技术股份有限公司。
1.1.2 样品来源
猪的病料样品采集于2016—2018年间黑龙江省齐齐哈尔市周边县区及临近内蒙古自治区部分猪场,采集临床表现疑似繁殖障碍疾病的母猪内脏、淋巴结活体组织。每头猪的各组织混合成1份病料。
1.1.3 主要试剂
Trizol Reagent购自Invitrogen公司;dNTP、Taq DNA聚合酶、DNA Marker DL 2 000、5×RT Buffer及M-MLV酶和RNA酶抑制剂购自大连宝生物工程有限公司;琼脂糖购于Biowest公司;DNA及RNA提取试剂盒购于北京世纪元亨动物防疫技术有限公司。
1.2 方法
1.2.1 引物设计与合成
根据GenBank中PRRSV、CSFV 和PCV2的标准参考毒株基因组序列选择保守基因,分别选择PRRSV的ORF7基因、CSFV的E2基因和PCV2的ORF2基因做为扩增靶序列,应用Primer 5.0和Oligo 7.0软件设计3对特异性引物,引物由上海生工生物工程技术服务有限公司合成,用ddH2O稀释,-20℃保存备用,见表1。

表1 多重RT-PCR引物设计结果
1.2.2 DNA和RNA的提取
取疑似病猪的心、肺、脾和淋巴结组织,分别剪取每个组织不同位置的样品放在研磨器中研磨,同时加入适量的生理盐水匀浆后,置于-20℃反复冻融3次,8 000 rpm/min离心3 min,取上清液于1.5 mL灭菌离心管中,分别按照北京世纪元亨动物防疫技术有限公司生产的DNA/RNA提取试剂盒说明书进行操作。将提取好的DNA/RNA检测合格后,置于-20℃保存备用。
1.2.3 RNA病毒模板的制备
取提取好的PRRSV和CSFV的RNA,按照反转录试剂说明书进行反转录。反应体系为20 μL,其中RNA模板 6 μL、random primers 1 μL、2.5 mM dNTP 4 μL、ddH2O 1 μL、65℃ 5 min,冰浴 30 s;buffer 4 μL、0.1 M DTT 2 μL、酶抑制剂 1 μL、37℃ 2 min;MLV 1μL、25℃ 10 min、37℃ 1.5 h、70℃ 13 min。反转录得到的cDNA检测合格后,置于-20℃保存备用。
1.2.4 单项PCR检测方法的建立
根据引物浓度,退火温度条件反复试验最后确定单项PCR最佳反应条件。单项PCR的反应总体系25 μL,取DNA或反转录得到的cDNA模板各2 μL、2.5 mM dNTP 2 μL、10×PCR Buffer(Mg2+) 2.5 μL、上下游引物各 0.5 μL、Taq 0.125 μL,加 ddH2O 补足 25 μL。单项PCR扩增程序按以下步骤:94℃2 min、94℃30 s、54℃30s、72℃1min20s,32个循环,72℃延伸10min。
1.2.5 多重PCR检测方法的建立
以PCV2、CSFV和PRRSV单项PCR反应为基础,对多重PCR各项条件进行优化。多重PCR的反应体积为 25 μL:其中,2.5 mM dNTP 2 μL、10×PCR Buffer(Mg2+) 2.5 μL,模板各1.5 μL,上下游引物各0.5 μL,Taq0.125 μL,然后加 ddH2O 补足 25 μL。按以下步骤进行PCR扩增:94℃2 min、94℃30 s、54℃30 s、72℃1 min 20 s,32个循环,72℃延伸10 min。
1.2.6 多重PCR扩增条件的优化
以提取的DNA和cDNA为模板,采用50℃、52℃、54℃、56℃、58℃、60℃进行PCR扩增,优化退火温度,确定多重PCR扩增最佳退火温度。
1.2.7 多重PCR灵敏性试验
将已知浓度3种病毒核酸混合,用ddH2O做10倍稀释,取每个稀释度的模板进行PCR。
1.2.8 多重PCR特异性试验
采用优化后的PCR体系及程序,分别以CSFV、PRRSV和PCV2,以及3种病毒的DNA或cDNA的混合物为模板;同时,以PRV、PPV、PEDV为阳性对照,以灭菌双氧水为阴性对照,用1.2.5反应体系和程序进行多重PCR。
1.2.9 重复性试验
应用建立的多重PCR,用1.2.5反应体系和程序重复检测的CSFV、PRRSV和PCV2的单一病毒的cDNA或DNA以及DNA与cDNA的混合样品3次,检验结果的可靠性。
2 结果
2.1 PCR扩增
用合成的3对引物分别对CSFV、PRRSV、PCV2进行单项及多重PCR扩增,扩增结果如图1,可观察到204 bp(CSFV)、314bp(PRRSV)、485bp(PCV2)的目的条带,大小与预期相符,阴性对照没有扩增出条带。

图1 单一PCR扩增和多重PCR扩增
2.2 多重PCR退火温度的优化
选取不同的退火温度(50℃、52℃、54℃、56℃、58℃、60℃)进行多重PCR反应。结果显示,不同退火温度对扩增结果影响不大,最终选择54℃作为多重PCR最佳退火温度(图2)。
2.3 灵敏性检验结果
采用优化后的条件来扩增10倍稀释的CSFV、PRRSV和PCV2的cDNA和DNA混合液,测得的多重PCR的最低检测量分别为39.3 pg、55.1 pg和1.32 pg(见图 3)。

图2 多重PCR退火温度的优化

图3 多重PCR敏感性扩增结果
2.4 特异性检验结果
按照已优化的多重PCR反应体系进行特异性试验。结果显示,PRV、PPV和PEDV及阴性对照均未扩增出条带,CSFV、PRRSV和PCV2及3种混合模板可见清晰的条带。通过测序鉴定:这些条带均为目的片段,说明该PCR的特异性较好。
2.5 重复性试验结果
用建立的多重PCR在不同时间对每份阳性样品重复检测3次,结果均一致。说明建立的多重PCR具有较好的稳定性。

图4 多重RT-PCR的特异性扩增结果
2.6 多重PCR对临床样品的检测结果
对96份疑似繁殖障碍病的母猪组织样品进行多重PCR检测,结果显示,8份样品检出CSFV,24份样品检出PRRSV,75份样品检出PCV2;其中24份样品为PCV2和PRRSV混合感染,8份样品为PCV2和CSFV的混合感染。多重PCR检测结果与单一RT-PCR检测结果完全相符(表2)。
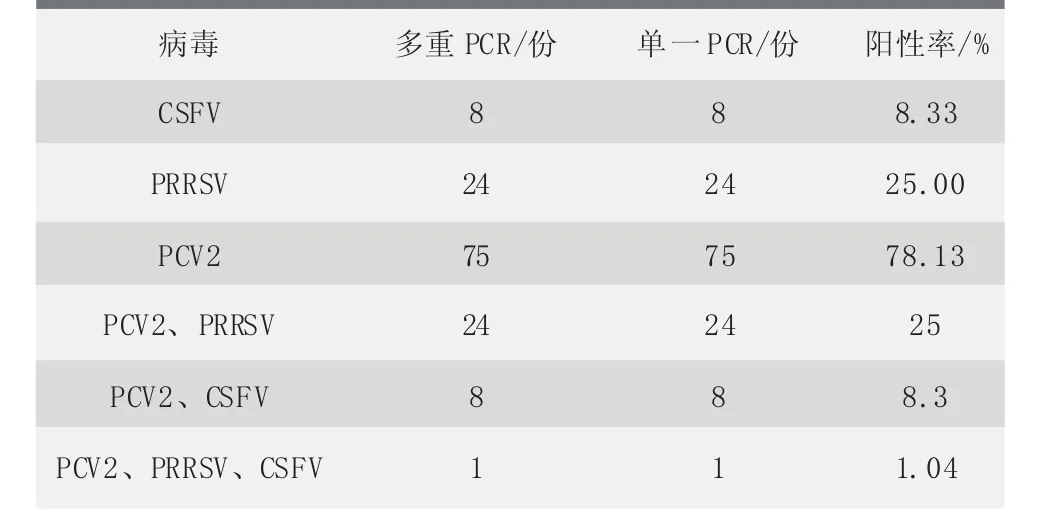
表2 96份病猪样品经多重PCR及单一PCR的检测结果
3 讨论
近年来,文献及临床病料检测结果表明,规模化猪场所发生的母猪繁殖障碍性疾病大多为混合感染[6],此类疾病中CSFV、PRRSV和PCV2是较为常见的病原,其中PCV2在猪场中普遍存在,临床检测阳性率极高。
多重PCR反应中,引物设计的好坏决定着多重PCR反应的成败[3]。设计引物时,所选基因片段中G+C含量应在55%~60%,引物长度为20~21 bp,所扩增的基因片段长度容易区分,退火温度相近,以确保不同引物在同一温度下均能扩增成功,并便于琼脂糖凝胶电泳的观察分辨。应用多重PCR方法对96份可疑病料进行检测,结果表明,在检查的96份病料中,PCV2与PRRSV混合感染占比为25%,PCV2与CSFV混合感染占比为8.33%,PCV2、PRRSV和CSFV 3者混合感染占比为1.04%。说明目前3种病毒对猪群的感染率较高,且多以混合感染为主。
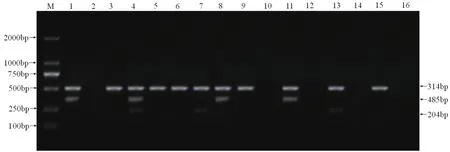
图5 多重PCR对部分临床样品的检测
4 小结
试验通过自行设计3对引物,建立了同时检测PCV2、PRRSV和CSFV 3种病毒的多重PCR,该PCR可同时扩增出204 bp(CSFV)、314 bp(PRRSV)和485 bp(PCV2)的目的条带,为3种病毒检测增加了一个新的渠道。该检测方法对种猪场的实时监控、净化种猪群和推广优良种猪具有重要意义[3]。
