尖孢镰刀菌的分离鉴定及不同苜蓿品种芽期抗病性
2019-09-04刘香萍敬雪敏闫红秀罗英花许美花
刘香萍 敬雪敏 闫红秀 罗英花 许美花


摘要 为了解黑龙江省大庆市苜蓿根腐病的病原,评价不同苜蓿品种芽期对根腐病的抗病性,于2018年采集疑似感染根腐病的苜蓿病株,对其进行了病原分离与鉴定。将鉴定得到的致病菌接种于18个品种的紫花苜蓿幼芽,测定相对根长、相对苗长、发病率和病情指数,利用隶属函数进行抗病性综合评价。形态学和rDNA-ITS序列分析结果表明,分离获得的致病菌为尖孢镰刀菌Fusarium oxysporum,其对不同苜蓿品种芽期相对根长、相对苗长、发病率和病情指数均有显著影响(P<0.05)。说明尖孢镰刀菌对苜蓿有较强致病性。抗病性综合评价表明: 不同苜蓿品种芽期对尖孢镰刀菌根腐病抗性由强到弱依次为:‘龙牧801 > ‘斯贝德 > ‘SK3010 > ‘巨能-CR >‘肇东> ‘DS310FY > ‘WL168HQ > ‘WL354HQ> ‘TG4> ‘WL319HQ> ‘擎天柱 > ‘WL298HQ > ‘龙牧806 > ‘北极星 > ‘皇后 > ‘北极熊 > ‘CW2000 > ‘敖汉。
关键词 苜蓿; 根腐病; 尖孢镰刀菌; 分子鉴定; 抗病性
中图分类号: S 435.4
文献标识码: A
DOI: 10.16688/j.zwbh.2018428
Abstract In order to understand the pathogens of alfalfa root rot in Daqing of Heilongjiang province, and to evaluate the resistance of different alfalfa varieties to root rot during the bud stage, the alfalfa roots showing symptoms of root rot were collected, and pathogens were isolated and identified in 2018. Based on morphological characteristics and rDNA-ITS sequence analysis, the pathogen was identified as Fusarium oxysporum. The pathogen was inoculated into alfalfa sprouts of 18 varieties. The relative root length, relative seedling length, morbidity and disease index were measured to evaluate disease resistance by comprehensively analyzing subordinative function. The results showed that F.oxysporum had significant effects on relative root length, relative seedling length, morbidity and disease index of different alfalfa varieties (P<0.05) during the bud stage,indicating that F.oxysporum had strong pathogenicity to alfalfa. The comprehensive evaluation of disease resistance showed that the resistance order of alfalfa varieties during the bud stage to F.oxysporum from strong to weak was ‘Longmu 801>‘Sibeide>‘SK3010>‘Juneng-CR>‘Zhaodong>‘DS310FY>‘WL168HQ>‘WL354HQ>‘TG4>‘WL319HQ>‘Qingtianzhu>‘WL298HQ>‘Longmu 806>‘North Star>‘Queen>‘Polar Bear>‘CW2000>‘Aohan.
Key words alfalfa; root rot; Fusarium oxysporum; molecular identification; disease resistance
紫花苜蓿Medicago sativa L.屬豆科多年生草本植物,是世界上种植最为广泛的牧草之一,它具有产量高、适应性强、营养丰富、草质优良、家畜易于消化等特点,其营养价值居牧草之首,有“牧草之王”的美誉[1]。紫花苜蓿根系发达,一次种植可利用多年,可用于生态恢复改良干旱和轻度盐碱土壤。但因利用年限较长,根腐病不仅影响当年苜蓿产量,对第2年返青及其多年生特性都有较大影响,已成为苜蓿产量下降和植株衰败的一个极其重要的原因[23]。根腐病是世界性病害,几乎所有苜蓿产区都有发生。据估计,每年全世界由根腐病造成的产量损失在20%左右,有些严重发生的地块甚至达到40%[45]。根腐病是由镰刀菌引起的土传真菌病害[6],2003年,李敏权等[7]在对甘肃定西苜蓿根腐病病原的研究中发现了3种镰刀菌,即尖孢镰刀菌F.oxysporum、锐顶镰刀菌F.acuminatum和半裸镰刀菌F.semitectum,这是我国首次有关根腐病病原的系统的研究报道。尖孢镰刀菌是苜蓿根腐病主要致病菌,它不仅可以在宿主植物中存活,还可在土壤和空气中存活达10年以上,表现出很强的致病性[8]。目前,苜蓿种苗对尖孢镰刀菌的抗病性方面缺乏系统性研究。本试验在形态学观察的基础上,结合分子生物学手段,测定了18个紫花苜蓿品种芽期对尖孢镰刀菌的抗病性,以期为苜蓿抗根腐病品种的筛选提供参考依据。
1 材料与方法
1.1 菌株与苜蓿品种来源
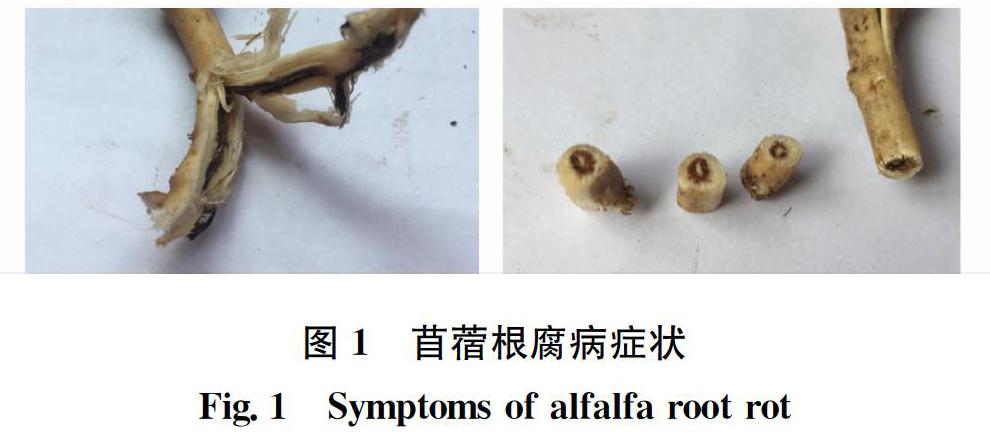
2018年6月在黑龙江八一农垦大学动物科技学院草业科学系苜蓿试验田进行了根腐病调查采样,苜蓿品种为‘龙牧801。将田间疑似病株挖出,并将主根维管束变褐坏死的根腐病根样品(图1)带回实验室进行致病菌分离与鉴定。
供抗病性评价苜蓿品种共18个,分别为‘CW2000、‘DS310FY、‘SK3010、‘WL168HQ、‘WL298HQ、‘WL319HQ、‘WL354HQ、‘敖汉、‘北极星、‘北极熊、‘皇后、‘巨能-CR、‘龙牧801、‘龙牧806、‘TG4、‘擎天柱、‘斯贝德和‘肇东,均由黑龙江省畜牧研究所提供。
1.2 病原菌分离纯化
病原菌分离采用常规组织分离法进行,通过在PDA培养基上培养、纯化获得分离菌株。再经过平板涂布法进行单孢分离,用斜面PDA培养基4℃冰箱中保种,待用。
1.3 病原菌形态学观察
待菌丝长成菌落之后,依据Booths镰刀菌分类标准[9]在显微镜下观察菌丝和分生孢子形态、厚垣孢子的有无及着生方式,并用测微尺测量孢子大小,同时进行显微照相。
1.4 病原菌致病性测定及再分离纯化
根据柯赫氏法则,将单孢分离的菌株回接至健康的成株‘龙牧801,植株发病症状与田间自然发病症状一致,从症状完全一致的植株上分离、纯化病原菌至PDA培养基,观察再次分离、纯化的菌株与接种菌株形态是否一致,形态一致的菌株为目标病原菌。
1.5 病原菌分子生物学鉴定
在形态学特征鉴定的基础上,采用DNA提取试剂盒(OMEGA-D3390-01,OMEGA公司)提取菌株DNA。采用rDNA-ITS区通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。PCR反应体系为25 μL,2×Taq Master Mix 12.5 μL,DNA模板为1 μL,上下游引物各0.3 μL,ddH2O 10.9 μL。反应程序为94℃预变性3 min;94℃变性30 s,54℃退火30 s;72℃延伸1 min,35个循环;72℃延伸5 min。PCR产物经1.0%的琼脂糖凝胶电泳检测。引物由生工生物工程(上海)股份有限公司合成,扩增产物送交该公司测序。
获得的rDNA-ITS序列与GenBank数据库(http:∥www.ncbi.nlm.nih.gov/blast)中的镰刀菌rDNA-ITS序列进行比较,利用MEGA 5软件进行聚类分析,构建进化树。
1.6 不同苜蓿品种芽期抗病性比较
1.6.1 病原菌接種
在PDA培养基上培养病原菌,1周后加5 mL无菌水至培养基上,用手术刀刮取菌丝,双层无菌纱布过滤菌丝,再加5 mL无菌水冲洗培养基表面残留的菌丝,滤液即为孢子悬浮液,浓度为1×106个/mL。挑选各苜蓿品种中优质的种子约200粒,在无菌条件下用75%乙醇浸泡2 min,再用1%次氯酸钠浸泡5 min,无菌水冲洗5次,无菌滤纸吸干种子表面水分,将种子均匀放置在放有双层滤纸的9 cm无菌培养皿中,添加适量无菌水使种子吸饱水分进行催芽。1~2 d后种子萌发,幼芽约1 cm时,挑选长势一致的幼芽放置在新的放有双层滤纸的9 cm无菌培养皿中,每皿25粒。每个苜蓿品种分为A、B两组,每组3个重复,A组为处理组,每皿注射3 mL的孢子悬浮液; B组为对照组,每皿注射3 mL无菌水。每天适量添加无菌水,保证幼芽吸水饱满。待接种14 d后,测定根长、苗长和发病株数,根据病斑占根系面积的百分比进行病害分级。分级标准为: 0级,无症状; 1级,根部变细; 2级,根部病斑面积小于等于1/2; 3级,根部病斑面积大于1/2; 4级,全株腐烂(图2)。
1.6.2 测定指标
相对根长=(菌液处理组根长/对照组根长)×100%;
相对苗长=(菌液处理组苗长/对照组苗长)×100%;
发病率=(病株数/总株数)×100%;
病情指数=∑(各级病株数×该级代表值)/(总株数×最重级别代表值)×100。
1.6.3 数据处理
运用隶属函数对各指标进行标准化处理[10]。当指标与抗病性呈正相关用公式(1),当指标与抗病性呈负相关用公式(2)。
1.7 数据统计分析
采用SPSS 22.0软件对数据进行方差分析。
2 结果与分析
2.1 病原菌形态学鉴定
菌株在PDA培养基上25℃培养7 d后菌落直径为62.3~68.0 mm,气生菌丝茂盛呈白色絮状(图3a),培养基底部为黄白色,气生菌丝有隔,且具有侧生分枝(图3b)。不易产生小型分生孢子,无隔膜,大小(3.0~9.5)μm×(0.9~2.0)μm;产生的大型分生孢子(图3c)多呈纺锤形,细长,顶端微微弯曲,一般具有3~5个隔膜,大小(10.0~15.5)μm×(3.5~2.1)μm。培养后期,容易生成厚垣孢子(图3d),菌丝膨大。依据形态学特征,将该菌株鉴定为尖孢镰刀菌。
2.2 病原菌分子生物学鉴定
菌株经提取DNA,利用ITS引物进行PCR扩增后,经琼脂糖凝胶电泳检测得到大小约560 bp的片段(图4)。所获得的序列在NCBI数据库进行BLAST比对,发现该病原菌与登录号为MG136705等尖孢镰刀菌的ITS序列同源性为99%~100%。
在基于rDNA-ITS区序列构建的系统发育树中(图5),病原菌与NCBI数据库中的尖孢镰刀菌聚为一类,而与其他菌种距离较远,表明该病原菌属于尖孢镰刀菌。
2.3 不同苜蓿品种芽期抗病性评价
2.3.1 尖孢镰刀菌对18个苜蓿品种芽期相对根长和相对苗长的影响
受尖孢镰刀菌侵染后,苜蓿芽期的相对根长和相对苗长呈现下降趋势,在一定程度上反映了苜蓿接种病原菌后的抗病性强弱,并且不同品种间存在显著性差异(P<0.05)。从图6可知,各品种相对根长在0.39~0.96之间。其中相对根长小于0.5的有‘敖汉、‘皇后和‘北极熊,相对根长分别为0.39、0.40和0.41;大于0.95的有‘斯贝德,相对根长为0.96;其他品种的相对根长在0.5~0.95之间。各品种的相对苗长在0.48~0.98之间。其中相对苗长小于0.5的有‘敖汉,相对苗长为0.48;大于0.95的有‘巨能-CR和‘WL354HQ,相对苗长分别为0.95和0.98;其他品种的相对苗长在0.5~0.95之间。
2.3.2 18个苜蓿品种芽期根腐病发病率
不同品种苜蓿芽期的发病率存在显著差异(P<0.05)。从图7可知,发病率在66.67%~100%之间,其中发病率最低的为‘龙牧801,发病率为66.67%; 而發病率达到95%的有6个苜蓿品种,分别为‘敖汉、‘CW2000、‘龙牧806、‘北极星、‘北极熊和‘皇后。
2.3.3 18个苜蓿品种芽期病情指数
不同苜蓿品种芽期对病原菌的抗性存在显著差异。从图8可知,各品种的病情指数变化范围在25~68之间。病情指数在30以下的是‘龙牧801,其病情指数为25;病情指数在60以上的品种有:‘北极星、‘皇后、‘北极熊、‘CW2000和‘敖汉,‘敖汉的病情指数最高,为68。
2.3.4 18个苜蓿品种芽期对尖孢镰刀菌抗病性综合评价
以18个苜蓿品种芽期的相对根长、相对苗长、发病率和病情指数4个指标作为依据,采用隶属函数法结合各指标的权重系数,综合评价这18个苜蓿品种芽期对尖孢镰刀菌的抗病性(表1)。D值代表抗病性的强弱,D值越大抗病性越强。排序结果表明,18个苜蓿品种芽期抗病性的强弱顺序依次为‘龙牧801>‘斯贝德>‘SK3010>‘巨能-CR>‘肇东>‘DS310FY>‘WL168HQ>‘WL354HQ>‘TG4>‘WL319HQ>‘擎天柱>‘WL298HQ>‘龙牧806>‘北极星>‘皇后>‘北极熊>‘CW2000>‘敖汉。
3 讨论
镰刀菌形态复杂,易受外界环境影响发生变异,通过形态学观察很难准确鉴定到种。本研究用形态学和分子生物学结合的方式,对样本菌株进行鉴定。其中的分子生物学用到的rDNA-ITS是介于18S rDNA、5.8S rDNA和28S rDNA之间的区域,该区域被普遍用来进行真菌种间或种内遗传相似性的分子系统研究[1113]。
关于苜蓿苗期根腐病抗病性评价,黄宁等[14]用尖孢镰刀菌接种了62个苜蓿品种的无菌苗,聚类分析得到了抗病品种4个、中抗品种31个、感病品种27个;辛宝宝等[15]用尖孢镰刀菌对60份紫花苜蓿种质材料进行苗期对根腐病抗病性评价,通过计算发病率和病情指数,并测定株高、地上生物量及地下生物量,得出12份耐病材料、34份感病材料、14份高感材料,无免疫和抗病材料,它们的发病率范围是3.33%~100%,病情指数范围为25.92~82.78;潘其龙等[16]用拟枝孢镰刀菌接种测定30个紫花苜蓿品种苗期抗性,结果表明不同品种间抗性差异显著,病情指数在30.67~64.67。关于苜蓿种苗期抗病性评价,郭玉霞等[17]将锐顶镰刀菌接种于14个紫花苜蓿品种的种子上进行种苗期对根腐病抗病性评价,通过测定相对根长、苗高、发病率,并计算病情指数,得出1个品种抗病性最强、4个品种抗病性较强、5个品种抗病性较弱、1个品种抗病性最弱,它们的病情指数范围为8.58~63.12;孔前前等[18]用150株镰刀菌侵染‘中苜1号苜蓿种子,测定其发病率及病情指数来评价镰刀菌的致病性。其中尖孢镰刀菌的病情指数范围为51.67~78.00。而苜蓿种子自身存在发芽率的问题,本试验对苜蓿种子进行催芽后接种尖孢镰刀菌,避开了苜蓿种子由于种子休眠、未受精、不完整、包衣过厚而影响试验准确性的问题,降低了误差。本试验对18个苜蓿品种芽期进行尖孢镰刀菌根腐病抗性评价,得出发病率范围为66.67%~100%,病情指数变化范围为25~68。这与辛宝宝等[15]、孔前前等[18]的试验虽然接种的菌种相同,但因接种时期和苜蓿品种的不同而导致病情指数存在较大差异。
4 结论
本研究从苜蓿根腐病病组织中分离得到病原菌,形态学鉴定结果与基于ITS序列的分子生物学鉴定结果一致,确定所分离病原菌为尖孢镰刀菌。18个苜蓿品种在芽期对其抗病性存在差异,由强到弱依次是‘龙牧801>‘斯贝德>‘SK3010>‘巨能-CR>‘肇东>‘DS310FY>‘WL168HQ>‘WL354HQ>‘TG4>‘WL319HQ>‘擎天柱>‘WL298HQ>‘龙牧806>‘北极星>‘皇后>‘北极熊>‘CW2000>‘敖汉。
参考文献
[1] 赵燕梅,钟华,崔志文,等.不同品种、刈割时期苜蓿的营养特性[J].草业与畜牧,2015(1):1722.
[2] 孟悦,徐博,陈晶晶,等.紫花苜蓿根腐病及其防治方法的研究进展[J].江西农业,2017(23):30.
[3] 丛丽丽,康俊梅,张铁军,等.苜蓿镰刀菌根腐病病原菌的分离鉴定与致病性分析[J].草地学报,2017,25(4):857865.
[4] 李万苍,李文明,孟有儒.苜蓿根腐病菌(Fusarium solani)生物学特性研究[J].草业学报,2005(4):106110.
[5] 郭玉霞,管永卓,张金锋,等.根腐病原镰刀菌苜蓿品种土壤水分互作对种苗生长的影响[J].草地学报,2015,23(3):623631.
[6] 铁男.苜蓿根腐病如何防治[J].农药市场信息,2018(17):48.
[7] 李敏权.苜蓿根和根颈腐烂病病原致病性及品种抗病性研究[J].中国草地,2003(1):4044.
[8] WU Hongsheng, ZHOU Xiaodong, SHI Xue, et al. In vitro responses of Fusarium oxysporum f.sp. niveum to phenolic acids in decaying watermelon tissues [J]. Phytochemistry Letters, 2013, 8: 171178.
[9] BOOTH C.镰刀菌属[M].陈其煐译.北京:农业出版社,1988.
[10]辛宝宝, 袁庆华, 王瑜, 等. 不同苜蓿材料对木贼镰刀菌根腐病的抗病性评价[J]. 植物保护, 2016, 42(5): 158164.
[11]SAMPIETRO D A, MARIN P, IGLESIAS J, et al. A molecular based strategy for rapid diagnosis of toxigenic Fusariumspecies associated to cereal grains from Argentina [J]. Fungal Biology, 2010, 114: 7481.
[12]SCHOCH C L, SEIFERT K A, HUHNDORF S, et al. Nuclear ribosomal internal transcribed spacer (rDNA-ITS) region as a universal DNA barcode marker for fungi [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(16): 62416246.
[13]劉晓倩,祁建民,陈玉森,等.中国红麻炭疽病病原菌的分离鉴定及rDNA-ITS序列分析[J].中国农业科学,2012,45(17):35153521.
[14]黄宁,孙鑫博,王铁梅,等.62个苜蓿品种抗根腐病评价及抗病评价标准品种的筛选[J].中国草地学报,2013,35(1):1217.
[15]辛宝宝,袁庆华,王瑜,等.紫花苜蓿对尖孢镰刀菌的抗性评价[J].中国草地学报,2016,38(1):7480.
[16]潘龙其,张丽,田进山,等.紫花苜蓿不同品种对拟枝孢镰刀菌的抗性评价[J].草业学报,2016,25(5):95101.
[17]郭玉霞,郭志鹏,张靖雪,等.锐顶镰孢致病性及苜蓿品种间的抗病性研究[J].植物病理学报,2018,48(2):213222.
[18]孔前前,秦丰,张雨竹,等.苜蓿镰孢菌根腐病病原致病性和毒素化学型测定[J].中国农业大学学报,2018,23(5):7485.
(责任编辑:杨明丽)
