金水六君煎对慢性阻塞性肺疾病气道黏液高分泌大鼠肺组织黏蛋白5AC及水通道蛋白5表达的影响
2019-09-04柏正平刘雨谭小宁谭电波邓秀娟李仲普刘俊谭光波
柏正平 刘雨 谭小宁 谭电波 邓秀娟 李仲普 刘俊 谭光波

摘要:目的 觀察金水六君煎对慢性阻塞性肺疾病(COPD)气道黏液高分泌大鼠肺组织黏蛋白5AC(MUC5AC)、水通道蛋白5(AQP5)表达的影响,探讨其治疗气道黏液高分泌的可能机制。方法 24只SD大鼠随机分成正常组、模型组、金水六君煎组和阿奇霉素组,每组6只。采用烟熏加气管内脂多糖滴入制作大鼠COPD气道黏液高分泌模型,成模后给予相应药物干预,连续2周。观察大鼠一般情况,小动物肺功能仪检测肺功能,HE染色观察肺组织病理,PAS染色检测气道杯状细胞数及黏液量,RT-PCR和Western blot分别检测肺组织MUC5AC、AQP5基因与蛋白的表达。结果 与正常组比较,模型组大鼠肺组织HE染色符合COPD病理改变,肺功能及AQP5基因与蛋白表达明显降低(P<0.05),气道杯状细胞数、黏液量增加及MUC5AC基因与蛋白表达显著升高(P<0.05);与模型组比较,金水六君煎组大鼠肺功能明显改善(P<0.05,P<0.01),气道杯状细胞数、黏液量减少及肺组织MUC5AC基因与蛋白表达明显降低(P<0.05),肺组织AQP5基因与蛋白表达显著升高(P<0.05,P<0.01)。结论 金水六君煎可促进肺组织AQP5表达,抑制MUC5AC表达,纠正黏蛋白/水盐比例失衡可能是其治疗COPD气道黏液高分泌的机制之一。
关键词:金水六君煎;慢性阻塞性肺疾病;气道黏液高分泌;黏蛋白5AC;水通道蛋白5;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)08-0054-06
DOI:10.3969/j.issn.1005-5304.2019.08.012 开放科学(资源服务)标识码(OSID):
Abstract: Objective To observe the effects of Jinshui Liujunjian Decoction on expressions of mucin5AC (MUC5AC) and aquaporin5 (AQP5) of chronic obstructive pulmonary diseases (COPD) airway mucus hypersecretion rats model; To explore possible mechanism of Jinshui Liujunjian Decoction for the treatment of airway mucus hypersecretion. Methods Twenty-four SD rats were randomly divided into normal group, model group, Jinshui Liujunjian Decoction group and azithromycin group, with 6 rats in each group. COPD model was established by the method of cigarette smoking combined with intratracheal injection of LPS. After successful modeling, the corresponding medicines were continuously intervened for 2 weeks. The general condition of the rats was observed. The lung function of rats was detected by small animal lung function test; HE was used to detect lung tissue pathology; PAS staining was used to detect and the number of airway goblet cells and mucus; qRT-PCR and Western blot were applied to verify the mRNA and protein expressions of MUC5AC and AQP5. Results Compared with the normal group, the lung tissue in the model group was accorded with the pathological changes of COPD, the lung function and mRNA and protein expression of AQP5 decreased significantly (P<0.05), and number of airway goblet cells, mucus and expression of MUC5AC mRNA and protein significantly increased (P<0.05). Compared with the model group, the lung function of Jinshui Liujun Decoction group was obviously improved (P<0.05, P<0.01), the number of airway goblet cells, mucus and expression of MUC5AC obviously decreased (P<0.05), and expression of AQP5 mRNA and protein remarkably increased (P<0.05, P<0.01). Conclusion Jinshui Liujunjian Decoction can promote expression of AQP5 and inhibit expression of MUC5AC in lung tissue and keep the balance of mucin/water salt ratio, which may be one of the mechanisms for its treatment of COPD airway mucus high secretion.
Keywords: Jinshui Liujunjian Decoction; chronic obstructive pulmonary disease; airway mucus hypersecretion; mucin5AC; aquaporin5; rats
慢性阻塞性肺疾病(chronic obstruetive pulmonary diseases,COPD)是呼吸系统常见的一种以气流阻塞为特征的慢性疾病,其发病率、致残率、病死率较高,严重危害人类健康。气道黏液高分泌是COPD重要病理特征,与COPD患者肺功能加速下降、急性加重及高住院治疗率密切相关[1]。中医学认为痰饮贯穿于COPD疾病发生、发展始终,现代医学与中医学进行了较为全面的研究,认为“气道黏液高分泌”是中医学的“痰饮”[2-3]。金水六君煎出自《景岳全书》,临床用于治疗慢性支气管炎及COPD咳喘痰多疗效满意,药理研究表明其能促进纤毛运动和排痰量[4-6],但其对COPD气道黏液高分泌机制研究迄今未见报道。COPD黏液高分泌除黏蛋白绝对量增加外,还与黏蛋白/水盐比例失衡有关,黏蛋白5AC(MUC5AC)主要影响黏度,水通道蛋白5(aquaporin 5,AQP5)调控黏蛋白/水盐比[7]。本研究旨在通过观察金水六君煎对COPD气道黏液高分泌大鼠肺组织MUC5AC和AQP5表达的影响,探讨其治疗COPD气道黏液高分泌的可能机制,为金水六君煎临床应用提供依据。
1 材料与方法
1.1 动物
清洁级健康雄性SD大鼠24只,鼠龄10~12周,体质量(230±20)g,湖南省斯莱克实验动物中心提供,动物许可证号SCXK(湘)2016-0002。饲养于温度22~26 ℃、相对湿度40%~70%环境,通风换气8~12次/h,饲料为高温高压灭菌饲料,水为纯净水。
1.2 药物及制备
金水六君煎(熟地黄15 g,当归6 g,茯苓6 g,法半夏6 g,陈皮4.5 g,炙甘草3 g),加入生姜10 g,饮片购自湖南省中医药研究院附属医院药房,一煎按原药材量加10倍水,煎煮1 h,二煎加8倍量水,煎煮1 h,合并藥液浓缩备用。阿奇霉素分散片,珠海联邦制药股份有限公司,0.25 g/片,批号20150401。
1.3 主要试剂与仪器
白沙烟(湖南长沙卷烟厂,焦油量15 mg,烟气烟碱量0.9 mg),脂多糖(美国Sigma公司,货号L2880),反转录试剂盒、UltraSYBR Mixture试剂盒(北京康为世纪),小鼠MUC5AC单克隆抗体(SantaCruz,货号45M1),AQP5兔多克隆抗体(Abcam,货号ab78486),AB-PAS染色试剂盒(北京索莱宝科技有限公司,货号G1132),大鼠β-actin、MUC5AC、AQP5引物(上海生工)。小动物肺功能分析系统(美国Buxco公司),电泳仪(美国Bio-rad,164-5050),转膜仪(北京六一,DYCZ-40A),全自动凝胶成像分析系统(英国Syngene G公司),荧光PCR板(Thermo,SPL0960),荧光定量PCR仪(Thermo,PIKO REAL 96)。
1.4 分组、造模和给药
实验大鼠采用随机数字表法分为正常组、模型组、金水六君煎组和阿奇霉素组,每组6只。模型制作参照文献[8]方法,除正常组外,其余各组大鼠于第1、14日麻醉后气管内滴入脂多糖200 μg。第2~13、15~28日给予大鼠香烟烟熏,2次/d,每次15根,1 h/次。第29~42日开始给予药物灌胃干预,每日1次,连续14 d。大鼠给药剂量参考人和动物体表面积折算等效剂量比率表,大鼠等效剂量相当于人的6.3倍,大鼠给药量按临床人(70 kg)与动物等效量换算,金水六君煎给药量为4.50 g/kg,阿奇霉素给药量为22.5 mg/kg,给药体积均为1 mL/100 mg。模型组给予等量生理盐水灌胃。各组末次给药后次日行肺功能检测,麻醉状态下处死大鼠,摘取肺组织,分别固定于4%多聚甲醛中行病理学检测及液氮中行RT-PCR和Western blot检测。
1.5 指标检测
1.5.1 一般观察
观察大鼠体质量、活动情况、毛发、咳嗽、气喘和口鼻分泌物等。
1.5.2 小动物肺功能仪检测肺功能
大鼠麻醉后分离暴露气管,进行气管插管并固定,用动物呼吸机测定0.3 s用力呼气容积(FEV0.3)、呼气峰值流速(PEF)、肺阻力(RI)及动态肺顺应性(Cdyn)。
1.5.3 肺组织病理观察
取大鼠肺组织,置于4%多聚甲醛中固定48 h,常规梯度乙醇脱水,石蜡包埋,切片,HE染色,脱水,透明,封片,光镜下观察肺组织病理改变。
1.5.4 气道杯状细胞数及黏液量检测
肺组织石蜡包块切片,脱蜡至水,1%高碘酸钠水溶液氧化10 min,水洗3次,Schiff液染色20 min,蒸馏水水洗分化10 min,苏木精染核10 s,1%盐酸乙醇分化20 s,脱水,透明,封片。阳性表达区400倍光镜下拍照,每张切片取3个不同视野,计算气管杯状细胞数,应用ProPlus6.0图像分析软件计算PAS阳性表达物积分光密度(IOD),取平均值。
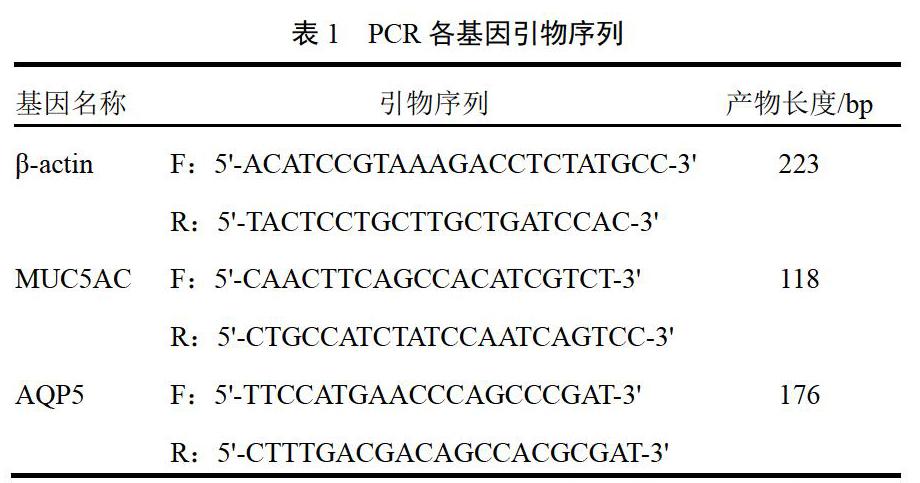
1.5.5 RT-PCR检测肺组织黏蛋白5AC、水通道蛋白5基因的表达
取大鼠肺组织约0.02 g,加入1 mL Trizol,于灭菌匀浆器中充分研磨匀浆,采用酚/氯仿萃取法提取总RNA,紫外分光光度计测定RNA浓度及260、280 nm处吸光度,计算其纯度。取6 ?L RNA,按HiFiScript cDNA Synthesis Kit说明书合成cDNA,再以cDNA为模板,按UltraSYBR Mixture合成试剂盒说明书进行扩增。反应体系:2×SYBGREEN PCR Master Mix 15 μL,引物F(10 μmol/L)0.5 μL,引物R(10 μmol/L)0.5 μL,PCR无酶水13 μL,cDNA 1 μL,总体积共30 μL。扩增条件:95 ℃预变性10 min;95 ℃、15 s,60 ℃、50 s,40个循环。根据所得Ct值,以β-actin为内参、正常组样本为对照样品计算2-ΔΔCt,得到目的基因的相对表达量。引物设计见表1。
1.5.6 Western blot检测肺组织黏蛋白5AC、水通道蛋白5蛋白的表达
剪取25 mg大鼠肺组织,加入200 μL RIPA裂解液,于匀浆器中反复研磨后离心提取总蛋白,BCA法测定蛋白浓度后加入5×蛋白上样缓冲液,100 ℃金属水浴煮10 min,-20 ℃冰箱保存备用。配制分离胶浓度为8%(分离MUC5AC)和12%(分离AQP5及β-actin)的SDS-聚丙烯酞胺凝胶。在加样孔按顺序加入蛋白样本20 μL及蛋白Marker 4 μL,按浓缩胶恒压80 V、30 min,分离胶120 V、60 min进行电泳。电泳结束后用湿转法将蛋白转移至PVDF膜,恒流300 mA MUC5AC约2 h,AQP5及β-actin约1 h。转膜完毕后,将PVDF膜置于5%脱脂奶粉(1×TBST稀释)中室温封闭1.5 h,1×TBST洗涤10 min,加入1×TBST稀释的小鼠MUC5AC单克隆抗体(稀释比1∶200)、AQP5兔多克隆抗体(浓度0.1 μg/mL)和β-actin(稀释比1∶5000),4 ℃冰箱孵育过夜。孵育结束后1×TBST洗3次×10 min,加入TBST稀释的辣根过氧化物酶标记鼠二抗和兔二抗(稀释比1∶5000),室温孵育1.5 h,1×TBST洗涤3次×10 min,置于ECL发光液(A液和B液按 1∶1混合)中显影,暗室曝光冲印,采用BioRad成像系统分析电泳条带,QuantityOne图像分析基因相对表达量。
1.6 统计学方法
采用SPSS19.0统计软件进行分析。实验数据以—x±s表示,组间比较用方差分析,两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 一般状况
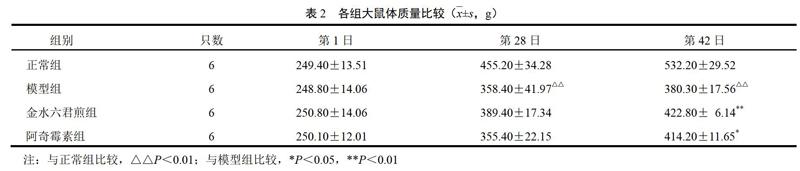
与正常组比较,模型组大鼠偶可闻及气道痰鸣音及咳嗽,毛发干枯,活动量减少,体质量明显下降;与模型组比较,金水六君煎组和阿奇霉素组大鼠毛发光泽度较好,活动量增多,体质量明显增加。结果见表2。
2.2 金水六君煎对模型大鼠肺功能的影响
与正常组比较,模型组大鼠FEV0.3/FVC、PEF、Cdyn均明显降低,RI明显升高,差异有统计学意义(P<0.05,P<0.01);与模型组比较,金水六君煎组和阿奇霉素组大鼠FEV0.3/FVC、PEF、Cdyn均有不同程度升高,RI明显降低,差异有统计学意义(P<0.05,P<0.01)。结果见表3。
2.3 肺组织病理变化
正常组大鼠小气道黏膜上皮完整,管壁规整,无炎性细胞浸润,肺泡腔无病理性扩大,肺小血管血管壁未见增厚;模型组大鼠可见大小不一肺小泡形成,肺泡间隔破坏,部分肺泡融合成肺大泡,气管上皮黏膜脱落,气管壁变形,管腔内痰黏潴留,管壁周围及肺间质可见淋巴细胞及中性粒细胞浸润,肺小血管壁增厚,管腔变窄。结果见图1。
2.4 金水六君煎对模型大鼠肺组织气道杯状细胞数及黏液量的影响
紫红色阳性表达物为黏蛋白,主要表达于气管及主支气管黏膜杯状细胞。正常组大鼠支气管黏膜可见少量散在杯状细胞,模型组大鼠气管支气管杯状细胞数显著增加,杯状细胞内黏蛋白分泌亢进,管腔内可见少量PAS阳性分泌物。与正常组比较,模型组大鼠气道杯状细胞数及黏液量显著增加(P<0.01);与模型组比较,金水六君煎组和阿奇霉素组大鼠杯状细胞数及黏液量明显减少(P<0.05,P<0.01)。结果见表4、图2。
2.5 金水六君煎对模型大鼠肺组织黏蛋白5AC、水通道蛋白5基因表达的影响
与正常组比较,模型组大鼠肺组织MUC5AC mRNA表达显著升高(P<0.01),AQP5 mRNA表达显著降低(P<0.01);与模型组比较,金水六君煎组和阿奇霉素组大鼠肺组织MUC5AC mRNA表达明显降低(P<0.01),金水六君煎组大鼠肺组织AQP5 mRNA表达显著升高(P<0.01),阿奇霉素组大鼠肺组织AQP5 mRNA表达无明显变化。结果见表5。
2.6 金水六君煎对模型大鼠肺组织黏蛋白5AC、水通道蛋白5蛋白表达的影响
与正常组比较,模型组大鼠肺組织MUC5AC蛋白表达明显升高(P<0.01),AQP5蛋白表达明显降低(P<0.01);与模型组比较,金水六君煎组和阿奇霉素组大鼠肺组织MUC5AC蛋白表达明显降低(P<0.01),金水六君煎组大鼠肺组织AQP5蛋白表达明显升高(P<0.05),阿奇霉素组大鼠肺组织AQP5蛋白表达无明显变化。结果见表5、图3。
3 讨论
气道黏液高分泌是COPD重要的病理特征之一,与COPD患者临床结局密切相关[9]。正常气道黏液由气管、支气管分泌,是杯状细胞分泌的黏蛋白及黏膜下腺体分泌的水、糖类、蛋白质、脂类及矿物质的混合物。黏蛋白占气道黏液总量2%,水分占气道黏液总量95%,黏蛋白糖基组成的变化是引起黏液理化特性改变的主要原因。在成人呼吸道分泌的黏蛋白中,MUC5AC是主要分泌物,气道黏液高分泌过程中MUC5AC表达显著增加[10]。AQP5是主要表达于肺泡的水通道蛋白,一方面利用腔道内外的渗透压差,使水分子快速跨膜转运,从而调节气道黏液的体积;另一方面调控黏膜下腺泡黏液分泌,调节黏蛋白/水盐比的平衡。COPD黏液高分泌除黏蛋白的绝对量增多外,还与黏蛋白/水盐比例失衡有关。目前在体及体外实验研究均显示MUC5AC与AQP5呈负相关,抑制AQP5表达,可导致MUC5AC表达显著增加[11-12]。
中医认为,肺主通调水道,通过宣发和肃降调节水液的输布、运行和排泄。痰饮的形成与肺气宣发肃降功能受损,水道失于通调,水津失布有关,气道黏液高分泌的中医病机在于肺气失于宣肃,肺内水道不利[13]。金水六君煎主治肺肾虚寒,水泛为痰,或年迈阴虚,气血不足,外受风寒,咳嗽呕恶多痰,喘急等证。其组方由二陈汤(法半夏、陈皮、茯苓和甘草)及贞元饮(熟地黄、当归和炙甘草)组合而成,其中二陈汤理气燥湿化痰,当归、熟地黄滋肺肾阴血以治本,全方标本兼顾[14]。
本研究采用烟熏联合气道内脂多糖滴入制作大鼠COPD模型,模型组肺功能FEV0.3、PEF、Cdyn明显降低,RI明显升高,HE染色可见小气道慢性炎症及肺气肿改变,PAS染色显示杯状细胞数及PAS阳性分泌物明显增加。王骏等[15]采用气道脂多糖滴入联合烟熏建立COPD气道黏液高分泌大鼠模型,发现大气道上皮杯状细胞化生在第30日时达到高峰,认为30 d的复合COPD模型可用于COPD急性加重期气道黏液高分泌的实验研究,与本研究相一致。提示烟熏联合气道内脂多糖滴入可成功制作COPD气道黏液高分泌大鼠模型。金水六君煎组和阿奇霉素组均能改善COPD大鼠相关肺功能指标,降低杯状细胞数及杯状细胞内黏液分泌物量,提示金水六君煎可明显改善COPD大鼠气道黏液高分泌状态,延缓肺功能下降。
本研究结果显示,模型组大鼠肺组织MUC5AC基因和蛋白表达明显升高,AQP5基因与蛋白表达明显降低,与临床研究相一致[16]。与模型组比较,金水六君煎组大鼠肺组织MUC5AC基因和蛋白表达明显下调,AQP5基因与蛋白表达明显上调,提示金水六君煎可能通过纠正黏蛋白/水盐比例失衡抑制气道黏液高分泌。王志旺等[17-18]研究发现,当归能明显上调哮喘小鼠肺组织AQP5表达,抑制MUC5AC表达,通过调节肺组织水代谢发挥平喘作用。周建龙等[19-20]研究发现,半夏提取物通过抑制MUC5AC表达,上调AQP5表达抑制大鼠气道黏液高分泌状态。当归养阴润燥、半夏燥湿化痰可能是金水六君煎治疗痰饮主要药效成分。本研究发现,阿奇霉素组大鼠肺组织MUC5AC表达显著降低,但AQP5表达较模型组无明显差异。有研究认为,阿奇霉素通过调控炎症因子及基质金属蛋白酶9,阻断MUC5AC合成信号通路,从而抑制气道黏液高分泌[21-22]。提示金水六君煎和阿奇霉素治疗气道黏液高分泌存在不同的作用机理。
本实验初步证实金水六君煎可通过纠正黏蛋白/水盐比例失衡抑制COPD大鼠气道黏液高分泌并延缓其肺功能下降,为临床上中医药治疗COPD高黏液分泌提供依据。但COPD气道黏液高分泌是一个复杂的病理过程,涉及多种信号传导通路调控MUC基因转录、蛋白合成及分泌,AQP5调控MUC5AC表达的作用靶点及信号通路有待进一步研究。
参考文献:
[1] 田攀文,文富强.治疗慢性阻塞性肺疾病气道黏液高分泌临床意义[J].中国实用内科杂志,2015,35(5):382-385.
[2] 马建岭,席宁,史利卿.以中医痰饮病机理论探讨慢性阻塞性肺疾病稳定期气道黏液高分泌机制及治疗方法[J].现代中医临床,2012,19(3):37-39.
[3] 赵娜妹.从痰饮探讨健脾益肺化痰方对COPD模型大鼠气道黏液高分泌的作用机制[D].北京:北京中医药大学,2016.
[4] 谷丽敏,李伟红,朱德增,等.金水六君煎加味治疗慢性支气管炎31例[J].中医杂志,2001,42(3):147.
[5] 常琦.金水六君煎对稳定期慢性阻塞性肺疾病患者呼吸功能和免疫功能的影响[J].上海中医药杂志,2012,46(7):40-41.
[6] 孟辉,黎俏梅,沈英森,等.金水六君煎及其成分祛痰作用的药效学研究[J].中成药,2005,27(7):849-850.
[7] 陈智鸿,白春学.气道黏液高分泌與上皮通道蛋白关系的研究进展[J].国际呼吸杂志,2007,27(11):871-873.
[8] 宋一平,崔德健,茅培英.慢性阻塞性肺病大鼠模型的建立及药物干预的影响[J].中华内科杂志,2000,39(8):712-714.
[9] 文富强,申永春.祛痰治疗在慢性阻塞性肺疾病中临床应用[J].中华肺部疾病杂志,2010,3(4):6-8.
[10] 陈玉梅,童瑾.气道黏液高分泌机制的研究进展[J].基础医学与临床,2016,36(11):1573-1577.
[11] 沈瑶.水通道蛋白5敲除对呼吸道黏液表达谱的影响及其信号转导机制的研究[D].上海:复旦大学,2010.
[12] 陈智鸿,祝蓉,白莉,等.小发卡状RNA介导的人呼吸道黏膜下腺细胞对水通道蛋白5的抑制及其对MUC5AC表达的影响[J].中华结核和呼吸杂志,2006,29(2):128-129.
[13] 傅慧婷,余小萍.肺通调水道功能与气道黏液高分泌[J].新中医, 2013,45(3):5-7.
[14] 张俊图,吴洪波,李建梅.金水六君煎方用探讨[J].江西中医药, 2015,46(4):5-7.
[15] 王骏,李春盈,刘治坤,等.慢性阻塞性肺疾病气道黏液高分泌大鼠模型的建立[J].心肺血管病杂志,2014,33(4):592-595.
[16] 王可,冯玉麟,文富强,等.慢性阻塞性肺疾病患者气道上皮水通道5的表达与黏液高分泌[J].中国呼吸与危重监护杂志,2006,5(5):357-361.
[17] 王志旺,刘雪枫,程小丽,等.当归对阴虚哮喘小鼠的平喘作用及肺组织中水通道蛋白5表达的影响[J].华西药学杂志,2016,31(3):235-238.
[18] 王志旺,程小丽,任远,等.当归对阴虚哮喘小鼠气道MUC5AC及相关炎症因子表达的影响[J].中国免疫学杂志,2016,32(1):42-45.
[19] 周建龙,邓青南,梁静,等.半夏提取物对小鼠肺水通道蛋白5表达的影响[J].长春中医药大学学报,2015,31(2):229-231.
[20] 周建龙.半夏提取物对慢性气道黏液高分泌的影响[D].广州:广州中医药大学,2009.
[21] 任薇,孙耕耘,王胜,等.阿奇霉素对慢性阻塞性肺疾病模型大鼠气道炎症和气道黏液高分泌的影响[J].中国病理生理杂志,2015,31(10):1767-1771.
[22] 罗琳,尤列·皮尔曼,维克多·科罗索夫,等.阿奇霉素通过基质金属蛋白酶9抑制气道黏液高分泌的实验研究[J].中华医学杂志2011,91(10):689-693.
(收稿日期:2019-01-07)
(修回日期:2019-01-25;编辑:华强)
