水杨醛缩氨基硫脲配合物与牛血清蛋白的弱相互作用研究
2019-09-04何江龙吴建丽李优优
何江龙,吴建丽,周 芳,徐 昊,李优优
(黄河科技学院 医学院,河南 郑州 450000)
席夫碱是由氨基与活泼的羰基这两类物质通过脱水缩合而形成的含有烷亚氨基(RC=N)或亚氨基(HC-N)的一类有机高分子化合物[1-2]。席夫碱中由于有C-N键的存在,以及其杂化轨道上具有孤对电子的N原子,因此在化学与生物学上具有重要的意义[3]。席夫碱还可以与大部分金属元素在不同条件下形成稳定性不一的金属配合物,而这些配体及配合物在多个领域都有着非常重要的作用[4]。在参考文献基础上,本文用更加简便的方法合成了水杨醛缩氨基硫脲配体及其与3种金属离子的配合物,并通过红外和核磁共振氢谱对化合物进行结构表征,提出了配合物可能存在的结构。
血清蛋白是血液中脂肪酸的携带者,也是人和动物体内血浆中含量最丰富的蛋白。药物进入人体后会优先与血清蛋白结合,而血清蛋白与药物之间若结合能力过强的话则可能导致游离的药物浓度下降,从而使药效降低;反之,它们之间结合能力过弱则会引起药物的快速代谢。由此可见,药物的药效决定于血清蛋白与药物结合能力的强弱。由于具有高度同源性,牛血清蛋白(BSA)被广泛的代替人血清蛋白模型从而用于进行各种研究[5-7]。因此研究各类药物小分子与BSA之间的弱相互作用,对于认知药物作用原理及新药设计等具有极其重要的价值,研究水杨醛席夫碱配合物与BSA之间的弱相互作用对于进一步理解水杨醛席夫碱配合物潜在的药物价值显得很有意义。本文通过荧光法,较为详细的研究了水杨醛缩氨基硫脲配合物与牛血清蛋白的弱相互作用,并简单分析了作用原理。
1 实验部分
1.1 仪器与试剂
F-4600荧光光谱仪(日本日立),CJJ79-1 磁力搅拌器(江苏晓阳电子仪器厂),FA1004电子天平(上海良平仪器仪表有限公司),2XZ-2真空干燥箱(北京中兴伟业仪器有限公司),X-4熔点分析仪(上海微图仪器科技发展有限公司)。牛血清蛋白(Bovine serum albumin,BSA,Sigma-Aldrich,中国);水杨醛、氨基硫脲、四水乙酸锰和四水硝酸镉等试剂均为分析纯。
1.2 实验方法
1.2.1 水杨醛缩氨基硫脲schiff's碱配体L的合成(路线如图1)

图1 L的合成路线
Fig.1 The syhthetic route for L
在150 mL三颈烧瓶中加入60 mL无水乙醇,3.6481 g氨基硫脲,水浴加热至水温达到55℃并使固体全部溶解。取4.9036 g水杨醛于20 mL无水乙醇使其全部溶解,转移至滴液漏斗中,恒温水浴加热回流搅拌滴加水杨醛溶液,溶液由澄清透明变为乳白色。反应液回流搅拌1.5 h后倒入烧杯中,冷却至室温,结晶,静置过夜,生成淡黄色沉淀。检验过滤,乙醚洗涤得淡黄色结晶,真空干燥24 h后得到淡黄色粉末纯schiff's碱配体L。产率为71.7%,m.p.为228~232℃。
1.2.2 Mn(Ⅱ)、Cd(Ⅱ)配合物的合成
称取上述Schiff's碱配体L0.1962 g(1 mmol)于20 mL甲醇中,加热搅拌使其溶解;另分别取0.2450 g(1 mmol)的Mn(OAc)2·4H2O和0.308 g(1 mmol)的Cd(NO3)2·4H2O于烧杯中,加入5 mL甲醇和10 mL蒸馏水,磁力搅拌使其溶解;将配体溶液缓缓倒入硫酸铜溶液,向溶液中滴加0.1 mol/L的NaOH溶液,使其pH值等于6.0。静置24 h,待沉淀析出完全,抽滤并干燥。反应结束得到棕色锰配合物和米黄色镉配合物,测得两种配合物m.p.均大于300℃。
1.2.3 席夫碱L及Mn(Ⅱ)配合物与牛血清蛋白的荧光光谱测定
配体L和Mn(Ⅱ)配合物以甲醇溶解后,用蒸馏水稀释为2.50×10-4mol/L的储备液;牛血清蛋白用蒸馏水溶解并配成1.0×10-4mol/L的储备液。
在8支10 mL的比色管中分别加入0.15 mLBSA储备液及一定量的配体和配合物储备液,用Tris-HCl缓冲溶液(pH值7.35)定容至5 mL,在25℃进行荧光光谱扫描(荧光最大激发波长λex=280 nm,荧光最大发射波长λem=290~500 nm,狭缝宽度分别为2.5 nm和5 nm)。
2 结果与讨论
2.1 配体L结构表征
由IR谱图可知,化合物保留一个-NH2(ν=3200~3500 cm-1有两个吸收峰) 和-OH(ν=3000~3300 cm-1)。同时水杨醛分子中的-CHO(ν≈1720 cm-1)吸收峰消失,出现了-CH=N-(ν≈1651 cm-1)的吸收峰。
1HNMR谱图表明,配体中-OH质子的δ出现在11.37附近,-CH=N-质子的δ出现在8.37附近,苯环上的质子δ出现在6.79~7.92之间,受-C=S-基团的影响,-NH2和-NH-质子δ出现在8.11和9.87。
2.2 配合物结构表征
从Cd(Ⅱ)配合物IR谱图可知,-NH2的特征吸收峰消失,意味着-NH2和中心离子Cd(Ⅱ)配位成功,保留-NH-的吸收峰(ν=3200~3500 cm-1有一个吸收峰),也保留了-OH的部分缔和吸收峰。-CH=N-(ν≈1651 cm-1)的吸收峰没有受到影响;而在Mn(Ⅱ)配合物的IR谱图中,-NH2的特征吸收峰部分消失,-OH的特征缔和吸收峰保留,同时-CH=N-(ν≈1610 cm-1)的吸收峰发生了红移现象。Cd(Ⅱ)配合物1HNMR谱图中-NH2质子峰出现了高场(δ=5.987)。
2.3 配合物的可能结构推测
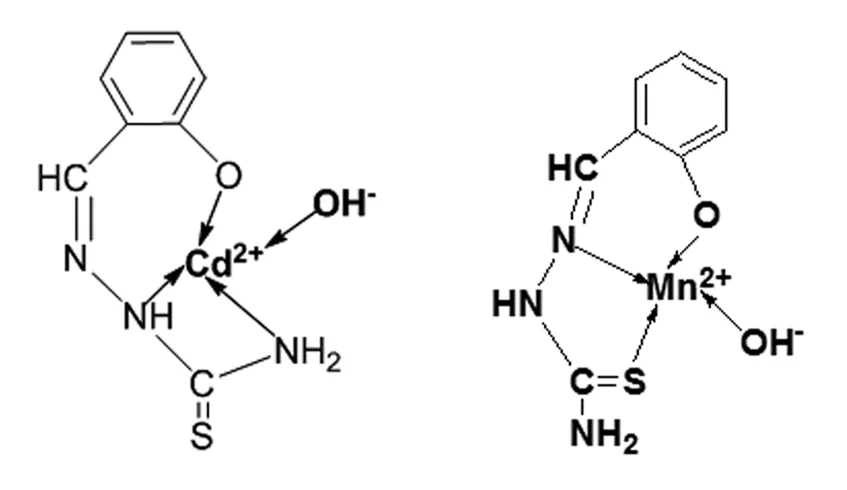
图2 Cd(Ⅱ)、Mn(Ⅱ)配合物的结构Fig.2 Structure of Cd(Ⅱ)and Mn(Ⅱ)complexes
结合IR和1HNMR数据,我们推测Cd(Ⅱ)、Mn(Ⅱ)配合物的结构可能如图2所示。
2.4 荧光光谱数据分析与讨论

pH值7.35,25℃,CBSA= 3.00μmol /L,0 → 7:CL/(μmol /L) = 0.00;1.00; 3.00; 6.00; 9.00; 12.00; 15.00; 18.00
图3 配体L与牛血清蛋白弱相互作用荧光谱图
Fig.3 Fluorescence spectra of BSA in the presence of L

pH值7.35,25℃,CBSA= 3.00μmol /L,0 → 7: Ccp1/( μmol/L) = 0.00;1.00; 3.00; 6.00; 9.00; 12.00; 15.00; 18.00
图4 Mn(Ⅱ)配合物与牛血清蛋白弱相互作用荧光谱图
Fig.4 Fluorescence spectra of BSA in the presence of CP
牛血清蛋白属于内源性荧光物质主要表现为色氨酸残基。随着猝灭剂浓度的不断增加,配体L及Mn(Ⅱ)配合物与BSA的荧光光谱图中,均表现出了明显的荧光猝灭现象,说明与这两种化合物与牛血清蛋白之间存在弱相互作用;Mn(Ⅱ)配合物与BSA荧光光谱图中,荧光猝灭现象明显增强明显,说明该配合物与牛血清蛋白的弱相互作用增强。随着 Mn(Ⅱ)配合物浓度的增加,蛋白在340 nm 处的荧光强度下降且最大发射波长红移10 nm,色氨酸在蛋白质中的最大荧光发射波长依赖于其周围环境的极性,波长红移表明蛋白中的色氨酸进入到亲水的极性环境中。Mn(Ⅱ)配合物是亲水性分子,可能插入到蛋白的亲水性空腔,提高色氨酸周围的极性特性,从而引起最大荧光发射波长红移,亦有可能Mn(Ⅱ)配合物的大小和亲水空腔匹配的缘故。
3 结论
参考文献的基础上用更简便的方法合成了水杨醛缩氨基硫脲schiff's碱配体及其与Cd(Ⅱ)及Mn(Ⅱ)形成的配合物,并进行了结构解析。同时,试验结果表明,配体与Mn(Ⅱ)配合物与BSA的荧光光谱图中,发生了荧光猝灭现象,表明两种化合物与牛血清蛋白之间存在弱相互作用;Mn(Ⅱ)配合物与BSA荧光光谱图中,荧光猝灭现象更为明显,说明该配合物与牛血清蛋白的弱相互作用更强。鉴于某些席夫碱化合物的生理活性,这2种化合物可以作为潜在的药物筛选,两种化合物与BSA的猝灭原理也有待进一步的研究。
