茶氨酸处理脑缺血后大鼠海马血红素加氧酶-1表达及细胞凋亡的影响研究
2019-09-04边步荣高彦东薛荣亮
高 静,边步荣,高彦东,薛荣亮
1.延安大学第二附属医院(陕西省榆林市第一医院)麻醉科(榆林 719000);2.西安交通大学第二附属医院麻醉科(西安 710004)
氧化应激损伤和细胞凋亡是脑缺血再灌注损伤的两种主要机制[1]。血红素加氧酶-1(Heme oxygennase-1,HO-1)具有潜在的细胞保护作用,也是目前发现最易受诱导的酶,能被各种引起氧化应激的因素所诱导而增加表达,其代谢产物具有强大的抗氧化能力[2-3]。而细胞凋亡具有主动性、选择性、可逆性,大多发生在细胞坏死之后,如能采取恰当的处理措施,有效抑制和逆转细胞凋亡,将有利于脑再灌注损伤的治疗,改善神经系统转归[4-5]。茶氨酸属于保健食材,本课题组前期的研究已证明其通过抗氧化作用、降低神经元的氧化水平对脑缺血再灌注损伤有保护作用[6-7]。本实验拟探讨茶氨酸脑保护作用的机制是通过上调HO-1的表达来进行,还是通过自身减少氧化应激损伤和抑制细胞凋亡来实现,报告如下。
材料与方法
1 实验材料 健康清洁雄性SD大鼠270只,体重180~220 g,由西安交通大学医学院动物中心提供。L-茶氨酸(美国genview公司),HO-1单克隆抗体(StressGen),SABC免疫组化试剂盒(武汉博士德生物试剂公司),原位细胞凋亡检测试剂盒(美国SIGMA公司),HO-1引物(北京三博远志生物有限公司),GAPDH引物(北京三博远志生物有限公司),流式细胞仪(美国BD公司),PCR合成仪(美国ABI公司),多重实时定量荧光PCR仪(德国伯乐公司),GAPDH基因序列181 (cattgacctcaactacatggtctacatgttccagtatgactctacccacggcaagttcaa),241(cggcacagtcaaggctgagaatgggaagctggtcatcaacgggaaacccatcaccatctt),301(ccaggagcgagatcccgctaacatcaaatggggtgatgctggtgctgagtatgtcgtgga),121(ggttaccagggctgccttctcttgtgacaaagtggacattgttgccatcaacgacccctt),HO-1基因序列1021(tctcatgtagccttctctctgcaggggagaatcttgcctggctctcttttcttgggcctc),1081(taagaaagcttttggggttcctcgcccccttcctgtgtcttcctttgtctctctggaatg),1141(gaaggagatgcctggcacatttccctcaccaaaagcacagccaggggcctgaacttggaa)。
2 实验方法 采用随机数字表法,将大鼠分为三组:假手术组(PO组),脑缺血再灌注组(IR组),茶氨酸组(TH组)。采用四血管阻断法建立大鼠全脑缺血再灌注损伤模型,茶氨酸干预组于全脑缺血模型建立后3 min经尾静脉注射25%茶氨酸溶液4 ml/kg(即1000 mg/kg),其余两组分别尾静脉注射生理盐水4 ml/kg。大鼠分别于再灌注后2 h、6 h、12 h、24 h、48 h处死取脑组织,HE染色观察海马结构形态变化;IHC免疫组化染色(一抗为小鼠IgG,浓度为1∶50)和实时定量PCR观察HO-1蛋白在海马各个时点的表达变化;TUNNEL染色和流式细胞仪观察海马各个时点细胞凋亡情况。

结 果
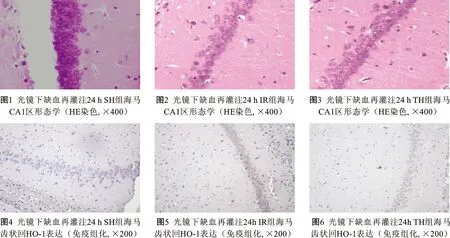
1 HE染色海马CA1区形态学改变 光镜下可见PO组各时点大鼠海马CA1区椎体细胞3~4层排列整齐而紧密,胞质淡红色,胞核蓝色(图1);IR组48 h,海马椎体细胞失去正常结构,排列紊乱,细胞皱缩,数量减少(图2);TH组在组织形态学上较IR组有改善,细胞数量也较IR组增加(图3)。
2 免疫组化染色(IHC) PO组各时点海马组织几乎无棕黄色淡染的HO-1阳性细胞,齿状回可见少量HO-1阳性的棕黄淡染细胞(图4)。IR组24 h海马HO-1阳性细胞增加,海马齿状回细胞几乎均被棕染(图5),HO-1蛋白大量表达。TH组与IR组比较24 h明显可见棕黄淡染阳性细胞数量减少(图6)。
3 原位细胞凋亡检测 PO组各时点海马组织几乎无棕色淡染的凋亡细胞(图7);IR组48 h齿状回棕色淡染的阳性凋亡细胞遍布整个视野(图8);TH组48 h齿状回棕黄淡染的凋亡细胞明显减少(图9)。

4 流式细胞仪检测凋亡 结果显示PO组凋亡率较低(图10),IR组凋亡率在缺血再灌注6 h后明显上升(P<0.05),在再灌注48h后到达顶峰(图11)。TH组凋亡率在各时间点均低于IR组(P<0.05),见表1。

表1大鼠全脑缺血再灌注后个时点海马凋亡率比较(%)

组 别n2 h6 h12 h24 h48 hPO组614.73±1.3015.07±1.3815.37±0.6515.48±0.4115.58±0.32IR组619.83±0.52∗21.32±0.83∗24.58±0.86∗25.31±0.63∗27.79±1.18∗TH组618.29±1.54#20.77±0.84#24.18±0.79#24.8±0.51#27.19±0.73#
注:PO组与IR组相比*P<0.01;IR组与TH组相比,#P<0.01
5 HO-1的时程表达 PO组HO-1 mRNA表达量低,IR组HO-1表达量与PO组比较,差异有统计学意义(P<0.01),2 h开始升高,持续到24 h,在48 h时表达水平稍有回落, IR组与TH组比较差异有统计学意义(P<0.05),TH组每个时间点HO-1 相对表达量均低于IR组。见表2、3。

表2海马组织GAPDH、HO-1 real-time PCR CT值

表3海马组织HO-1相对表达量
注:IR组与PO组相比,*P<0.05;TH组与PO组相比,#P<0.05
讨 论
脑缺血再灌注损伤过程中,氧化应激反应、细胞凋亡均是参与其中的重要病生机制[7],尽管已取得了令人振奋的研究进展,但再灌注损伤仍然是临床上棘手的病生现象,是对临床医生的严峻挑战。
HO-1是血红素分解代谢的起始酶和限速酶,分解血红素产生一氧化碳(CO)、铁离子和胆绿素,在受到氧化应激时被诱导表达,有潜在的细胞保护作用。其代谢产物之一胆绿素拥有强大的抗氧化能力,可以直接清除自由基,抑制脂质过氧化,阻断氧化应激损伤;代谢产物之二CO,扩血管、抑制血小板聚集、增强血流灌注、稳定细胞膜,从而抑制氧化应激损伤;铁离子调节包括HO-1自身在内的多种基因表达。离体实验研究显示,HO-1基因敲除的神经元对氧化应激损伤敏感性增加,而HO-1表达上调则增加神经元对氧化应激的耐受性。HO-1诱导表达是神经元对氧化应激损伤做出反应过程的重要事件[8-9]。
本实验发现,全脑缺血再灌注后,24 hHO-1阳性细胞在海马结构大量表达,齿状回完全黄染,48 h表达量有所回落。实时定量PCR显示,PO组HO-1 的表达较低,IR组HO-1的表达量从2 h开始升高,持续到24 h,48 h略有回落。这些结果均与现有研究发现相一致,进一步证实了脑缺血再灌注对大脑的应激刺激和HO-1的受诱导表达。
茶氨酸作为一种食品添加剂已广泛用于点心、糖果、果冻、口香糖等,毒性实验中未发现其毒性[10],既往的研究发现,茶氨酸具有抑制咖啡碱引起的兴奋、舒缓神经、降血压和增强免疫力等多种保健及药用功能,开发应用前景广阔。
在我们的实验中,给予缺血再灌注大鼠茶氨酸干预后,在各个时间点HO-1阳性细胞在海马结构表达减少,海马组织HO-1 mRNA表达下降,且均低于IR组,所以推论,在受到脑缺血再灌导致的氧化应激刺激后,茶氨酸是通过其自身的抗氧化应激能力,减少缺血再灌注损伤,而非通过上调HO-1的表达来发挥其脑保护作用。
细胞凋亡是脑缺血再灌注损伤的一种主要机制,是一种由基因控制的细胞自主性死亡,具有主动性、选择性和可逆性的。脑缺血再灌注后凋亡的发生较为滞后[11],因此,如能采取恰当措施有效抑制和逆转细胞凋亡的发生,将有利于脑损伤的改善和治疗。在本次实验中,通过原位细胞凋亡检测法(TUNEL)和流式细胞仪检测法,发现在脑缺血再灌注发生后的2 h、6 h、12 h、24 h、48 h,细胞的凋亡率不断增加,在48 h达到了凋亡峰值。且在各个时间点IR组凋亡率均高于PO组,在脑缺血再灌注后给予茶氨酸注射干预,TH组各个时间点的凋亡率均显著下降。说明茶氨酸可以降低海马组织的细胞凋亡,对全脑缺血再灌注损伤有改善作用。
本实验还发现,脑缺血再灌注后,随着时间增加,细胞凋亡率增加,HO-1表达降低,细胞凋亡率与HO-1表达呈负相关,所以,生理剂量的HO-1蛋白的抗氧化应激能力,并未达到降低细胞凋亡的作用。HO-1蛋白与细胞凋亡之间的剂量关系及相关机制,还有待进一步实验加以探索。
综上所述,在全脑缺血再灌注后给予茶氨酸干预,海马结构组织细胞学得到改善,细胞凋亡减少,但HO-1蛋白表达降低,由此推论脑缺血再灌注损伤发生后,茶氨酸通过其自身抗氧化应激能力发挥脑保护作用,而不是通过上调HO-1蛋白的表达来发挥其保护作用,并进一步证明茶氨酸可通过抑制凋亡来发挥脑保护作用。
