血根碱通过诱导细胞凋亡抑制卵巢癌肿瘤生长的机制研究
2019-09-04张蓓蕾赵宏喜李艳红
张蓓蕾 李 怡 吴 涛 姜 锋 赵宏喜 李艳红
卵巢癌是常见的妇科肿瘤之一[1]。传统的卵巢癌治疗方法有手术治疗和化疗,然而这些治疗方法疗效有限,且化疗药物的耐药性极大地降低了治疗的敏感性,影响临床疗效[2]。因此,寻找安全有效、耐药逆转的天然药物是目前卵巢癌治疗的有效途径之一。血根碱(Sanguinarine,SANG)是一种来源于罂粟科植物博落回的提取物。SANG已被证明具有抗菌、抗氧化和抗炎特性[3-4]。当以微摩尔浓度使用时,SANG能够抑制多种肿瘤细胞系的生长,诱导肿瘤细胞与正常细胞的选择性细胞凋亡反应。到目前为止,已经在多种肿瘤细胞中证实了SANG的抗增殖和促凋亡活性,包括表皮、前列腺、乳腺、结肠和骨肉瘤等肿瘤细胞[5]。然而,SANG对卵巢癌细胞的作用机制少见报道,在小鼠卵巢癌移植肿瘤模型的体内效应研究则更少。因此,本研究以人类卵巢癌细胞SKOV3为研究对象,在细胞水平和动物水平研究SANG对卵巢癌生长、凋亡的影响,并揭示其作用机制,为SANG用于卵巢癌的临床治疗提供实验依据。
1 材料和方法
1.1 材料
SANG购自美国Sigma公司;信号通路抑制剂BAY11-7082、LY294002和SB203850购自中国碧云天公司;CCK-8试剂盒、caspase-3活性测定试剂盒、BCA蛋白质测定试剂盒、活性氧(ROS)测定试剂盒购自中国碧云天公司;Annexin V-FITC/PI凋亡检测试剂盒购自美国BD Pharmingen公司;一抗和二抗购自美国Santa Cruz Biotechnology公司;卵巢癌细胞SKOV3购自中国科学院上海细胞库,并在DMEM培养基中培养,其中补充10%胎牛血清,1%谷氨酰胺,100 mg/mL链霉素和100 U/mL青霉素。
1.2 细胞活力测定
使用CCK-8试剂盒测定SANG对细胞活力的影响。具体步骤为,将细胞接种在96孔板(5×103细胞/孔)中,设立5组不同浓度SANG处理组(0 μM、0.5 μM、1 μM、2 μM、4 μM),作用24 h后向每个孔中加入10 μL CCK-8,4 h后用酶标仪测量450 nm处的吸光度值。
1.3 免疫蛋白印记
收获细胞,加入RIPA裂解缓冲液,冰上裂解10 min。收集上清液,使用BCA蛋白质测定试剂盒测定蛋白质浓度。将等量的蛋白质提取物(20 μg)加载到SDS-PAGE凝胶中并转移到PVDF膜上,在室温下用5%脱脂奶粉封闭1 h后,将转移的膜与caspase-3抗体、JNK抗体、p-JNK抗体、IκBα抗体或actin抗体等一抗在室温下孵育1 h,然后与IgG-HRP二抗孵育另外1 h。使用ECL检测仪器检测免疫反应性,使用Image J软件定量蛋白质条带。
1.4 流式细胞术分析
使用Annexin V-FITC/PI凋亡检测试剂盒检测由SANG诱导的细胞凋亡。具体步骤为,收获细胞并用PBS洗涤两次,将细胞悬浮于1 mL Annexin-V结合缓冲液中,在室温下孵育15 min,加入PI(5 μg/mL)并用Accuri C6流式细胞仪分析凋亡细胞,C Flow Plus软件用于确定相对DNA含量。
1.5 体外caspase-3活性测定
使用caspase-3活性测定试剂盒测量caspase-3活性。具体步骤为,收集用不同浓度的SANG(0 μM、0.5 μM、1 μM、2 μM、4 μM)或对照DMSO处理的细胞,洗涤并加入裂解缓冲液,冰上裂解30 min,然后12 000 rpm离心10 min,收集上清液。随后向每个样品中加入Ac-DEVD pNA(2 mM)并在37℃下孵育1 h,最后使用分光光度计在405 nm波长下定量每个样品的光密度。p-NA标准用于校准每个样品的caspase-3活性。
1.6 ROS含量的检测
使用ROS检测试剂盒检测细胞内ROS的含量。具体步骤为,将细胞接种在24孔板上,并用不同浓度(0 μM、0.5 μM、1 μM、2 μM、4 μM)的SANG或NAC抑制剂处理不同的时间,向细胞中加入10 mM DCFH-DA并在37℃下孵育30 min,最后通过荧光分光光度计测量激发/发射波长为488/525 nm的OD值确定细胞中的ROS含量。
1.7 体内动物实验
所有实验动物操作严格依照空军军医大学颁发的《实验动物管理条例》,实验裸鼠(约4周)购自空军军医大学实验动物中心。收集悬浮在PBS中的1×107个卵巢癌细胞SKOV3注射到裸鼠(n=5)中来制备异种移植肿瘤模型。在肿瘤达到约100 mm3的体积后,小鼠尾静脉注射SANG或DMSO对照。在整个实验期间,一组荷瘤小鼠(n=5)每隔一天静脉注射10 mg/kgSANG,而对照组小鼠(n=5)仅注射DMSO。肿瘤生长测量计算为LW2/2,其中L表示肿瘤长直径,W表示短直径。
1.8 TUNEL染色
处死小鼠并收集肿瘤样品并切片,使用TUNEL凋亡检测试剂盒,通过末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)测定来确定DNA片段,以判定组织凋亡情况。
1.9 统计分析
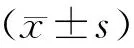
2 结果
2.1 SANG对细胞生长和凋亡的影响
CCK-8结果显示与对照组(0 μM)相比,不同浓度SANG处理组有效抑制了SKOV3细胞的增殖,且呈剂量依赖性(图1A)。Western blot结果显示,与对照组相比,SANG处理后显著激活了caspase-3的表达(图1B)。其次,流式细胞术分析表明,与对照组相比,不同浓度的SANG处理后,凋亡细胞的百分比随着细胞中SANG浓度的增加而增加(图1C)。这些结果表明SANG显著诱导SKOV3细胞凋亡,并抑制其细胞生长。

图1 SANG对细胞活力和细胞凋亡的影响Figure 1 Effects of SANG on viability and apoptosis of SKOV3 cellsNote:A.CCK-8 assay for cell viability;B.Western blot assay to detect the expression of caspase-3;C.Apoptosis analysis by flow cytometry.*P<0.05,**P<0.01,***P<0.001,when compared with the with the negative control group.
2.2 ROS的产生参与SANG诱导的细胞凋亡
caspase-3活性结果显示,与对照组相比,不同剂量的SANG显著刺激了caspase-3活性的增加,并呈剂量依赖性(图2A)。ROS检测结果显示,与对照组相比,随着SKOV3细胞中使用SANG浓度的增加,ROS的产生逐渐增加(图2B)。然而,用ROS抗氧化剂N-乙酰半胱氨酸(NAC)预处理细胞不同时间后,与SANG处理组相比,SANG+NAC联合处理组极大地抑制了SKOV3细胞中ROS的产生,并且抑制是呈时间依赖性的(图2C)。我们进一步发现,与SANG单独处理组相比,不同浓度的SANG+NAC联合处理组或NAC单独处理组显著抑制了细胞中caspase-3的活性,并且呈现浓度梯度依赖性(图2D)。这些结果表明活性氧ROS的产生参与了SANG诱导的细胞凋亡。
2.3 SANG诱导的细胞凋亡与JNK和NF-κB信号通路的激活有关
细胞信号通路的激活,如核因子-κB(NF-κB)、c-JunN-末端激酶(JNK)或P38丝裂原活化蛋白激酶(p38 MAPK),参与调节细胞生长和细胞死亡。因此,我们进一步采用信号通路抑制剂探究这些信号通路是否参与SANG诱导的细胞凋亡。结果显示,与SANG处理组相比,SANG+BAY11-7082或SANG+SP600125处理组显著减弱了caspase-3活性。相反,与SANG处理组相比,SANG+SB203850处理组对caspase-3活性的变化几乎没有影响(图3A)。Western blot结果进一步显示,与对照组相比,SANG处理后明显导致了SKOV3细胞中p-JNK和IκBα蛋白的升高,从而证明了SANG诱导的细胞凋亡过程中NF-κB和JNK信号通路被激活(图3B)。

图2 ROS产生参与SANG诱导的细胞凋Figure 2 ROS was involved in SANG-induced apoptosis of SKOV3 cellsNote:A.Caspase-3 activity assay;B.ROS release in cells treated with different concentrations of SANG;C.ROS release in cells treated with SANG and different concentrations of NAC;D.Caspase-3 activity in cells treated with SANG and different concentrations of NAC.*P<0.05,**P<0.01,***P<0.001,when compared with the ctrl or SANG group.
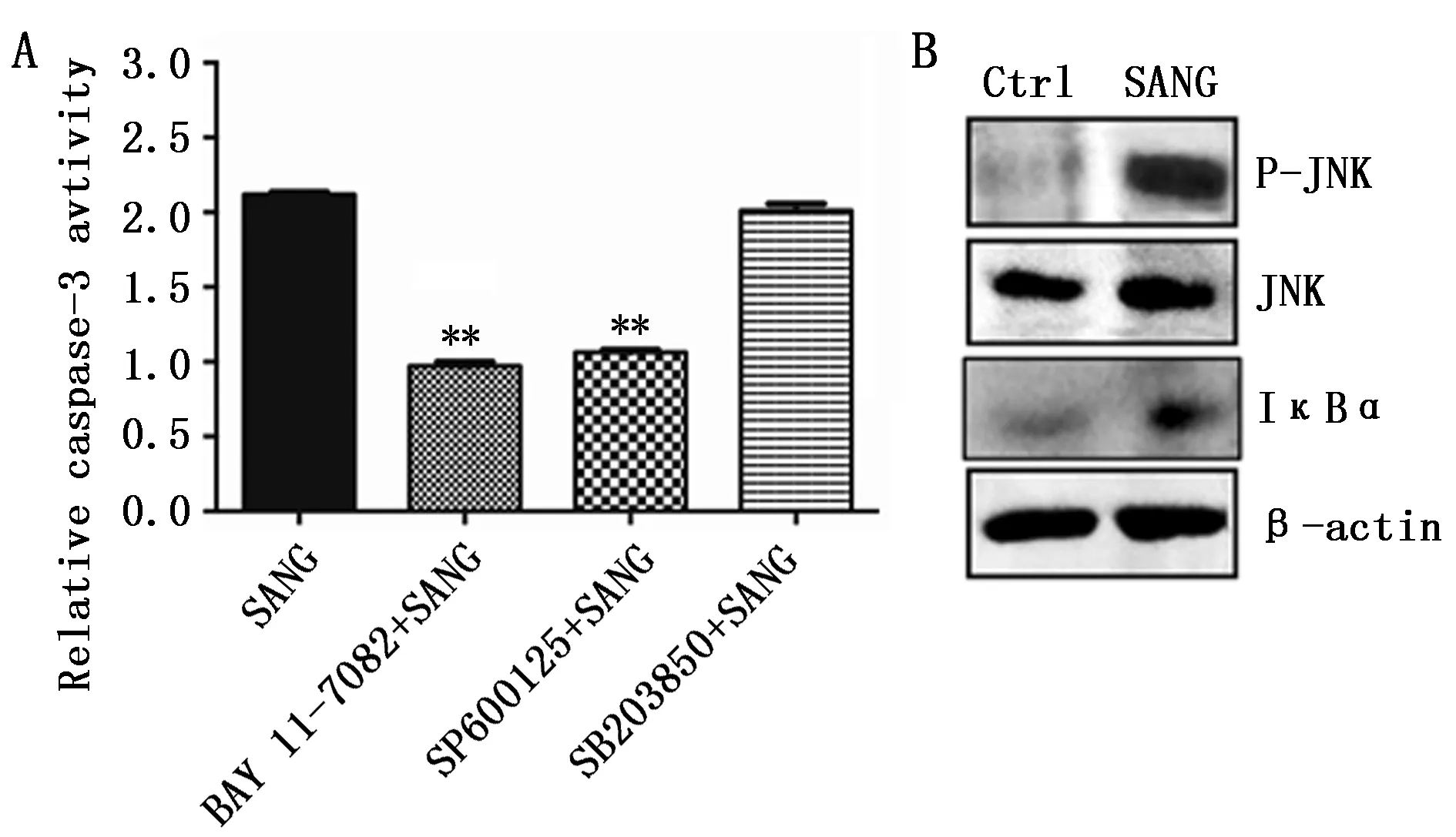
图3 JNK和NF-κB信号通路的激活介导SANG诱导的细胞凋亡Figure 3 SANG-induced apoptosis was associated with activation of JNK and NF-κB signal pathwaysNote:A.Caspase-3 activity in cells treated with SANG and different inhibitors;B.Western blot assay to detect P-JNK,JNK and IκBα expression.***P<0.01,when compared with the SANG group.
2.4 SANG抑制小鼠移植瘤模型肿瘤生长
小鼠肿瘤生长曲线显示,与对照组小鼠相比,SANG处理组的小鼠表现出显著的肿瘤生长迟缓。治疗三周后,与对照组相比,SANG处理组的小鼠肿瘤负荷减少了60%左右,表明SANG具有很强的抑制肿瘤功效(图4A)。此外,在实验结束时没有观察到两组间小鼠体重的变化,说明SANG对动物的毒性很小(图4B)。肿瘤TUNEL染色结果显示,与对照组相比,SANG处理组表现为来自凋亡细胞的绿色信号增加,表明SANG导致了更多的细胞凋亡(图4C)。这些结果证实SANG可以在体内有效诱导细胞凋亡和抑制肿瘤生长。

图4 SANG体内抑制肿瘤疗效评价Figure 4 The therapeutic efficient evaluation of SANG in a mouse model of ovarian cancer xenograftsNote:A.Tumor growth curve;B.Mice body weight;C.TUNEL staining.*P<0.05,**P<0.01,when compared with the vehicle group.
3 讨论
大多数化疗药物主要通过诱导细胞凋亡的途径来抑制肿瘤进展,并且普遍认为肿瘤化疗抵抗与细胞凋亡调控失调相关[6-8]。一些化学治疗药物,包括多柔比星和紫杉醇,通常被认为是广泛的人类肿瘤治疗中的有效药物。然而,由于耐药性和难以忍受的毒性,治疗通常是暂时的[9]。因此,一直需要探索用于克服这些限制的新型抗肿瘤药物。天然产物是肿瘤治疗的丰富来源,大量植物衍生的药物具有显著的抗肿瘤活性,并且越来越多地用于肿瘤化疗[10]。在本研究中,我们发现天然产物SANG以剂量和时间依赖性方式诱导卵巢癌细胞凋亡,并且凋亡的诱导介导活性氧ROS的产生以及JNK和NF-κB信号途径的激活。
越来越多的证据表明受损的线粒体会刺激活性氧ROS的产生,并且ROS的不成比例的产生会通过激活半胱氨酸蛋白酶导致线粒体受损,并通过内在途径诱导细胞凋亡[11]。我们的数据显示,SANG在促进细胞凋亡过程中导致ROS的产生显著增加。与NAC(一种常用的ROS抗氧化剂)共培养,可以有效地阻断ROS的产生。此外,阻断ROS的产生完全阻止了细胞凋亡并抑制了SANG诱导的caspase-3的激活。这些结果表明ROS的产生是SANG诱导卵巢癌细胞凋亡所必需的。
通常认为细胞凋亡是动态且复杂的过程,并且相同药物在不同肿瘤类型中造成的凋亡可能介导不同的信号通路途径。Han等[12]报道SANG在治疗人膀胱癌细胞的半小时内,JNK信号通路以ROS依赖性方式被激活。然而,特异性JNK抑制剂SP600125预处理并未减弱SANG诱导的细胞凋亡,提示ROS依赖性JNK激活不能介导SANG诱导的膀胱癌细胞凋亡。在另一项研究中[13],研究人员证实,SANG处理人结直肠癌HCT-116细胞导致p38MAPK和JNK信号通路活化,但特异性抑制剂对这两种通路的破坏并未显著阻止SANG诱导的细胞凋亡。在本研究中,我们发现在SKOV3卵巢癌细胞中SANG处理后可导致JNK的磷酸化和IκBα蛋白表达的增加。此外,SANG诱导的促细胞凋亡作用被BAY11-7082或SP610025特异性抑制剂而非SB203850抑制剂阻断,表明NF-κB和JNK信号通路的激活参与SANG诱导的卵巢癌细胞凋亡。我们推测这些结果之间的不一致是由于使用的不同肿瘤细胞类型所致。
综上所述,SANG可以抑制卵巢癌细胞的生长,并诱发卵巢癌细胞的凋亡,其凋亡过程介导ROS的产生以及JNK和NF-κB信号途径的激活。这些发现可以更深入地了解SANG的抗肿瘤分子机制,为卵巢癌的治疗提供了新的思路和方法。
