miRNA-409-3p表达水平对宫颈癌细胞增殖及顺铂化疗敏感性的影响
2019-09-04魏军成
申 利 魏军成
宫颈癌是导致女性相关死亡的第四大原因,虽然其发病率和死亡率在过去30年有所下降,但晚期患者的5年生存率仍低于40%[1]。目前,许多宫颈癌患者接受术前和术后辅助化疗被认为是治疗多种癌症最有效的治疗方法,但由于对化学药物的耐药性,影响了化疗的疗效[2]。因此,许多研究人员致力于阐明癌细胞如何获得化疗耐药性的机制,从而为肿瘤的治疗提供新策略。miRNA是一种非编码单链RNA,具有转录调节功能。miRNA功能障碍涉及许多病理过程,包括癌症[3]。研究中证实,miRNA的失调参与了肿瘤细胞对化疗药物耐药的调节[4]。因此,致癌miRNA的失活和抑癌miRNA的恢复是癌症治疗有希望的策略。最近的研究表明,miRNA-409-3p被认为是一种肿瘤抑制因子miRNA,但miRNA-409-3p抑制宫颈癌的机制仍不清楚[5]。自噬被认为是诱导癌细胞化学抗性的因素之一,使用3-甲基腺嘌呤(3-MA)抑制自噬可能降低乳腺癌细胞的化疗耐药性,抑制卵巢癌细胞的增殖[6]。因此,本研究检测宫颈癌组织中miRNA-409-3p的表达情况,并分析其对细胞增殖及顺铂敏感性的影响,为临床治疗顺铂耐药宫颈癌患者提供新方法。
1 材料与方法
1.1 主要试剂与仪器
宫颈癌HeLa细胞购自中国科学院典型培养物保藏委员会细胞库;顺铂购自齐鲁制药厂;miRNA-409-3p特异性siRNA和阴性对照(NC)购自上海吉玛生物科技有限公司;DMEM培养基、胰酶、胎牛血清购自美国Gibco公司;细胞计数试剂盒8(CCK-8)购自美国Amresco公司;Trizol购自美国Invitrogen公司;Prime Script RT reagent Kit Perfect Real Time RNA反转录试剂盒购自大连TaKaRa公司;Ultra SYBR One Step RNA PCR Kit荧光定量PCR试剂盒购自宝生物工程大连有限公司;PCR引物序列由大连TaKaRa公司设计并合成:miRNA-409-3p上游引物为5′-UAACACUGUCUGGUAACGAUGU-3′,下游引物为:5′-AUC GUUACCAGACAGUGUUAUU-3′;β-actin上游引物为5′-TCCCATCACCATCTTCCAG-3,下游引物为:5-GGTATCCATCGCCATGCTC-3′;细胞蛋白抽提试剂购自碧云天生物技术研究所;鼠抗Fip200、LC3和β-actin单克隆抗体购自美国Santa Cruz公司;辣根过氧化物酶HRP标记亲和纯化山羊抗鼠IgG二抗购自北京中杉金桥生物技术有限公司;二氧化碳细胞培养箱购自美国Ther-mo Revco公司;HBS-1096B酶标仪购自南京德铁实验设备有限公司;NanoDrop2000c型蛋白核酸检测仪购自美国Thermo公司;实时荧光定量PCR仪和垂直电泳仪购自美国BIO-RAD公司;凝胶成像仪购自美国UVP公司。
1.2 组织来源
组织样本来自我院2016年1月—2018年12月原发性宫颈癌标本120例,并选取癌旁组织(距肿瘤边缘>5 cm),所有患者术前均未接受化疗或放疗。同时选取良性肿瘤(子宫肌瘤、子宫腺肌症患者行全子宫切除者,术后病理证实宫颈组织无异常)患者的正常宫颈组织110例,所有研究对象平均年龄(54.43±4.57)岁。各组织样本均由本院病理学专家检查并确认。研究同意我院伦理委员会批准,严格按照《赫尔辛基宣言》执行。
1.3 细胞培养和转染
用含胎牛血清的DMEM培养基培养HeLa细胞,当细胞融合至70%左右时进行实验。将细胞随机分为3组:正常对照组、NC对照组和miRNA-409-3p mimic组。NC对照组和miRNA-409-3p mimic组HeLa细胞分别用Lipofectamine法将阴性对照(NC)和miRNA-409-3p mimic转染到HeLa细胞,继续培养48 h后收获细胞,进行相关检测。
1.4 RT-PCR检测miRNA-409-3p mRNA表达
取标本组织和转染后的HeLa细胞,进行总RNA提取,测定mRNA浓度和纯度,将提取的总RNA根据反转录试剂盒说明书合成cDNA,根据SYBR Premix Ex Taq TM II荧光定量PCR试剂盒说明书,用制备20 μL反应体系进行扩增。以β-actin作为内参,采用2-△△Ct法计算miRNA-409-3p mRNA的相对表达量。
1.5 CCK-8法检测细胞增殖率
三组细胞转染后以5×103/孔接种于96孔板中,200 μL/孔,待细胞贴壁分别不加入顺铂和加入终浓度为10 μg/L的顺铂,继续培养0h、6 h、12 h、24 h、36 h和48 h后,向培养板中加入10 μL CCK-8试剂,37℃继续培养4 h,用酶标仪在630 nm处测定吸光度值,计算细胞增殖率,每组设3个平行孔。
1.6 Western blot法检测Fip200和LC3蛋白的表达水平
三组细胞转染后接种于25 cm2的培养瓶中培养至细胞贴壁,加入含顺铂(14 μg/mL)的培养液培养48 h,收获细胞,进行细胞蛋白质的提取,进行电泳、切胶;分别孵育Fip200和LC3蛋白一抗,4℃下过夜,孵育相对于二抗,采集图像进行分析。
1.7 统计分析
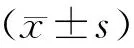
2 结果
2.1 正常宫颈组织、宫颈癌旁组织与宫颈癌组织中miRNA-409-3p的表达
正常宫颈组织中miRNA-409-3p mRNA的相对表达水平高于宫颈癌组织,差异有统计学意义(P<0.05);宫颈癌旁组织与正常宫颈组织miRNA-409-3p mRNA的相对表达水平差异无统计学意义(P>0.05)(表1)。
表1 正常宫颈组织、宫颈癌旁组织与宫颈癌组织中miRNA-409-3p的表达
Table 1 Expression of miRNA-409-3p in normal cervical tissue,paracancerous tissues and cervical cancer tissues

GroupCasesmiRNA-409-3pNormal cervical tissue1101.00±0.05 Paracancerous tissues1200.94±0.06 Cervical cancer tissues1200.18±0.02#*
Notes:#P<0.05,when compared with normal cervical tissues;*P<0.05,when compared with paracancerous tissues.
2.2 转染miRNA-409-3p mimic后各组细胞中miRNA-409-3p mRNA的表达
通过转染miRNA-409-3p mimic后,miRNA-409-3p mimic组miRNA-409-3p mRNA的相对表达水平较正常对照组显著上调,差异有统计学意义(P<0.05),提示miRNA-409-3p被高效转染到细胞中。NC对照组与正常对照组miRNA-409-3p mRNA的相对表达水平无统计学差异(P>0.05)(表2)。
表2 转染miRNA-409-3p mimic后各组细胞中miRNA-409-3p mRNA的表达
Table 2 Expression of miRNA-409-3p mRNA in Hela cells transferred with miRNA-409-3p mimic and its controls

GroupCasesmiRNA-409-3pNormal control 31.00±0.04 NC control31.03±0.05 miRNA-409-3p mim-ic34.26±0.32#*
Notes:#P<0.05,when compared with the normal control group;*P<0.05,when compared with the RNA control group.
2.3 转染miRNA-409-3p mimic后各组细胞增殖的影响
正常对照组和NC对照组的细胞增殖率差异无统计学意义(P>0.05);miRNA-409-3p mimic组HeLa细胞增殖率较正常对照组和NC对照组显著降低,差异有统计学意义(P<0.05)(表3)。

表3 转染miRNA-409-3p mimic后各组细胞增殖的影响
Notes:#P<0.05,when compared with the normal control group;*P<0.05,when compared with the RNA control group.
2.4 转染miRNA-409-3p mimic后顺铂对各组细胞增殖率的影响
给予顺铂干预后,正常对照组和NC对照组的细胞增殖率先降低后迅速增长,差异无统计学意义(P>0.05);给予顺铂干预后,与正常对照组和NC对照组相比,miRNA-409-3p mimic组的细胞增殖率明显降低,差异有统计学意义(P<0.05)(表4)。

表4 转染miRNA-409-3p mimic后顺铂对各组细胞增殖率的影响
Notes:#P<0.05,when compared with the normal control group;*P<0.05,when compared with the RNA control group.
2.5 转染miRNA-409-3p mimic后顺铂对各组细胞中Fip200和LC3蛋白表达的影响
给予顺铂干预后,正常对照组和NC对照组细胞中Fip200蛋白表达水平和LC3Ⅱ/LC3Ⅰ比值无统计学差异(P>0.05);给予顺铂干预后,与正常对照组和NC对照组相比,miRNA-409-3p mimic组细胞中Fip200蛋白表达水平和LC3Ⅱ/LC3Ⅰ比值显著降低,差异有统计学意义(P<0.05)(图1,表5)。
表5 转染miRNA-409-3p mimic后顺铂对各组细胞中Fip200和LC3蛋白表达的影响
Table 5 Effects of cisplatin on the expression of Fip200 and LC3 proteins in Hela cells after transfected with miRNA-409-3p mimic

GroupCasesFip200 LC3Ⅱ/LC3ⅠNormal control 30.57±0.040.24±0.03NC control30.60±0.070.21±0.04miRNA-409-3p mim-ic30.29±0.03#*0.10±0.02#*
Notes:#P<0.05,when compared with the normal control group;*P<0.05,when compared with the RNA control group.
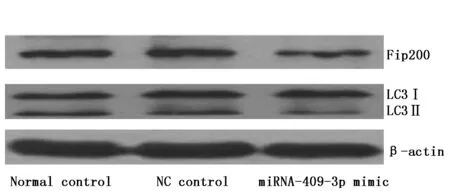
图1 转染miRNA-409-3p mimic后顺铂对各组细胞中Fip200和LC3蛋白表达的影响Figure 1 Effects of cisplatin on the expression of Fip200 and LC3 proteins in Hela cells after transfected with miRNA-409-3p mimic
3 讨论
miRNA的异常表达参与了宫颈癌的病理生理过程[7]。近期研究表明,miRNA-409-3p在肿瘤进展中发挥重要作用。例如,miRNA-409-3p通过靶向IRS2抑制直结肠癌细胞的生长和侵袭[8];同时,miRNA-409-3p靶向调控ZEB1,影响乳腺癌细胞增殖和代谢[9]。然而,miRNA-409-3p在宫颈癌中的表达和功能尚不清楚。本研究结果提示,上调miRNA-409-3p的表达可以抑制宫颈癌细胞增殖。
阿霉素是多种癌症的一线临床治疗方案,但其耐药性影响了临床疗效。自噬与多种常见疾病相关,在许多肿瘤中观察到失调的自噬活性[10]。研究发现,自噬是肿瘤细胞耐药性的重要组成部分。γ辐射可以触发自噬,由此诱导胶质瘤干细胞对化疗的耐药性,而且自噬诱导缺氧也加速乳腺癌细胞对化疗治疗的耐药性[11-12]。研究表明恶性肿瘤中的miRNA与自噬的调控相关,这可能影响肿瘤细胞对某些化疗药物的耐药性[13]。因为越来越多的研究表明,自噬是由miRNA调控,并在肿瘤细胞耐药过程中发挥关键作用。因此,有研究建议将其作为开发分子特异性疗法的目标的潜力。
在对卵巢癌的研究发现,通过上调miR-409-3p水平,可以抑制Fip200介导的自噬,从而增加OV-1063细胞对顺铂的敏感性,证实了自噬是肿瘤细胞耐药形成的关键环节[14]。Fip200是哺乳动物Atg17基因表达的目标蛋白,在自噬起始过程中起关键作用。以多种细胞系和小鼠模型为研究对象,发现Fip200在自噬过程中起着不可或缺的作用[15]。同时,将OV-1063细胞移植到裸鼠的实验结果表明,Fip200介导的自噬是被miR-409-3p抑制,从而增强OV-1063细胞对顺铂的化疗敏感性[16]。通过生物信息学分析结果显示,miR-409-3p与Fip200 mRNA的3′-UTR结合,并在OV-1063细胞的双荧光素酶报告基因实验中得到验证[14]。自噬蛋白标记物LC3在自噬激活时由LC3-Ⅰ转化为酶促LC3-Ⅱ,LC3B-I蛋白向LC3B-II的转化是自噬体形成过程中自噬诱导的一个标志[17]。本研究结果显示,上调miRNA-409-3p的表达可以降低Fip200蛋白表达水平和LC3Ⅱ/LC3Ⅰ的比值,抑制了自噬的发生,增加HeLa细胞对顺铂的敏感性,提示miRNA-409-3p通过参与自噬调控肿瘤细胞对顺铂的敏感性。
综上所述,miRNA-409-3p在宫颈癌组织中低表达,上调miRNA-409-3p水平可以抑制HeLa细胞增殖,增加HeLa细胞对顺铂的敏感性,其机制可能与抑制Fip200表达有关,但其作为临床治疗宫颈癌的方法还需要大量研究加以论证。
