草酸处理对采后哈密瓜果实膜脂代谢的影响
2019-09-04茅林春李学文辉吕刘彩虹侯琛元
王 静 茅林春 杨 璐 李学文 张 辉吕 卓 刘彩虹 李 乾 侯琛元
(1 浙江大学生物系统工程与食品科学学院 浙江省农产品加工技术研究重点试验室 杭州310058 2 新疆农业大学食品科学与药学学院 乌鲁木齐830000 3 新疆林业科学院林业测试中心 乌鲁木齐830000)
新疆哈密瓜栽培历史悠久,是当地的主要水果之一,其贮藏量位居新疆果品之首。哈密瓜果实属于典型的呼吸跃变型果实,采后腐烂迅速,损失非常严重。低温冷藏虽能有效抑制果实采后腐烂和品质下降,但哈密瓜果实对低温环境敏感,低温贮藏易发生冷害。冷害的发生限制低温贮藏技术在哈密瓜果实采后贮运中的应用。如何增强哈密瓜果实采后对低温的耐受性,控制冷害的发生,已成为哈密瓜果实采后贮运中急需解决的问题。
草酸是一种广泛分布于动、植物及真菌体中的有机酸,同时也是一种新型植物的非生物诱导剂,在调节植物的抗逆反应中起着重要作用[1]。有研究发现草酸处理可降低芒果[2]、石榴[3-4]和竹笋[5]等果蔬的冷害现象;诱导桃果实[6-7]、茄子[8]抗氧化酶性活性提高;提高芒果脯氨酸代谢关键酶活性,降低冷害发生[9];维持猕猴桃果实较高的ATP 和能荷,提高果实的抗氧化能力,增强其抗冷性[10];保持桃果实较高酶活性与能量及高的不饱和脂肪酸/饱和脂肪酸,减轻冷害的发生[11]。草酸处理是如何调控哈密瓜果实膜脂代谢影响冷害的? 尚未见相关报道。
作者前期研究发现15 mmol/L 草酸溶液处理哈密瓜果实10 min,可显著降低冷害。在此基础上,本文重点研究15 mmol/L 草酸溶液处理对哈密瓜冷害与膜脂代谢的影响,旨在为哈密瓜采后保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
以“西州密25 号”哈密瓜(属厚皮甜瓜亚种Cucumis melo var.reticulatus Naud.) 为原料,于2016年7月15日摘自吐鲁番鄯善瓜商品瓜基地,单个平均质量为2.70 kg,瓜中心平均糖度14%~15%,瓜皮呈青色,布满灰色网纹,瓜瓤泛橙色。采后立即用泡沫网状发套将果实单独包装,每个纸箱(40 cm×35 cm×28 cm)中放置4 个瓜,立即运至试验室。选择成熟度基本一致、大小适中、无任何机械损伤的果实作为试验材料。
草酸(OA),为分析纯,国药集团上海化学试剂公司;次氯酸钠,国药集团上海化学试剂公司;石英砂,国药集团上海化学试剂公司;海砂,漳州天然石英砂厂;石油醚、无水硫酸钠、亚油酸钠、Na2HPO4·2H2O 和NaH2PO4·H2O,郑州万瑞达化工产品有限公司;Triton X-100、交联聚乙烯吡咯烷酮(PVPP),上海江莱生物科技有限公司;冰醋酸、无水醋酸钠,青岛瑞升化学有限公司;牛血清蛋白质,考马斯亮蓝G-250,Sigma 公司;PLD 试剂盒,上海恒远生物有限公司;胆碱氧化酶、辣根过氧化物酶,南京杜莱生物技术有限公司。
1.2 仪器与设备
SIGMA 3-18K 型低温高速离心机,上海知信试验仪器有限公司;SP-752 型紫外-可见分光光度计,上海光谱有限公司;JF2004 型电子分析天平,上海麦聚瑞电子仪器有限公司;HH-4 型恒温水浴锅,国华电器有限公司;原子分光光度仪PinAAcle99T,北京浩天晖仪器有限公司;日本岛津气-质谱联用仪GCMS-QP2010Plus,上海普迪生物技术有限公司
1.3 试验方法
将挑选好的“西州蜜25 号”哈密瓜擦拭干净,置于浓度为15 mmol/L 草酸溶液(0.5 mL/L 吐温-20)中浸泡10 min,以蒸馏水(0.5 ml/L 吐温-20)浸泡10 min 作为对照。充分晾干后装箱,贮藏于机械冷库内(3~5 ℃)(西州密25 号哈密瓜受冷害的温度为3 ℃,依据刘同业等[12]研究结论)。每个处理各136 个瓜(每次处理4 个瓜,共计34 次),低温冷藏,平均每隔6 d 取1 次样,共取样7 次。每个处理取3 个瓜,3 个重复,共计9 个瓜。每个指标重复3 次,分别在瓜的前、中、后3 个部位取约2 cm 厚的瓜皮组织,混匀后用液氮冷冻并在-80 ℃冰箱中放置。
1.4 测定方法
1.4.1 冷害指数的测定 参照毕阳等[13]的方法,稍作改动。将果实从贮藏冷库转移到室温(25 ℃)放置1 d 后统计冷害情况。每个处理取5 个瓜,3个重复,共计15 个瓜。症状按严重程度分为5 级:0 级,果面光洁,没有冷害症状;1 级,有轻微的下陷冷害斑,占果面总面积15%以下;2 级,冷害面积占果面的比例小于40%;3 级,冷害面积小于果面的70%;4 级,冷害面积占果面总面积的70%以上;5 级,冷害面积占果面总面积的100%,记录3组的冷害级数,冷害指数=移(果实冷害级别×该级别的果实数)/(果实总数量×最高级别)。
1.4.2 脂肪酸组成及含量的测定 提取哈密瓜果皮300 g,打碎后放入三角瓶中,加入海砂后搅拌吸水拌干,按照1∶1.5 的体积比加入样品和石油醚,在三角瓶中加入450 mL 石油醚后摇匀,静止4 h 以上。将提取的上清液转移至另一三角瓶中,提取时在漏斗颈部塞入脱脂棉,并在其上铺一层无水硫酸钠吸水,将提取好的上清液在旋转蒸发仪中浓缩得到油层,将油层转移至0.2 mL 的离心管中,冷冻储藏。采用日本岛津气-质谱联用仪GCMS-QP2010Plus 测脂肪酸种类和含量,结果以相对百分含量%表示。
气相色谱仪测定条件:进样口分流(1∶20),载气为氦气,进样口压力120 kPa,进样口温度240℃,进样体积0.5 μL。色谱柱升温程序:在温度180 ℃保留30 min,然后以10 ℃/min 的速度升温到220 ℃保持2 min。肪酸组分定量分析采用对各组分峰面积积分,用归一化法计算各组分的百分含量。
式中,si——膜脂不饱和脂肪酸相对含量,%;ti——该不饱和脂肪酸所含不饱和键的数量。
膜脂脂肪酸不饱和度=不饱和脂肪酸相对含量(UFA)/饱和脂肪酸相对含量(FA)。
1.4.3 脂氧合酶活性(LOX)的测定 按照陈昆松等[15]的方法并稍作改动。取5.0 g 冷冻果皮组织,室温(25 ℃)下反应,于234 nm 处测定吸光度值。加酶液15 s 后开始计时,每隔30 s 记录1 次,记录3 min 内OD234值变化,重复3 次。酶活性结果以ΔOD234·min-1·g-1蛋白表示。
1.4.4 蛋白质含量测定 按照Bradford[16]考马斯亮蓝染色法测定,以牛血清蛋白作标准曲线。标准曲线为Y=0.0053X+0.025,R2=0.992。
1.4.5 PLD 活性的测定 参照赵宇瑛[17]的方法。重复3 次,酶活性结果以ΔOD492·min-1·g-1蛋白表示。
1.4.6 Ca2+含量的测定 参照Yapa 等[18]的方法提取,采用原子分光光度仪PinAAcle99T 测定。结果以mg·kg-1表示。
1.4.7 RNA 提取,cDNA 合成与荧光定量PCR(Q-PCR) 引物分析 取贮藏在3 ℃条件中0,7,14,21,28,35 d 及42 d 的哈密瓜果实,在赤道周围取约2 cm 厚的果皮组织用来提取总RNA,取2 μL 总RNA 反转录成cDNA,然后取2 μL cDNA进行实时荧光定量PCR。具体方法可参考Wang等[14]。
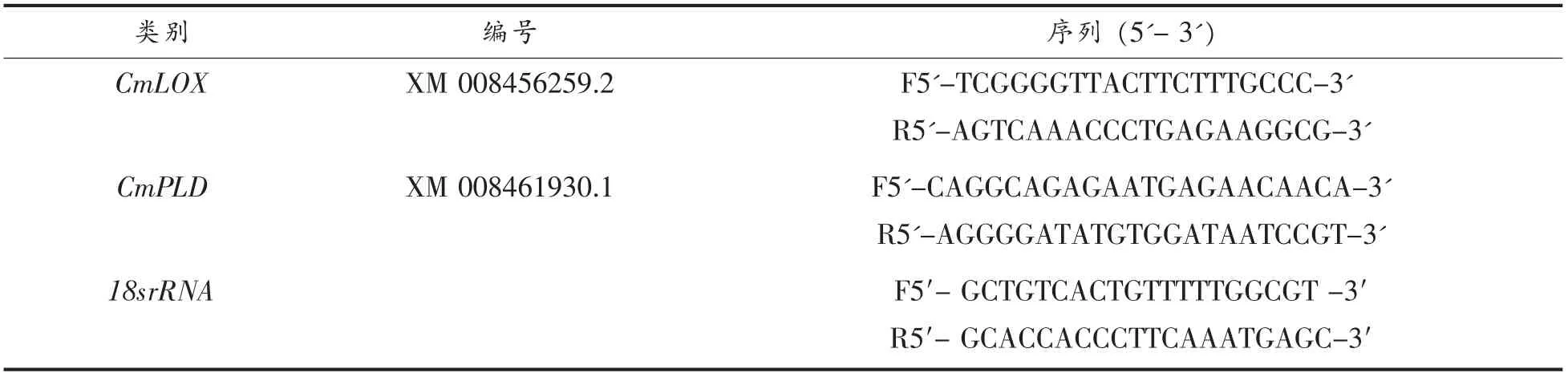
表1 荧光定量检测特异性引物设计和合成Table 1 Specific primers for PLD and LOX in real time fluorescent quantitative PCR
2 结果与分析
2.1 草酸处理对哈密瓜果实冷害指数和冷害症状的影响
由图1可知,哈密瓜果实贮藏至14 d 开始出现冷害,且随着贮藏时间的延长冷害指数逐步增加,贮藏至42 d,冷害指数上升较明显,对照果实的冷害指数始终高于草酸处理的果实 (P<0.05),说明草酸处理可以降低哈密瓜果实的冷害指数。随着哈密瓜冷害指数的上升,冷害症状开始加剧,贮藏至21 d,对照果实的冷害凹陷斑多于草酸处理的果实(图2a)。贮藏至42 d,对照果实冷害症状与草酸处理的果实相比,明显严重(图2b),且伴有失水现象发生。
以上结果表明,15 mmol/L 草酸处理可以作为减轻哈密瓜果实贮藏过程中冷害发生的条件之一。

图1 草酸处理对3~5 ℃冷藏42 d 哈密瓜果实冷害指数的影响Fig.1 Effect of OA treatment on CI index of Hami melon fruits after cold storage at 3-5 ℃for 42 d

图2 哈密瓜果实低温(3~5 ℃)冷藏21 d(a)和42 d(b)的冷害症状图Fig.2 Chilling injury symptom of Hami melon fruits after cold storage at 3-5 ℃for 14 days and 42 days
2.2 草酸处理对哈密瓜果皮饱和脂肪酸相对含量的影响
哈密瓜果皮中饱和脂肪酸主要有2 种:棕榈酸(C16:0)和硬酯酸(C18:0)。由图3a 可知,冷藏0~14 d 对照哈密瓜果皮棕榈酸(C16:0)相对含量缓慢上升,冷藏14~35 d 急剧下降至最低点,冷藏35~42 d 又缓慢上升,第42 天棕榈酸(C16:0)相对含量为22.1%。冷藏0~7 d 草酸处理果皮的棕榈酸(C16:0)相对含量缓慢上升,7~42 d 草酸处理果皮的棕榈酸(C16:0)相对含量降至最低点为20.78%。除第35天外,草酸处理的哈密瓜果皮棕榈酸(C16:0)相对含量低于对照(P<0.05),说明草酸处理可降低哈密瓜果皮棕榈酸(C16:0)的相对含量。
由图3b 可知,对照和草酸处理的哈密瓜果皮硬脂酸(C18:0)相对含量变化趋势基本相似,冷藏0~35 d 果皮硬脂酸(C18:0)相对含量下降,冷藏35~42 d 上升,除第35 天外,草酸处理的哈密瓜果皮硬脂酸相对含量显著低于对照(P<0.05)。
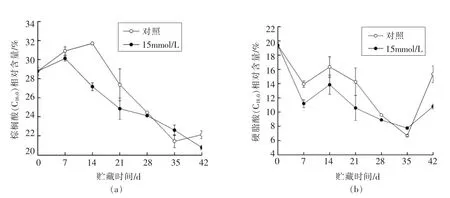
图3 草酸处理对3~5 ℃冷藏42 d 哈密瓜果皮棕榈酸(C16:0)(a)和硬脂酸(C18:0) (b)相对含量的影响Fig.3 Effect of OA treatment on palmitic acid (C16:0) (a) and stearicacid (C18:0) (b) relative contents in pericarp of Hami melon fruits after cold storage at 3-5 ℃for 42 d
2.3 草酸处理对哈密瓜果皮不饱和脂肪酸含量的影响
哈密瓜果皮中不饱和脂肪酸主要有4 种:亚油酸(C18:2)、油酸(C18:1)、亚麻酸(C18:3)和二十碳四烯酸(C20:4)。
由图4a 可知,冷藏0~28 d 草酸处理的哈密瓜果皮亚油酸(C18:2)相对含量缓慢上升且高于对照。贮藏至第35 天草酸处理与对照果皮的亚油酸(C18:2)相对含量接近,冷藏28~42 d 迅速升高,贮藏至第42 天对照和草酸处理的亚油酸(C18:2)相对含量达到最高值,分别为32.13%和38.14%。分析发现,除28 d 和35 d 外,草酸处理的哈密瓜果皮亚油酸(C18:2)相对含量均高于对照(P<0.05),表明草酸处理可以有效提高果皮亚油酸(C18:2)相对含量,对提高膜脂的流动性具有积极作用。
由图4b 可知,冷藏0~7 d 对照和草酸处理的哈密瓜果皮油酸(C18:1)相对含量增加,冷藏7~42 d,出现不同程度的降低。除28 d 和35 d 外,草酸处理的哈密瓜果皮油酸(C18:1)相对含量显著高于对照(P<0.05),说明草酸处理可缓解哈密瓜果皮油酸(C18:1)相对含量下降,对果实抵抗低温胁迫具有一定的帮助。
由图4c 可知,冷藏0~28 d 对照和草酸处理的哈密瓜果皮亚麻酸(C18:3)相对含量大幅度增加,且草酸处理显著高于对照(P<0.05),冷藏28~42 d对照和草酸处理果皮的亚麻酸(C18:3)相对含量比较接近,贮藏至42 d 亚麻酸(C18:3)相对含量达到最高值,分别为27.18%和27.57%(P>0.05),说明草酸处理提高贮藏前期(0~28 d)果皮亚麻酸(C18:3)相对含量。
由图4d 可知,冷藏0~21 d 草酸处理的哈密瓜果皮二十碳烯酸(C20:4)相对含量缓慢下降,21~28 d 其相对含量迅速上升且第28 天达到峰值6.64%,之后缓慢下降,至42 d,与起始点相比提高9.8%。相比之下,对照果皮的二十碳烯酸(C20:4)相对含量则低于草酸处理,贮藏至42 d,对照与起始点相比其相对含量下降22%,表明草酸处理可提高哈密瓜果皮二十碳烯酸(C20:4)的相对含量 (P<0.05)。
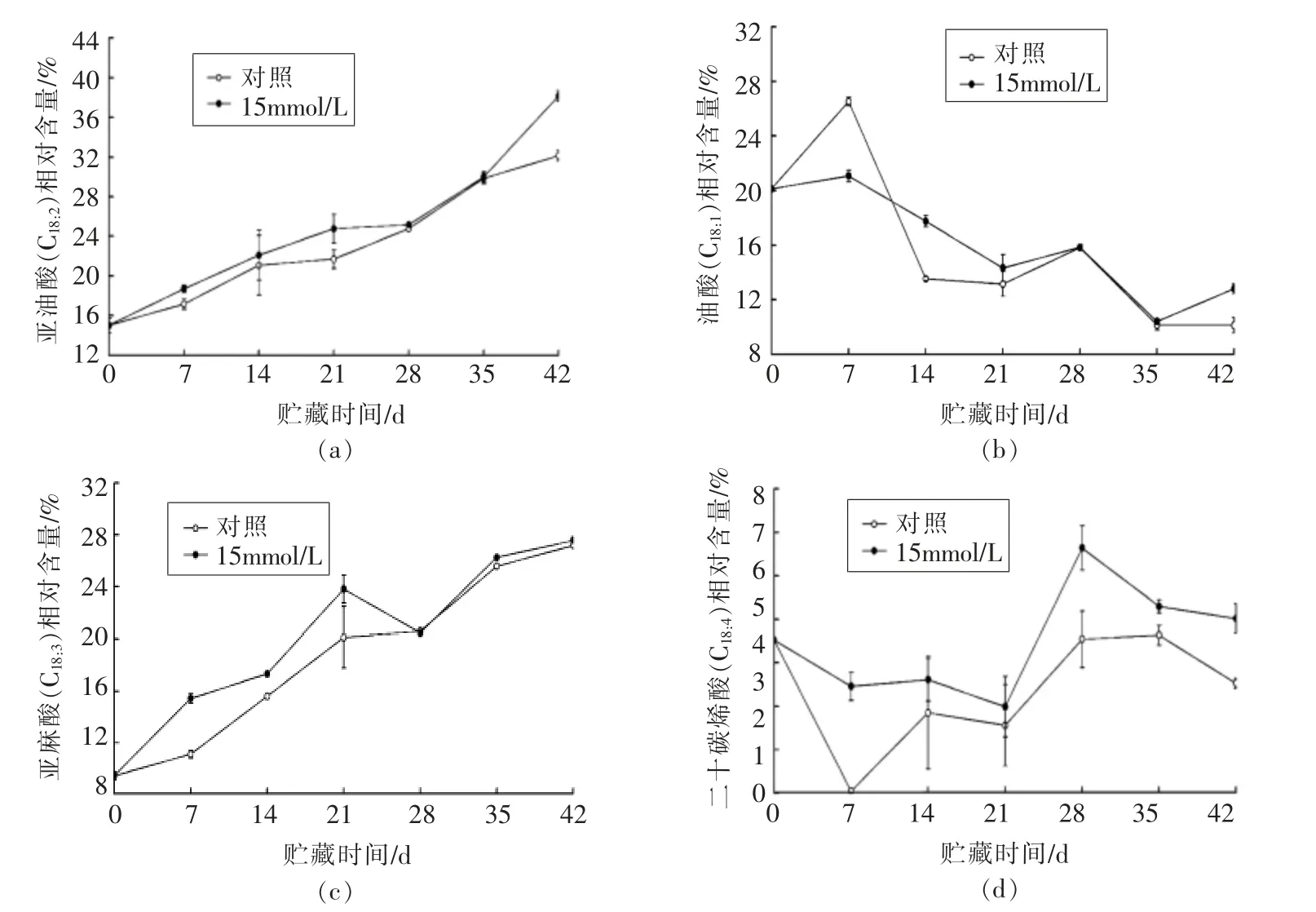
图4 草酸处理对3~5 ℃冷藏42 d 哈密瓜果皮亚油酸(C18︰2)(a)、油酸(C18︰1)(b)、亚麻酸(C18︰3)(c)和二十碳四烯酸(C20:4)(d)相对含量的影响Fig.4 Effect of OA treatment on linoleic acid (C18:2) (a) ,oleic acid(C18:1)(b),linolenic acid (C18:3) (c)and arachidonic acid (C20:4) (d)relative contents in pericarp of Hami melon fruits after cold storage at 3-5 ℃for 42 d
2.4 草酸处理对哈密瓜果皮不饱和指数和不饱和度的影响
膜脂脂肪酸不饱和指数(IUFA)是衡量膜脂脂肪酸不饱和程度的重要指标之一,能反映膜的流动性[21]。由图5a 可知,冷藏0~42 d 草酸处理的哈密瓜果皮不饱和指数持续明显上升,而对照呈忽高忽低的变化趋势。除第21 天外,草酸处理的哈密瓜果皮不饱和指数明显高于对照(P<0.05),表明草酸处理可提高哈密瓜果皮不饱和指数。
膜脂脂肪酸不饱和度是衡量膜脂脂肪酸不饱和程度的另一个重要指标,它可反映膜脂脂肪酸的构成和比例变化[21]。由图5b 可以发现,对照和草酸处理的哈密瓜果皮不饱和度大体呈明显上升趋势,且草酸处理显著高于对照(P<0.05),说明草酸处理可提高哈密瓜果皮膜脂脂肪酸不饱和度。
2.5 草酸处理对哈密瓜果皮脂氧合酶 (LOX)和磷脂酶D(PLD)活性及Ca2+含量的影响
脂氧合酶(LOX)是一种广泛存在于植物体内的含非血红素铁的蛋白质,它可催化植物中亚油酸和亚麻酸等多元不饱和脂肪酸的加氧反应,破坏磷脂双分子层,从而引起细胞膜破坏[22]。由6a可知,对照果皮LOX 活性在冷藏第7 天和第21天出现峰值,值分别为36.14ΔOD234·min-1·g-1蛋白和36.24ΔOD234·min-1·g-1蛋白,冷藏21~42 d,出现持续下降至最低点。冷藏0~21 d 草酸处理的哈密瓜果皮LOX 活性持续下降,冷藏21~28 d 出现短暂上升,后出现急剧下降的趋势,贮藏至第42 天下降到最低点。整个贮藏过程中草酸处理的哈密瓜果皮LOX 活性显著低于对照(P<0.05),表明草酸处理可降低哈密瓜果皮LOX 活性。
由图6b 得知,冷藏0~14 d 对照和草酸处理的哈密瓜果皮PLD 活性缓慢上升,14~42 d 两个处理的LOX 活性出现不同程度的下降,与起始点相比,贮藏至42 d 的草酸处理果皮PLD 活性下降39%,而对照则升高16%。在整个贮藏过程中草酸处理的哈密瓜果皮PLD 的活性显著低于对照(P<0.05),说明草酸处理可降低哈密瓜果皮PLD 活性。
由图6c 发现,冷藏0~7 d 对照和草酸处理的果皮Ca2+含量急剧上升,冷藏7~42 d 两个处理果皮的Ca2+含量变化趋势基本相似,且大致为增加状态。在整个贮藏过程中,与对照相比较,草酸处理提高哈密瓜果皮膜上结合的Ca2+含量。
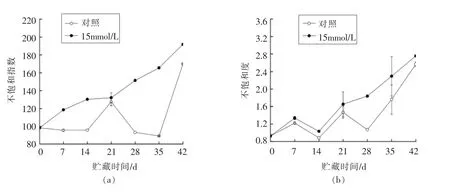
图5 草酸处理对3~5 ℃冷藏42 d 哈密瓜果皮不饱和指数(a)和不饱和度(b)的影响Fig.5 Effect of OA treatment on index of unsaturated fatty acids (IUFA) (a) and unsaturated degree of fatty acids (b) in pericarp of Hami melon after cold storage at 3-5 ℃for 42 d

图6 草酸处理对3~5 ℃冷藏42 d 哈密瓜果皮LOX(a)、PLD(b)活性及Ca2+(c)含量的影响Fig.6 Effect of OA treatment on LOX(a),PLD(b) activities and Ca2+ content in pericarp of Hami melon fruits after cold storage at 3-5 ℃for 42 d
2.6 草酸处理对哈密瓜CmLOX 和CmPLD 表达的影响
由图7a 得知,在整个贮藏过程中,草酸处理组哈密瓜的CmLOX 表达量(除第14 天)始终低于对照组(P<0.05),表明草酸处理抑制CmLOX 表达量上升。与LOX 活性变化趋势相似。
图7b 显示,两组哈密瓜的CmPLD 表达量变化趋势相似,先上升后下降,在整个贮藏过程中草酸处理组均低于对照组,与PLD 活性变化相近。贮藏0~14 d 草酸处理组的CmPLD 表达量缓慢上升,14~42 d 始终保持较低的水平,贮藏至42 d 降低至最低点。对照组CmPLD 表达量在贮藏0~21 d缓慢上升,在21~42 d 略微下降,然而显著高于草酸处理组(P<0.05),说明草酸处理可降低哈密瓜CmPLD 的表达水平。
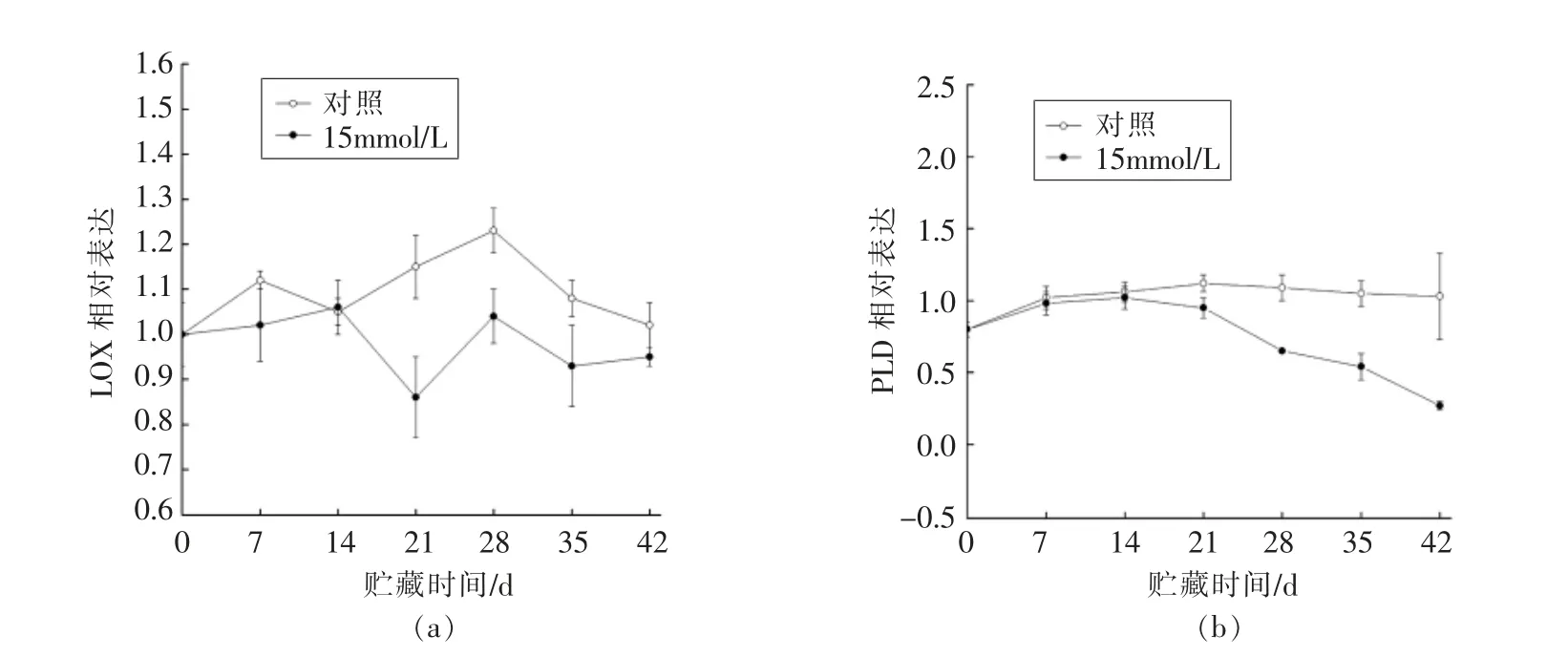
图7 草酸处理对哈密瓜CmLOX(a)和CmPLD(b)表达量的影响Fig.7 Effect of OA treatment on the expression of CmLOX (a) and CmPLD (b) in Hami melon
3 讨论
本研究发现,“西周密25 号”哈密瓜低温冷藏14 d,常温下放置1 d 后出现不规则的水渍状斑点冷害症状。随着低温冷藏时间的延长,斑点相连,发展成不规则的下陷斑块,冷害凹陷斑面积逐渐增大,失水皱缩现象伴随出现。与毕阳等[23]对哈密瓜冷害症状的研究报道基本相似。由图2a 和2b可知,对照果实冷害症状与草酸处理相比,冷害凹陷斑数量增多,表明对照果实外表皮的细胞膜结构已被一定程度的破坏。
诸多研究表明,细胞膜是生物体的重要组成部分,当植物体遭受逆境胁迫时,膜完整性常会遭到破坏,膜透性增加,细胞离子泄露,导致生理生化代谢发生紊乱,引起细胞组织结构崩溃瓦解[24]。草酸处理降低哈密瓜果实细胞膜渗透率和果皮MDA 含量,对降低膜脂过氧化程度,保持细胞膜结构的完整性起到一定的作用。该结论在Wang等[14]的研究结果中得到证实。由于与膜结合的PLD 是植物体内细胞膜氧化反应的主要酶,也是重要的跨膜信号转导酶,可作为信号分子催化膜脂中不饱和脂肪酸发生过氧化反应[25]。LOX 是以不饱和脂肪酸为底物,降低膜脂脂肪酸的不饱和程度,加剧对植物组织细胞结构和功能的破坏[26-27]。在膜脂代谢途经中PLD 与LOX 是起关键作用的酶[28]。本试验发现,正是由于15 mmol/L 草酸处理降低PLD 和LOX 活性(图6a,6b),从而降低细胞膜的降解和过氧化速度,降低冷害的发生(图1)。这可能与草酸处理提高哈密瓜果皮与膜结合的Ca2+含量有关(图6c)。有研究表明,PLD 活性受到细胞质内微量的Ca2+浓度调控,且细胞质中相对较高的Ca2+浓度,可激活细胞膜自身催化发生脂质降解,从而提高LOX 活性[25]。作者认为,草酸处理可能是通过提高哈密瓜果皮与膜结合的Ca2+含量,促进CmLOX 和CmPLD 表达量下降(图7a,7b)和活性降低(图6a,6b),降低细胞膜的降解和过氧化速度,抑制细胞膜渗透率和膜脂过氧化产物MDA 含量上升,提高果实对低温的耐受性[29]。而对照果实PLD 和LOX 活性较高,脂质过氧化作用加剧,促进膜降解的同时,伴随自由基的介入,导致膜渗透率上升,离子发生泄漏,细胞膜完整性和区室化结构被破坏,冷害加剧[28]。与荔枝果实贮藏期间果皮脂酶、PLD 和LOX 活性增加导致褐变和品质劣变的结论有相似之处[30]。
脂肪酸是植物细胞膜的主要组成部分,细胞膜上脂肪酸组分的变化会改变细胞膜的功能[31]。本试验结果表明,与对照相比,草酸处理的果皮中PLD 和LOX 活性保持较低(图6a,6b),使得酶的底物——不饱和脂肪酸消耗量减少,因此亚油酸(C18:2)、油酸(C18:1)、亚麻酸(C18:3)和二十碳四烯酸(C20:4)等不饱和脂肪酸相对含量高于对照(图4a,4b,4c,4d)。饱和脂肪酸棕榈酸(C16:0) 和硬脂酸(C18:0)等相对含量则低于对照(图3a,4b),表明草酸处理提高不饱和脂肪酸相对含量,降低饱和脂肪酸相对含量。同时草酸处理提高膜脂脂肪酸不饱和指数(IUFA)和膜脂脂肪酸不饱和度(图5a,5b),增加膜脂的不饱和程度,促进膜的流动性,控制果实冷害和衰老症状的发展。有研究表明,热空气处理抑制枇杷果实细胞膜氧化相关PLD 活性上升,维持细胞膜较高的不饱和脂肪酸含量和细胞膜流动性,降低果实衰老及褐变产生[32]。草酸处理降低桃果实冷害症状与脂肪酸不饱和度较高有关[5]。
本研究还发现,对照哈密瓜果皮LOX 活性(图6a)与二十碳四烯酸(C20:4)相对含量(图4d)呈显著 (P = 0.037 <0.05) 负相关 (相关系数R=-0.737),而与油酸(C18:1)、亚油酸(C18:2)和亚麻酸(C18:3)等不饱和脂肪酸相对含量没有明显的相关(P>0.05),经相关性分析LOX 的底物是二十碳四烯酸(C20:4)。与罗自生[33]对柿果、孔祥佳[24]对橄榄看法“LOX 的底物是亚麻酸”的结论不同。
综上所述,15 mmol/L 草酸处理明显抑制哈密瓜果皮PLD 和LOX 活性升高,可能与草酸处理提高哈密瓜果皮细胞膜的Ca2+浓度有关。细胞质中相对较低的Ca2+浓度,减少与膜结合的PLD 和LOX 的量,从而降低果实细胞膜渗透率,促进果皮MDA 含量降低,减少细胞膜发生氧化反应,较好地维护细胞膜结构的完整性。同时有效抑制果皮中棕榈酸(C16:0)和硬脂酸(C18:0)相对含量上升及油酸(C18:1)相对含量下降,提高 亚油 酸(C18:2)、亚麻酸(C18:3)和二十碳四烯酸(C20:4)的相对含量,提高果皮膜脂脂肪酸的不饱和指数和不饱和度,保持较高细胞膜不饱和度和流动性,控制果实冷害和衰老症状的发展。
4 结论
本试验结果表明,草酸处理明显抑制哈密瓜果皮PLD 和LOX 活性及蛋白表达升高,减少细胞膜发生氧化反应,降低膜脂过氧化产物含量,较好地维护细胞膜结构的完整性。同时有效抑制果皮中棕榈酸(C16:0)和硬脂酸(C18:0)相对含量上升及油酸(C18:1)相对含量下降,提高 亚油 酸(C18:2)、亚麻酸(C18:3)和二十碳四烯酸(C20:4)的相对含量,提高果皮膜脂脂肪酸的不饱和指数和不饱和度,维持较高的膜脂脂肪酸不饱和程度和较大的膜流动性,从而增强哈密瓜果实的抗冷性。
