嵌合猫杯状病毒F9株感染性克隆的构建及病毒拯救
2019-09-04左智敏康洪涛吴红霞祖少坡刘永相倪宏波曲连东
左智敏,康洪涛,吴红霞,祖少坡,田 进,刘永相,倪宏波,曲连东*
(1.黑龙江八一农垦大学动物科技学院,黑龙江大庆163319;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150069)
猫杯状病毒病(Feline caliciviral disease,FCVD)又称猫传染性鼻结膜炎,是一种由猫杯状病毒(Feline calicivirus,FCV)感染引起的猫科动物口腔和上呼吸道感染的高发传染病。该病在临床上主要表现为鼻炎、结膜炎和口腔溃疡,有时可以导致支气管炎、肺炎及慢性口腔溃疡,个别会出现关节或肌肉疼痛[1-2],是严重危害宠物、经济动物和野生动物健康的重要疫病。
FCV F9株于上世纪50年代被分离[3],是FCV的原始疫苗株,也是大多数FCV活疫苗的亲本株,被普遍用于FCV疫苗方面的研究[4]。最近Afonso等[5]对欧洲多国的FCV流行病学调查结果显示,目前FCV F9株仍然能够诱导机体产生具有广谱中和效应的抗体[5],FCV F9株应当作为欧洲地区FCV疫苗接种的首选。本研究采用分段克隆的方法,将FCV F9株的全基因组分3段扩增并依次克隆至pOK-12载体中,经序列替换,获得嵌合FCV F9株的全基因组克隆,并拯救出病毒。本研究首次构建出嵌合FCV F9株的感染性克隆,以期为FCV新型疫苗的研发奠定基础,也为FCV致病机理和免疫机制的研究提供技术平台。
1 材料与方法
1.1 主要实验材料 FCV F9株、pOK-12载体、已构建出的嵌合FCV强毒株的感染性克隆质粒pOK-2280[6]和猫肾细胞(F81)由中国农业科学院哈尔滨兽医研究所自然疫源性人兽共患病团队保存并提供。病毒RNA/DNA提取试剂盒、质粒提取试剂盒以及胶回收试剂盒购自AXYGEN公司;限制性内切酶、CloneJET试剂盒、T4 DNA连接酶、反转录试剂盒、转染试剂LipofectamineTMMessengerMAXTMTransfection Reagent购自Thermo公司;DNA Marker、体外转录试剂盒 HiScribeTMT7以及 Phusion High-Fidelity DNA Polymerase试剂盒购自NEB公司;Ribom 7G Cap Analog试剂盒购自Promega公司。
1.2 引物的设计与合成 根据FCV F9株基因序列(AB643784.1)设计相关的引物(表1),并由吉林库美生物科技有限公司合成。
1.3 pOK-12载体的改造 将人工合成的含XhoⅠ-KpnⅠ-SacⅠ-SalⅠ-PstⅠ-NotⅠ的寡核苷酸 pOK-linker-F与pOK-linker-R等摩尔比混合,通过94℃变性10 min,55℃复性20 min,获得具有粘性末端的双链DNA。将双链DNA纯化后与经XhoⅠ和NotⅠ酶切的pOK-12质粒连接,获得的重组质粒经测序鉴定正确后命名为pOK-LK。

表1 引物序列Table 1 Primer sequences used in the study
1.4 嵌合FCV F9株全长基因组重组质粒的构建按照试剂盒的使用说明提取FCV F9的病毒基因组RNA,反转录为cDNA,并以该cDNA为模板进行下述PCR扩增。
以引物T7F9-F/F9-R1 PCR扩增F9-T7G1片段,经纯化后用CloneJET试剂盒连接到pJET1.2中,获得 pJET-F9-T7G1。SalⅠ和 SacⅠ酶切 pJET-F9-T7G1获得F9-T7G1片段并克隆到pOK-LK中,获得pOKF9-T7G1。
以引物F9-F2/F9-R2扩增F9G2片段,经纯化后连接到pJET1.2中,获得pJET-F9G2,SacⅠ和PstⅠ酶切pJET-F9G2,回收F9G2片段,插入到pOK-F9-T7G1中,获得pOK-F9-T7G1G2。
将文献[6]中引物 Hdr1-F、Hdr2-R、Hdr3-F、Hdr4-R等摩尔比混合,94℃变性10 min、55℃复性20 min,获得产物HDRZ。以引物F9-F3/F9-R3扩增F9G3片段。以F9G3和HDRZ为模板,通过引物F9-F3/Hdr4-R扩增F9G3-HDRZ片段,纯化后连接至pJET1.2中,获得pJET-F9G3-HDRZ。将其经PstⅠ和NotⅠ酶切后克隆到pOK-F9-T7G1G2中,获得pOK-F9-F,并对质粒经测序鉴定。
1.5 嵌合FCV全长基因组感染性克隆pOK-F9H的构建与鉴定 为将pOK-F9-F的1823位前段区域(1685~1940)替换为pOK-2280相应区域,进行了下列操作:分别以质粒pOK-F9-F和pOK-2280为模板,以引物Hid-F/1685-R和1685f/28sacR PCR扩增2280-F9A片段(1 115~1 684)和2280-F9B片段(1 685~1 940),并以Hid-F/28sacR为引物,对2280-F9A片段和2280-F9B片段进行融合PCR扩增,获得2280-F9的融合片段(1 115~1 940)。
将2280-F9片段中出现差异的5个氨基酸位点突变成FCV F9对应的氨基酸。以2280-F9为模板,引物2280-F9-F1/2280-F9-R1 PCR扩增产物A;以2280-F9为模板,以引物2280-F9-F4/2280-F9-R4 PCR扩增产物K;以产物A和K为模板,以引物2280-F9-F1/2280-F9-R4 PCR扩增产物B;以2280-F9为模板,引物2280-F9-F2/2280-F9-R3 PCR扩增产物C;以2280-F9为模板,以引物2280-F9-F3/1820r PCR扩增产物D;以产物C和D为模板,以引物2280-F9-F2/1820-R PCR扩增产物F;以产物B和F为模板,引物2280-F9-F1/1820-R PCR扩增产物H1;以2280-F9为模板,以引物1820F/F9-R1 PCR扩增产物H2;以产物H1和H2为模板,以引物2280-F9-F1/F9-R1 PCR扩增产物2280-F9H;2280-F9H片段的氨基酸序列与FCV F9完全相同。以HindⅢ和SacⅠ酶切2280-F9H替换pOK-F9-F相应序列,最终得到嵌合质粒 pOK-F9H。经 SalⅠ和 NotⅠ双酶切鉴定pOK-F9H质粒,并对质粒全长测序鉴定。
1.6 嵌合病毒rFCV F9的拯救 将重组质粒pOK-F9H以NotⅠ酶切线性化,体外转录、RNA加帽和回收后,根据文献[7]方法转染F81细胞中进行病毒拯救。将转染后制备的病毒液接种新的F81细胞,当细胞出现50%CPE时,收取上清液,命名为rFCV F9的P1代病毒。连续传代至P10代,根据试剂盒的使用说明提取rFCV F9 P10代病毒与亲本病毒的基因组,反转录为cDNA,以引物F9-F1/F9-R1扩增FCV F9-G1片段和rFCV F9-G1片段并对PCR产物测序鉴定。
1.7 嵌合rFCV F9的蚀斑和细胞病变(CPE)形成试验 将拯救病毒与亲本病毒分别按照MOI 0.01分别接种于密度为100%的六孔板中的F81细胞中。病毒吸附1 h后弃掉病毒液,无血清DMEM冲洗两遍,将2%的低熔点琼脂糖与2×DMEM混合后以3 mL/孔铺于六孔板,置于37℃培养36 h后,用4%甲醇固定细胞2 h,结晶紫染色15 min,观察两种病毒蚀斑的大小及形态。
同时,将拯救病毒与亲本病毒分别按照MOI 0.001感染处于对数生长期的24孔板中的F81细胞。经上述步骤处理后,置37℃培养36 h后在显微镜下观察两种病毒CPE的形成情况。
1.8 嵌合rFCV F9多步生长曲线的测定 将拯救病毒与亲本病毒按照MOI 0.001分别感染处于对数生长期的24孔板中的F81细胞,分别在感染后的12 h、24 h、36 h和48 h收获病毒,采用文献[6]中方法测定收获病毒的病毒滴度,每个时间点重复测定3次,绘制病毒的多步生长曲线。
2 结果与讨论
2.1 pOK-12载体的改造结果 将具有粘性末端的双链DNA纯化后与经 XhoⅠ和 NotⅠ酶切的pOK-12质粒连接,测序结果显示,获得了插入酶切位点的重组质粒pOK-LK。
2.2 FCV F9株全基因组的拼接 以FCV F9的cDNA为模板,经PCR扩增获得的F9-T7G1、F9G2、F9G3-HDRZ片段大小分别为2.8 kb、2.8 kb、2 kb(图1),依次插入到改造后的载体pOK-LK中,重组质粒命名为pOK-F9-F。测序结果显示,质粒pOK-F9-F的1823位碱基出现移码突变,其余基因序列与亲本病毒完全相同。
2.3 嵌合FCV全长基因组感染性克隆的构建 经测序pOK-F9-F第1823位基因出现移码突变,所以将pOK-F9-F的1823位前段替换为pOK-2280相应区域。分别以质粒pOK-F9-F和pOK-2280为模板,分别经PCR扩增出2280-F9A片段和2280-F9B片段并融合,获得2280-F9融合片段。将2280-F9片段中与FCV F9存在差异的5个氨基酸位点依次突变为FCV F9的氨基酸,获得2280-F9H片段。将2280-F9H片段通过HindⅢ和SacⅠ双酶切替换至质粒pOK-F9-F中的相应部分,获得嵌合无突变的FCV F9全基因组序列的质粒pOK-F9H。经SalⅠ和NotⅠ双酶切pOK-F9H(载体2.1 kb,插入片段8 kb),鉴定,结果与预期相符(图1),测序结果无突变。表明构建了嵌合FCV F9株全基因组序列的重组质粒。
本研究中构建的pOK-F9-F质粒第1823位基因增加了一个碱基T,产生移码突变。尽管尝试了多种方式重新构建,但该突变仍然存在。为构建出FCV F9感染性克隆,本研究将pOK-F9-F的1685~1940位基因序列替换为pOK-2280[6]的相应序列,并将前者基因组推导的氨基酸差异位点依次突变为F9株相应位置的同义密码子。替换后获得具有同义密码子的嵌合FCV F9全基因组的重组质粒pOK-F9H。
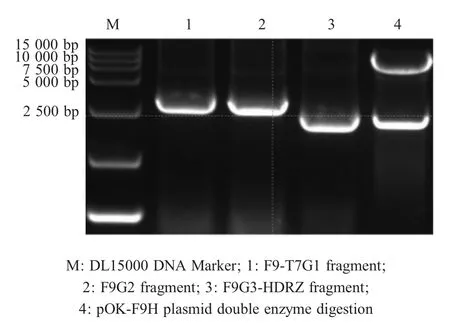
图1 目的片段的扩增及重组质粒pOK-F9H的双酶切鉴定Fig.1 Amplification of target genes and identification of recombinant plasmid pOK-F9H using double enzyme digestion
2.4 嵌合rFCV F9病毒的拯救 将体外转录制备的pOK-F9H的加帽RNA转染F81细胞,24 h后出现典型的CPE,未转染细胞无变化。将转染后制备的病毒液接种新的F81细胞,当细胞出现50%CPE时,收获上清液(P1代),将P1代病毒连续传至P10代后仍然有CPE产生,表明获得了可以稳定传代的病毒。
进一步对亲本病毒和获得的P10代拯救病毒分别进行PCR扩增,分别获得FCV F9-G1片段和rFCV F9-G1片段。测序结果显示该两个片断虽然碱基序列存在差异,但推导出的氨基酸序列相同。
2.5 嵌合rFCV F9的蚀斑和CPE形成试验结果接种F81细胞后,拯救病毒和亲本病毒均可以产生明显蚀斑,且形成的蚀斑大小和形态基本一致(图2);两株病毒感染F81细胞后产生的CPE基本一致(图2)。以上结果表明拯救病毒与亲本病毒具有相似的噬斑形成能力和相似的CPE形成能力。
2.6 嵌合rFCV F9的多步生长曲线测定 绘制的病毒多步生长曲线结果显示,rFCV F9和FCV F9的体外多步生长生长曲线基本一致(图3),表明rFCV F9与FCV F9具有相似的体外生长能力。推测,FCV的生物学特性可能仅由氨基酸序列决定,碱基序列不对病毒生物学特性产生影响;pOK-F9转化到细菌中后影响了细菌的增殖,推测FCV F9的碱基序列在细菌增殖时可能发挥某些未知的阻碍作用。
后续将会探究FCV基因组各蛋白的生物学特性,了解病毒蛋白在其生命活动周期中发挥的功能,为FCV基因的功能提供新的理解。
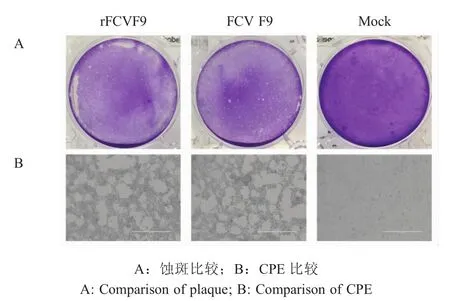
图2 拯救病毒和亲本病毒感染F81细胞后形成的蚀斑和CPEFig.2 Plaques and CPE compare F81 cells infected with virus after 36 h
图3 rFCV F9和亲本株FCV F9的多步生长曲线Fig.3 Multi-step growth curve of rFCV F9 and FCV F9
