GA3和ABA对小豆种子萌发和苗期生理参数的影响
2019-09-03任帅董伟欣张月辰
任帅 董伟欣 张月辰


摘要:为了探索促进小豆良好生长的适宜激素浓度,采用3个不同熟性的小豆品种,研究不同GA3和ABA浓度对种子萌发及苗期形态指标和生理参数的影响。结果表明:0.2 μmol/L GA3可以促进白红2号和冀红9218的萌发,0.1 μmol/L GA3可以促进唐山红小豆的萌发;3个品种对0.6 μmol/L ABA的敏感性最强,种子萌发受到明显抑制。0.6 μmol/L ABA处理对不同小豆品种的茎粗、茎节数和叶片数没有明显影响,但显著影响株高和叶面积;显著降低叶片的叶绿素和可溶性糖含量,增加可溶性蛋白和淀粉的含量。可见,适宜的激素浓度对小豆种子萌发以及苗期形态发育具有重要的调控作用。
关键词:小豆;GA3;ABA;种子萌发;幼苗形态指标;生理参数
中图分类号:S521.01文献标识号:A文章编号:1001-4942(2019)07-0103-05
小豆起源于中国[1],是我国传统的特色农作物。世界上已有30余个国家种植小豆[2],我国是主要种植国家之一[3]。小豆的经济价值较高,适口性较好,是深受人们喜爱的保健食品。但小豆落花落荚严重,加之生长后期自然灾害的影响,产量较低且不稳定,因此,研究植物激素对小豆种子萌发、花芽形成及生长发育的作用,对小豆良好生长及产量提高具有重要意义。
植物激素在调控种子萌发和植株生长发育方面的研究已有许多报道。不同浓度的激素可以促进或抑制种子的萌发,种子内抑制萌发物质浓度过高是种子休眠的主要原因之一[4],而适宜浓度的赤霉酸、生长素和细胞分裂素可以打破种子休眠[5,6],使种子提前萌发,并能影响种子的生理代谢。例如GA3和6-BA能够显著提高三岛柴胡(Bupleurum falcatum L.)种子的萌发率[7];GA3可以抑制草莓芽的休眠,促进萌发[8];外源GA3和6-BA处理对光滑高粱泡种子休眠未显示出显著性影响[9];鸢尾种子经0.01 g/L NAA或0.1 g/L GA3处理后发芽率和发芽势均极显著提高[10]。外源激素法已成为阐明种子休眠和萌发调控机理的重要手段之一,且其在调节幼苗生长[23]方面的应用也在多个物种中开展。有研究发现,CTK、IAA和GA能够刺激新稍生长,ABA和ETH抑制新稍生长[8];IAA和GA能够参与并调控果实前期发育[11],ABA能够启动葡萄的成熟[9,10]。GA、CTK、ABA、IAA对花芽的形成也起到重要作用。Dickens发现在体外成花诱导系统中,CTK可增加或诱导花芽的形成;在大豆、烟草、马铃薯、柑桔以及竹子等离体培养诱导花芽形成时,也都发现了CTK的存在[11]。可见,植物生长发育的任何一个阶段,都是由多种激素相互作用共同诱导同一个生理反应。
但目前植物激素在小豆种子萌发和生长发育调控中的应用尚缺乏系统研究,因此,本研究采用不同熟性的小豆品种作为研究材料,采用不同浓度GA3和ABA处理来研究其对小豆种子萌发以及苗期形态和生理指标的影响,以期为植物激素在促进小豆良好生长和提高产量方面的应用提供参考。
1 材料与方法
1.1 种子萌发试验
以早熟白红二号、中熟冀红9218、晚熟唐山红小豆为试验材料,在河北农业大学作物生长调控重点实验室进行。设三种处理:①GA3处理,用100 mL浓度分别为0.1、0.2、0.3 μmol/L GA3溶液浸泡不同品种的小豆种子10 h;②ABA处理,用100 mL浓度分别为0.3、0.6、0.9 μmol/L ABA溶液浸泡不同品种的小豆种子10 h;③对照,用100 mL自来水浸泡种子。每个培养皿放60粒种子,每个处理3个重复。用脱脂棉铺平培养皿底部,在其上面铺两层滤纸。将浸泡好的小豆种子放在铺好的滤纸上,分别再加入35 mL相应的浸泡溶液,立即放入智能培养箱中培养,培养条件为光照14 h、黑暗10 h,温度(25±2)℃,光照度为3 500 lx,培养3 d后统计发芽率和发芽指数。
1.2 ABA对小豆幼苗生理指标影响试验
将充实、饱满的中熟品种冀红9218和晚熟品种唐山红小豆种子播于装满蛭石和珍珠岩的塑料盆(高19 cm,直径10 cm,底部有透水孔),每个品种分成两组,一组作为对照,一组每天喷洒两次0.6 μmol/L的ABA溶液。在温室(光照14 h、黑暗10 h,温度35℃,光照度为7 500 lx)中培养8 d后,每个品种挑选长势良好、均匀的植株18株,测量株高、茎粗、茎节数、叶片数和叶面积,并采集叶片测定叶绿素、可溶性糖、淀粉和蛋白质的含量。
1.3 各项指标的测定和计算方法
(1) 发芽率(%)=测试种子发芽数/测试种子总数×100。
GI=∑Gt/Dt,其中,GI为发芽指数,Gt为每天发芽数,Dt为与Gt相对应的天数。
(2) 叶绿素含量参照邹琦[12]的方法测定;可溶性蛋白含量参照Read等[13]的方法测定;可溶性糖和淀粉含量采用白宝璋等[14]的方法测定。
1.4 数据分析
所有数据采用Microsoft Excel 2013整理,使用SPSS 17.0和SAS 9.4软件在α=0.05水平上進行方差分析及多重比较。
2 结果与分析
2.1 不同浓度GA3处理对小豆种子萌发的影响
适宜浓度的GA3可以促进小豆种子的萌发(表1)。白红2号和冀红9218均在0.2 μmol/L时发芽数、发芽率和发芽指数最高,白红2号分别高于对照2.98%、3.02%和7.26%,冀红9218分别高于对照3.04%、2.95%和5.81%;其次为0.1 μmol/L GA3处理,与对照相当;但在0.3 μmol/L GA3处理时,两品种的种子萌发均受到抑制。唐山红小豆则是在0.1 μmol/L GA3处理时发芽数、发芽率和发芽指数最高,分别比对照增加2.97%、2.93%和5.91%,0.2、0.3 μmol/L GA3处理的种子萌发均受到抑制。说明低浓度GA3可以促进小豆种子的萌发,而高浓度GA3抑制其萌发;不同小豆品种对GA3浓度的适应性存在差异。
2.2 不同浓度ABA处理对小豆种子萌发的影响
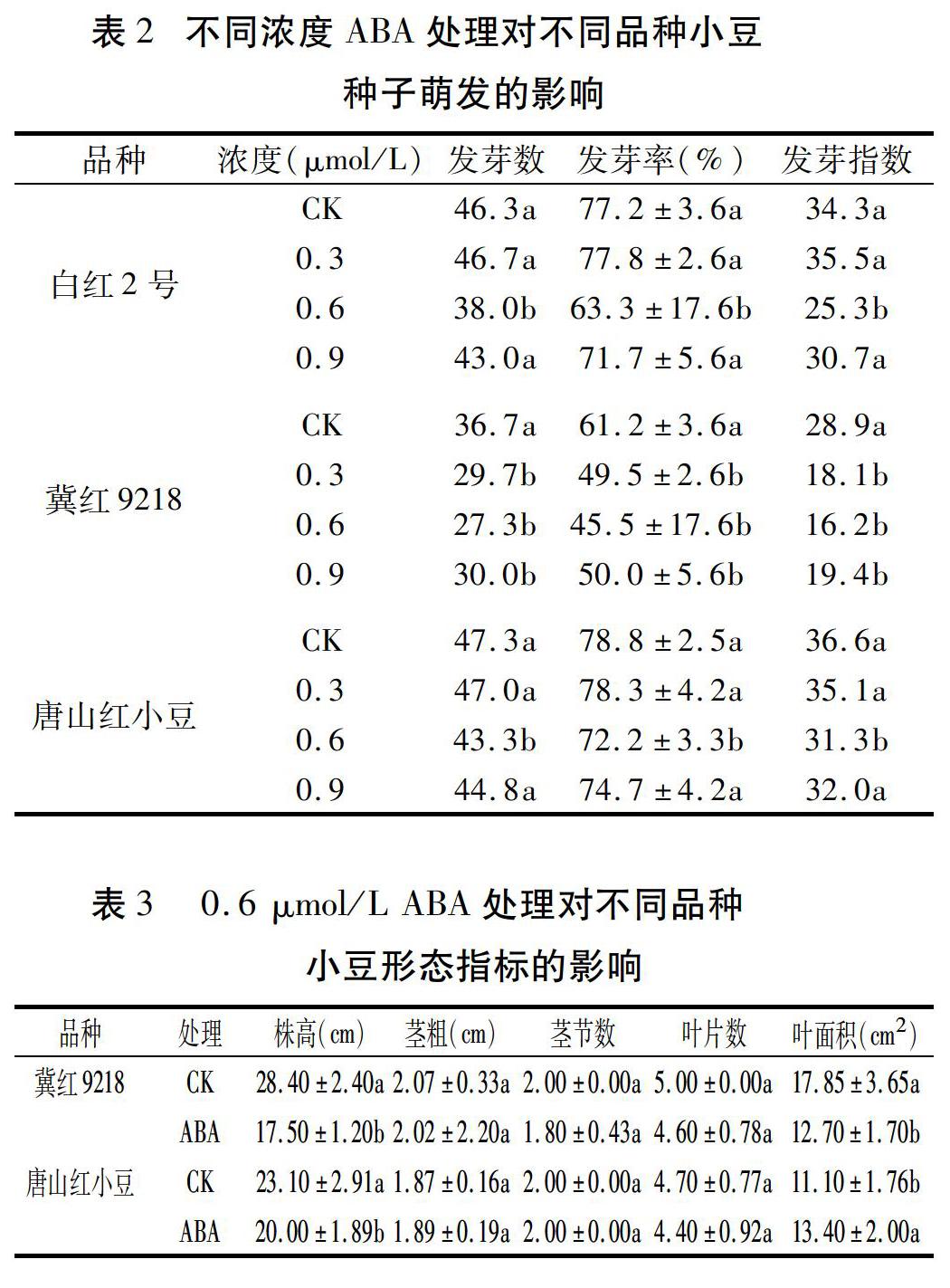
除0.3 μmol/L ABA对白红2号的种子萌发有轻微促进作用外,其余ABA处理均抑制了各品种小豆种子的萌发,且均以0.6 μmol/L ABA的抑制作用最明顯,白红2号、冀红9218、唐山红小豆的发芽率分别比对照降低18.01%、25.65%、8.38%(表2)。
2.3 ABA处理对小豆苗期形态指标的影响
由表3可见,经0.6 μmol/L ABA处理,两个小豆品种的茎粗、茎节数和叶片数与对照差异不显著,而株高显著降低,分别降低38.38%和13.42%;两品种叶面积对0.6 μmol/L ABA处理的响应不同,冀红9218的叶面积与对照相比显著降低,而唐山红小豆却显著增加。说明0.6 μmol/L ABA处理会抑制小豆植株的生长,但不同品种不同部位的表现有所差异。
2.4 0.6 μmol/L ABA处理对小豆苗期生理指标的影响
以冀红9218幼苗为试材,分析0.6 μmol/L ABA处理对其叶片叶绿素含量、可溶性蛋白、可溶性糖和淀粉含量的影响,结果(图1)显示,ABA处理降低了小豆叶片叶绿素a(Chla)、b(Chlb)的含量,其中Chlb的降低幅度达到显著水平;但显著增加了类胡萝卜素(Cxc)的含量。ABA处理显著提高了小豆叶片中可溶性蛋白和淀粉的含量,而显著降低了可溶性糖的含量,说明0.6 μmol/L ABA处理有利于苗期小豆叶片可溶性蛋白和淀粉的积累。
3 讨论与结论
研究表明赤霉素对种子萌发有促进作用[14-16],曾双等[17]研究发现,50 mg/L GA3对西葫芦种子的发芽势和发芽率都达到了显著的促进作用;刘栋等[18]研究表明,250 mg/L GA3可明显提高野生亚麻种子的发芽势和发芽率,而不同浓度IBA和6-BA均会抑制胡麻种子的萌发。本研究发现,0.2 μmol/L GA3可以促进白红2号和冀红9218的萌发,而0.1 μmol/L GA3可以促进唐山红小豆的萌发,太高则会抑制种子的萌发;0.6 μmol/L ABA对三个品种小豆种子萌发的抑制作用最强。来自叶片的光合同化物,必先经种皮卸出到质外体空间,再被子叶主动吸收,所以种皮的卸出和子叶的吸收是种子积累同化物的两个调控部位,ABA可能参与这两个调节过程。
适宜的植物激素浓度不仅可以调控种子萌发,也可以调控植物形态指标和生理参数的变化。如外源GA3能促进油茶抽梢、春梢伸长、新生叶片生长,但对油茶春梢直径和叶片厚度的影响不显著[19];CTK、IAA和GA能够促进葡萄植株和新梢的生长,同时,IAA和GA会促进果实生长,ABA会抑制植株生长,从而促进由营养生长向生殖生长转化,促进果实成熟,不同的激素浓度会有不同的促进或抑制效果[20];杨安中等[21]的试验发现,GA3能减缓水稻生育后期剑叶叶绿素和蛋白质的分解,提高其含量;对蚕豆叶片喷施氯吡苯脲可以延缓叶绿素a和b的分解,从而增加叶绿素的含量[22]。另外,喷施植物生长调节剂可以使烤烟的净光合速率提高3.36%,叶绿素含量增加14.04%,进而促进碳水化合物的合成,提高糖碱比,改善上部叶烤后感官质量[23]。本研究表明,0.6 μmol/L ABA处理对小豆植株茎粗、茎节数和叶片数的影响不大,但会显著抑制株高,降低叶片叶绿素和可溶性糖含量,提高可溶性蛋白和淀粉的含量。
本试验仅初步分析了不同浓度GA3和ABA对小豆种子萌发和幼苗生长的影响,今后将进一步探究其他激素对小豆生长发育的影响。
参 考 文 献:
[1]Вавилова Н N. 主要栽培植物的世界起源中心[M]. 董玉深译. 北京: 北京农业出版社, 1982.
[2] 金文林, 濮绍京. 中国小豆研究进展[J]. 世界农业, 2008(3): 59-62.
[3] 尹淑丽, 张月辰, 陶佩君, 等. 苗期日照长度对红小豆生育特性和产量的影响[J]. 中国农业科学, 2008, 41(8): 2286-2293.
[4] Kermode A R.Role of abscisic acid in seed dormancy[J].Journal of Plant Growth Regulation, 2005, 24(8): 319-344.
[5] Debeaujon I, Koornneef M. Gibberellin requirement for Arabidopsis seed germination is determined both by test acharacteristics and embryonic abscisic acid[J]. Plant Physiology, 2000, 122(7): 415-424.
[6] 汤贺, 宁伟, 卢晓磊, 等. 低温层积过程中激素处理对北五味子种子贮藏物质的影响[J]. 河南农业科学, 2008, 6(3): 92-94.
[7] 赵胜利, 索建政, 陈力众. 植物激素对三岛柴胡种子萌发的影响[J]. 中国中药杂志, 1992, 17(12): 715-717.
[8] 葛会波, 李青云, 陈贵林, 等. 草莓休眠过程中内源激素含量的变化[J]. 园艺学报, 1998, 25(1): 89-90.
[9] 刘欢, 熊莉军, 沈世峰, 等. 外源植物激素、冷湿层积和变温处理对悬钩子属光滑高粱泡种子休眠与萌发的影响[J]. 种子, 2018, 37(11): 30-34.
[10]张洁, 孙亚莉, 李梦露. 4种植物激素对鸢尾种子萌发的影响[J]. 山西农业科学, 2018, 46(6): 912-914.
[11]Dickens C. The induction and evocation of flowering in vitro [J]. South African Journal of Botany, 1988, 54(4): 325-344.
[12]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000: 72-75.
[13]Read S M, Northcote D H. Minimization of variation in the response to different protein of the coomassic blue G dye-binding assay for protein [J]. Analytical Biochemistry, 1981, 116(1): 53-64.
[14]白宝璋, 靳占忠, 李存东. 植物生理学试验教程[M]. 北京: 中国农业科技出版社, 1996: 61-62.
[15]赵欢蕊, 李鲜花, 刘娟, 等. 不同外源激素对黄秋葵种子萌发的影响[J]. 农学学报, 2018, 8(6): 43-46.
[16]贺志文, 李灵芝, 陶虹蓉, 等. 几种外源激素对番茄种子萌发及幼苗生长的影响[J]. 山西农业科学, 2017, 45(4): 534-537.
[17]曾双, 何兴佳, 张佳欣, 等. 外源激素浸种对西葫芦种子萌发及幼苗生长的影响[J]. 现代农业研究, 2018(11): 40-44.
[18]劉栋, 马建富, 郭娜, 等. 不同激素处理对野生亚麻种子萌发特性的影响[J]. 安徽农业科学, 2018, 46(35): 26-27.
[19]姜颖, 赵越, 孙全军, 等. 植物生长调节剂在植物生长发育中的应用[J]. 黑龙江科学, 2018, 9(24): 4-7.
[20]马海燕. 葡萄生长过程中内源激素含量变化的研究[D]. 杨凌: 西北农林科技大学, 2007.
[21]杨安中, 黄义德. 旱作水稻喷施6-苄基腺嘌呤的防早衰及增产效应[J]. 南京农业大学学报, 2001,24(2): 12-15.
[22]郭春霞, 徐皓. 氯吡苯脲对蚕豆离体叶片衰老的影响[J]. 现代农业科技, 2016, 9(5): 158-159.
[23]赵环宇, 孙光伟, 王玉军, 等. 植物生长调节剂对烤烟上部叶质量的影响[J/OL]. 中国烟草科学,http://kns.cnki.net/kcms/detail/37.1277.S.20190222.1011.002.html.
