沉默ATAD2增加乳腺癌细胞放疗敏感性
2019-09-03任潇毅宋宁宁陈建中张东铭郑英斌
任潇毅 宋宁宁 陈建中 张东铭 郑英斌
(郑州大学第二附属医院 1乳腺外科,河南 郑州 450000;2内分泌科;3普外科)
乳腺癌是常见于女性的实体肿瘤,其中手术治疗和放射治疗是局部控制乳腺癌的主要途径,放射治疗是乳房功能保守性手术后治疗的关键,提高乳腺癌细胞放射敏感性也成为广大医学工作者探讨的重点〔1〕。随着人们对乳腺癌发病机制的不断研究,靶向基因提高肿瘤细胞放射敏感性对于肿瘤的治疗具有重要意义〔2〕。三磷酸腺苷酶家族蛋白(ATAD)2是一种原癌基因,其在恶性肿瘤或低分化组织中高表达,在分化成熟的组织中表达水平极低,ATAD2可以调控多种分子的转录和表达,是核内激素受体的激活分子,其异常表达于多种肿瘤组织中,并且与肿瘤细胞的生长凋亡有关〔3,4〕。研究表明,ATAD2在乳腺癌组织中阳性表达率高于癌旁组织,ATAD2在乳腺癌的发生发展中具有重要意义〔5〕。本实验探讨沉默ATAD2对乳腺癌细胞增殖凋亡及放射敏感性的影响,为延长乳腺癌患者的生存期提供参考依据。
1 材料与方法
1.1材料 乳腺癌细胞MDA-MB-231购自北京伯乐生命科学发展有限公司;Realtime PCR试剂购自美国Thermo Fisher Scientific;阴性对照慢病毒和ATAD2 shRNA慢病毒购自南京科佰生物科技有限公司;兔抗激活型含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase)-3抗体、兔抗p21抗体购自北京百奥莱博科技有限公司;膜联蛋白(Annexin)V-FITC/碘化丙啶(PI)凋亡检测试剂盒购自杭州联科生物技术股份有限公司;PI单染细胞周期检测试剂盒购自上海江莱生物科技有限公司;兔抗细胞周期依赖性蛋白激酶(CDK)4抗体、ATAD2抗体购自美国Novus Biologicals。
1.2细胞转染 乳腺癌细胞生长密度为40%~50%以后,将慢病毒液添加至细胞中,感染复数为20,培养12 h以后换液,继续培养3 d以后,用0.5 μg/ml的嘌呤霉素筛选2 w。设置转染阴性对照慢病毒的乳腺癌细胞为Lv-NC组,设置转染ATAD2 shRNA慢病毒的乳腺癌细胞为Lv-ATAD2 shRNA组。
1.3沉默效果检测 Realtime PCR:取Lv-NC组、Lv-ATAD2 shRNA组细胞,用预冷的磷酸盐缓冲液(PBS)将细胞洗涤2次以后,依次添加1 ml的TRIZOL裂解液,提取细胞中总RNA。配制10 μl的逆转录体系,体系中包括:0.5 μl随机引物、2 μl 5×Primescript TM缓冲液、5.5 μl不含核糖核酸酶的水、0.5 μl Primescript TM RT Enyme mix、0.5 μl Oligo dT Primer、1 μl RNA,cDNA反应条件为:37℃,15 min;85℃,5 s。Realtime PCR体系为:3 μl灭菌蒸馏水、5 μl SYBR premix Ex Taq、0.5 μl上下游引物、1 μl cDNA。Realtime PCR条件为:95℃,10 s;95℃ 5 s;57℃20 s;95℃ 10 s,共40个循环。根据每个反应的Ct值计算ATAD2 mRNA的水平,设置甘油醛-3-磷酸脱氢酶(GAPDH)作为参照。ATAD2上游引物:5′-GGAATCCCAAACCACTGGACA-3′,下游引物5′-GGTAGCGTCGTCGTAAAGCACA-3′。GAPDH上游引物:5′-ATAGCACAGCCTGGATAGCAACGTAC-3′,下游引物5′-CACCTTCTACAATGAGCTGCGTGTG-3′。Western印迹法:取Lv-NC组、Lv-ATAD2 shRNA组细胞,用RIPA裂解液提取细胞中的总蛋白。依照二喹啉甲酸(BCA)法对蛋白进行定量检测以后,把蛋白样品与5×上样缓冲溶液混合后,煮沸5 min。配制5%的浓缩胶和10%的分离胶,依照每孔中添加50 μg蛋白样品计算,把蛋白样品分别添加至上样孔中,进行电泳。电压设置为80 V,电泳时间2 h后,观察溴酚蓝进入到凝胶的底部方可终止电泳。取出凝胶,以自来水冲洗以后,进行转膜,转膜电流为80 mA,转膜时间为60 min。转膜后的硝酸纤维素(NC)膜置于含有5%牛血清白蛋白反应液中结合反应2 h以后,再将NC膜放在一抗、二抗反应液中反应2 h,一抗用封闭液按照1∶1 000稀释,二抗用封闭液按照1∶4 000稀释。用电化学发光(ECL)试剂显色。分析每组ATAD2和内参GAPDH条带的灰度值,并以ATAD2灰度值与GAPDH灰度值的比值表示ATAD2蛋白水平。
1.4细胞分组和照射方法 Lv-NC、Lv-ATAD2 shRNA细胞分别用8 Gy剂量照射处理,记为Lv-NC+放射组、ATAD2 shRNA+放射组。照射方法为:美国VarianClinac ix直线加速器,剂量率为300 cGy/min,100 cm源皮距、20 cm×20 cm的照射野,6MV X射线。
1.5噻唑蓝(MTT)法检测细胞增殖 乳腺癌细胞接种在96孔细胞培养板中,按照Lv-NC、Lv-ATAD2 shRNA、Lv-NC+放射、ATAD2 shRNA+放射细胞分组方法处理以后,继续培养24 h,在每个孔中添加20 μl的MTT溶液,继续孵育4 h以后,将孔内的液体吸弃,继续添加二甲基亚砜(DMSO)溶液150 μl,放在摇床上反应10 min,测定490 nm每孔的吸光度值。
1.6PI单染法检测细胞周期 Lv-NC、Lv-ATAD2 shRNA、Lv-NC+放射、ATAD2 shRNA+放射细胞按照上述方法处理以后,继续培养24 h,在细胞中添加PBS将细胞洗涤以后,用0.25%的胰蛋白酶消化,将细胞配制成单细胞悬浮液。添加75%的乙醇溶液混合后,放置于4℃孵育过夜。在细胞中添加RNase A水,放在37℃孵育30 min,继续添加PI染液400 μl染色30 min。流式细胞仪检测细胞周期变化。
1.7Annexin V-FITC/PI双染法检测细胞凋亡 Lv-NC、Lv-ATAD2 shRNA、Lv-NC+放射、ATAD2 shRNA+放射细胞按照上述方法处理以后,继续培养24 h,收集各组细胞,用PBS悬浮以后,再分别添加5 μl的Annexin V-FITC和PI染液反应10 min,上流式细胞仪检测凋亡变化。
1.8Western印迹检测细胞中Cleaved Caspase-3、CDK4、p21蛋白表达水平 Lv-NC、Lv-ATAD2 shRNA、Lv-NC+放射、ATAD2 shRNA+放射细胞按照上述方法处理以后,继续培养24 h,收集各组细胞,用Western印迹方法检测细胞中Cleaved Caspase-3、CDK4、p21蛋白表达水平,步骤同上。
1.9克隆形成实验检测放射敏感性 Lv-NC、Lv-ATAD2 shRNA分别经过剂量为0、2、4、6、8 Gy的X射线照射处理以后,接种到6 cm的培养皿中,每个培养皿中添加300个细胞,同时在培养皿内添加4 ml细胞培养液。放在37℃孵育培养2 w以后,肉眼可观察到培养皿中有细胞克隆出现。把上清吸弃掉,添加PBS洗3次,继续添加5 ml的甲醇溶液固定15 min,用结晶紫染色20 min后,放在流水中将染液洗掉,置于室温条件中干燥。计数克隆数目,用GraphadPad拟合细胞存活曲线,根据单击多靶模型计算出放射敏感性的参数值:平均致死剂量(D0)、准阈剂量(Dq)、外推数(N)、2 Gy照射剂量细胞存活系数(SF2)、参数值(k),计算放射增敏比。
1.10统计学分析 采用SPSS21.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1ATAD2 shRNA转染后乳腺癌细胞中ATAD2蛋白表达水平 乳腺癌细胞中转染ATAD2 shRNA慢病毒后,细胞中ATAD2 mRNA和蛋白水平均显著降低(P<0.05)。见图1、表1。
2.2沉默ATAD2协同放疗抑制乳腺癌细胞增殖 沉默ATAD2后的乳腺癌细胞存活率显著降低(P<0.05),放射治疗后的乳腺癌细胞的存活率也显著降低(P<0.05),并且沉默ATAD2和放射治疗具有协同抑制乳腺癌细胞生长的作用。见表2。

图1 Western印迹测定ATAD2 shRNA慢病毒对乳腺癌细胞中ATAD2蛋白表达影响

组别ATAD2 mRNAATAD2蛋白Lv-NC组1.00±0.000.84±0.09Lv-ATAD2 shRNA组0.35±0.061)0.38±0.051)
与Lv-NC组比较:1)P<0.05
2.3沉默ATAD2协同放射治疗将乳腺癌细胞周期阻滞在G0/G1期并诱导细胞凋亡 从表2和图2中可以看出,沉默ATAD2后的乳腺癌细胞G0/G1期比例升高,放射治疗后的乳腺癌细胞G0/G1期比例也升高,并且沉默ATAD2和放射治疗具有协同抑制乳腺癌细胞周期的作用;沉默ATAD2和放射治疗均可以诱导乳腺癌细胞凋亡,并且二者具有协同作用。
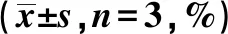
表2 下调ATAD2后乳腺癌细胞周期分布、细胞存活率及凋亡率变化
与Lv-NC组比较:1)P<0.05;与ATAD2 shRNA+放射组比较:2)P<0.05;表3、4同

图2 流式细胞术检测下调ATAD2对乳腺癌细胞凋亡影响
2.4沉默ATAD2协同放射治疗促进乳腺癌细胞中Caspase蛋白活化和p21蛋白表达,同时下调细胞中CDK4蛋白表达水平 从表3和图3中可以看出,沉默ATAD2后的乳腺癌细胞中Cleaved Caspase-3、p21蛋白水平显著升高,CDK4蛋白水平显著降低,放射治疗后的乳腺癌细胞中Cleaved Caspase-3、p21蛋白水平也显著升高,CDK4蛋白水平也显著降低,并且沉默ATAD2和放射治疗具有协同作用。
2.5沉默ATAD2提高乳腺癌细胞放射敏感性 与Lv-NC组比较,Lv-ATAD2 shRNA组、2、4、6、8 Gy细胞存活分数显著下降(P<0.05)。沉默ATAD2后的乳腺癌细胞放射增敏比为1.396。见表4、表5。
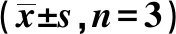
表3 下调ATAD2后乳腺癌细胞中Cleaved Caspase-3、CDK4、p21蛋白表达水平变化
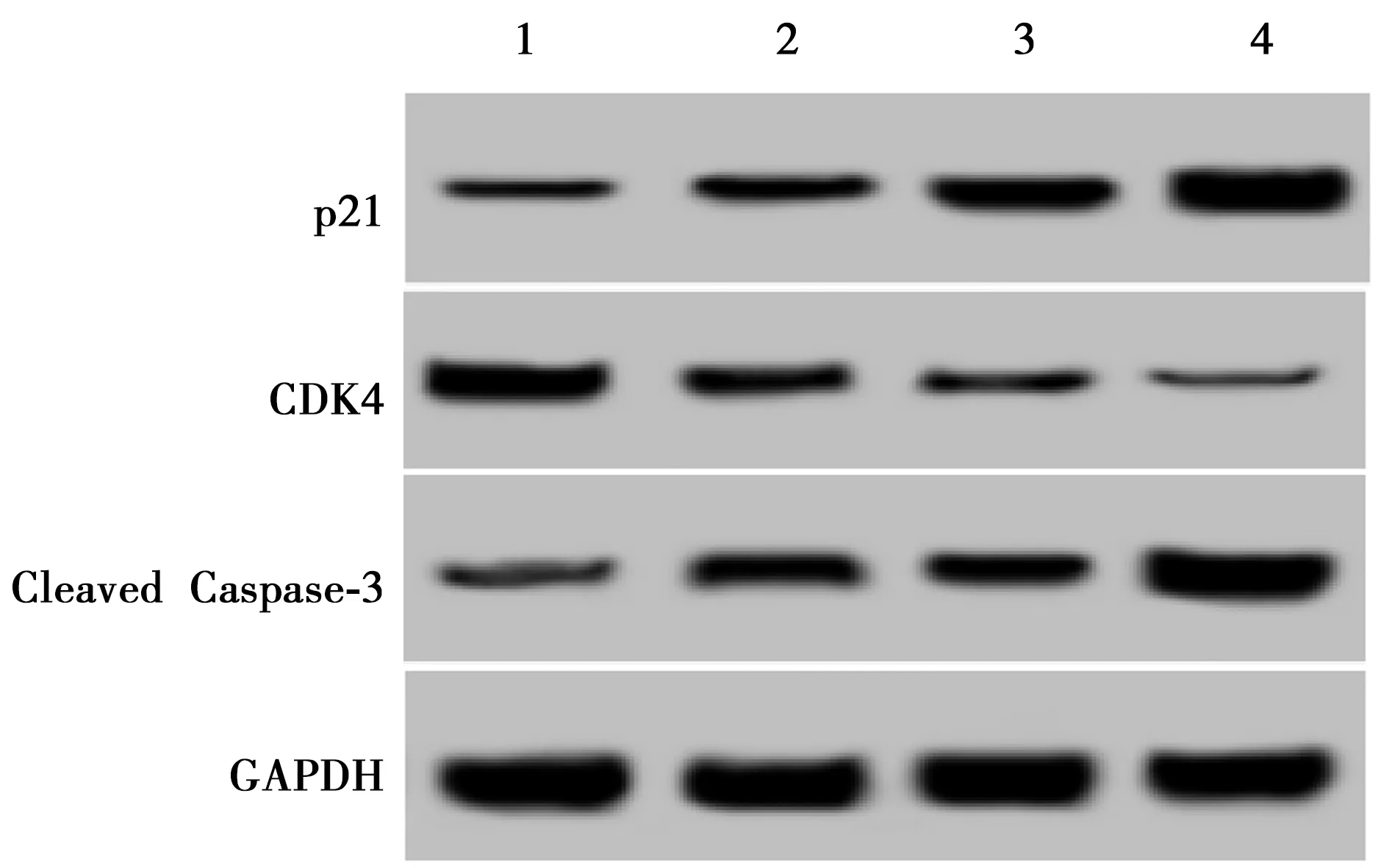
1~4:Lv-NC组、Lv-ATAD2 shRNA组、Lv-NC+放射组、ATAD2 shRNA+放射组图3 Western印迹检测下调ATAD2对乳腺癌细胞中Cleaved Caspase-3、CDK4及p21蛋白表达影响
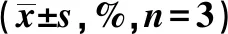
表4 不同放射剂量两组细胞存活分数

表5 单击多靶模型参数值
3 讨 论
ATAD2基因定位于8q24.13染色体上,其编码的蛋白质又称为PRO2000或ANCCA,ATAD2蛋白中含有可以调控细胞活性的ATP酶结构域、溴结构域,ATAD2蛋白的氨基端还含有雄激素受体、雌激素受体等协同因子,能够共同调控下游靶基因的转录和表达〔6~8〕。ATAD2在乳腺癌、宫颈癌、肝癌、淋巴瘤等肿瘤组织中高表达,其在肿瘤中发挥癌基因的作用,ATAD2可以通过调控多种癌症相关基因、肿瘤细胞表观遗传等影响肿瘤细胞的生长、凋亡〔5,6,9,10〕。ATAD2敲减可以诱导宫颈癌细胞凋亡,抑制宫颈癌细胞生长,后续在多种肿瘤细胞中证实敲减ATAD2具有抗肿瘤作用〔6,9〕。本研究表明,沉默ATAD2后的乳腺癌细胞的增殖能力降低,细胞凋亡率升高,沉默ATAD2在乳腺癌细胞中发挥抑制作用。
研究证实,沉默ATAD2发挥抗肿瘤细胞生长机制与阻碍细胞周期进展的和抑制Caspase凋亡反应有关;在结肠癌、宫颈癌细胞中的研究表明,沉默ATAD2可以将细胞周期阻滞在G0/G1期,也有研究表明,沉默ATAD2对肿瘤细胞周期没有明显作用;在肝癌等肿瘤细胞中的研究显示,沉默ATAD2可以激活细胞中Caspase-3,诱导细胞凋亡发生〔6,11~13〕。Caspase-3是Caspase蛋白家族的成员之一,其在Caspase凋亡反应中发挥执行者的作用,Caspase-3只有被活化后才可以诱导细胞凋亡的发生〔14〕。CDK4是一种细胞周期促进因子,其可以诱导细胞从G0/G1期向S期进展,p21是一种细胞周期抑制因子,其表达水平升高后可以抑制细胞周期进展〔15〕。本研究显示,沉默ATAD2后的乳腺癌细胞中Caspase-3活化水平升高,细胞中p21蛋白水平升高,CDK4蛋白水平下降,细胞周期被阻滞在G0/G1期,沉默ATAD2可以通过激活Caspase凋亡反应和通过调控细胞周期因子的表达发挥抗乳腺癌的作用。
流行病学资料显示,乳腺癌的发生率呈不断上升趋势,随着人们对乳腺癌生物学行为的不断研究发现,扩大手术切除范围并不能达到较好的治疗效果,保乳手术也成为乳腺癌治疗的首选,放射治疗是目前除了手术治疗之外的最常见的肿瘤治疗手段,在多种肿瘤的治疗中广泛应用,放射治疗也是手术切除后保乳治疗的首选途径〔16~18〕。研究显示,肿瘤细胞对于放射治疗的敏感性差是导致放疗失败的重要原因,寻找有效的途径提高肿瘤细胞的放射敏感性已经成为目前肿瘤治疗的关键〔19〕。本研究结果表明,沉默ATAD2在诱导乳腺癌细胞凋亡和抑制乳腺癌细胞增殖的过程中还可以提高乳腺癌细胞放射敏感性,靶向ATAD2可能是提高乳腺癌细胞放射敏感性的有效途径之一。
总之,沉默ATAD2可能是提高乳腺癌放射敏感性的潜在途径,沉默ATAD2能够协同放射治疗诱导乳腺癌细胞凋亡并阻滞细胞周期,发挥抗肿瘤作用。目前对于ATAD2具体的调控机制尚不明确,对于沉默ATAD2在体内抗乳腺癌的作用尚不清楚,在以后的实验探讨中会对上述部分进行探索。
