PHLPP1对结直肠癌细胞生长抑制及细胞周期阻滞的作用
2019-09-03潘新平刘小敏田立
潘新平 刘小敏 田立
(定西市人民医院 1肿瘤内科,甘肃 定西 743000;2手术室)
恶性肿瘤受多个癌基因、抑癌基因的调控,明确这些基因在肿瘤发生中的作用是阐明肿瘤发病机制的关键。结直肠癌是常见的消化系统恶性肿瘤,具有早期临床症状不明显、恶性程度高、发展速度快等特点,研究结直肠癌发病机制具有重要意义〔1〕。PHLPP1在人体的组织和器官中广泛表达,是目前发现的一种抑癌基因,具有抑制细胞增殖并诱导细胞凋亡的作用,其在卵巢癌、乳腺癌、结直肠癌等肿瘤组织中低表达,在乳腺癌等肿瘤细胞中已经证实PHLPP1具有抑制肿瘤细胞生长作用,而在结直肠癌细胞生长中的作用尚不明确〔2~5〕。本实验首先检测PHLPP1在结直肠癌和正常结肠上皮细胞中的表达,通过细胞转染的方法构建上调PHLPP1的细胞株,探讨PHLPP1高表达对结直肠癌细胞增殖、细胞周期及凋亡的影响。
1 材料与方法
1.1材料 pcDNA3.1-PHLPP1由甘肃金域医学检验研究所构建保存;Lipofectmine2000转染试剂、RNA提取试剂盒购自美国Invitrogen公司;cDNA合成相关试剂购自立陶宛MBI Fermentas公司;荧光定量PCR试剂盒购自美国Thermo公司;ECL显色试剂盒购自生工生物工程上海(股份)有限公司;活化型Caspase-9抗体、细胞周期蛋白(Cyclin)D1抗体购自美国Abnova公司;活化型Caspase-3抗体、细胞周期依赖性蛋白激酶(Cdk)4抗体购自美国Santa Cruz公司;PHLPP1抗体购自美国Merck millipore公司。
1.2细胞株 结直肠癌细胞HT29、Lovo、SW480和人正常结肠上皮细胞FHC购自美国ATCC,细胞常规培养于含有10%胎牛血清的RPMI1640培养液中,培养温度为37℃,CO2浓度为5%,期间每隔2~3 d进行细胞传代,用0.25%的胰蛋白酶消化。
1.3荧光定量PCR测定PHLPP1在结直肠癌细胞中的表达 结直肠癌细胞HT29、Lovo、SW480和人正常结肠上皮细胞FHC按照RNA提取试剂盒提取细胞中的总RNA,RNA用适量的DEPC水溶解以后,保存于-80℃。逆转录合成cDNA,体系为:2 μg总RNA、2 μl随机引物、1 μl dNTP加水至12 μl,放在65℃孵育5 min后,置于冰上冷却。再添加4 μl 反应缓冲液、2 μl的DTT、1 μl的RNase,置于37℃孵育2 min后,置于冰上。加入M-MLV逆转录酶1 μl,混合后,25℃ 10 min,37℃ 50 min,70℃ 15 min,产物保存在-20℃。取cDNA,进行荧光定量PCR,每个反应设置3个孔,40次循环,内参为GAPDH,步骤同荧光定量PCR试剂盒,测定反应管荧光强度到达阈值时的Ct值,用2-△△Ct法计算待测基因PHLPP1的表达水平。
1.4Western印迹测定PHLPP1在结直肠癌细胞中的表达 结直肠癌细胞HT29、Lovo、SW480和人正常结肠上皮细胞FHC用含有PMSF的蛋白裂解液裂解以后,在4℃离心10 min,把上清吸取至离心管中,常规BCA法对蛋白进行定量。按照每个泳道中添加20 μg蛋白进行上样,蛋白凝胶用10%的分离胶,蛋白电泳用100 V恒压,观察染料进入底部边缘,终止电泳。准备大小合适的PVDF膜,浸泡至转膜缓冲液中10 min以后,常规方法将凝胶上的蛋白电转移到PVDF膜,转膜在4℃中进行,转膜电压为90 V。PVDF膜与待测蛋白抗体(PHLPP1抗体1∶200稀释)室温孵育1 h以后,再与辣根过氧化物酶标记的二抗(1∶3 000稀释)室温孵育2 h。滴加ECL显色液。分析PHLPP1蛋白和内参GAPDH的灰度值,以二者的比值表示PHLPP1蛋白水平。
1.5细胞转染 Lovo细胞按照每个孔加入105个细胞种植到6孔板,细胞密度为80%,进行细胞转染,转染前将细胞培养液更换成为不含血清的培养液,用Lipofectmine2000转染试剂进行转染,步骤同Lipofectmine2000转染试剂说明书,把pcDNA3.1-PHLPP1和pcDNA3.1转染至细胞中,转染后24 h,将细胞按照1∶3的比例进行传代以后,以500 μg/ml的G418筛选,筛选稳定转染的细胞株。稳定转染pcDNA3.1-PHLPP1和pcDNA3.1的细胞记为PHLPP1组和NC组,把没有转染的细胞作为Control组。用荧光定量PCR和Western印迹方法检测转染后细胞中PHLPP1表达变化,步骤同上。
1.6细胞增殖检测 以MTT法检测各组细胞增殖情况。取Control、NC、PHLPP1细胞,以0.25%的胰蛋白酶消化以后,用细胞培养液制成单细胞悬浮液,细胞密度为5×104个/ml,每个孔中加入100 μl的细胞悬液,将各组细胞接种到96孔板内,分别在培养1 d、2 d、3 d、4 d时各取出一个培养板,每孔添加20 μl的MTT,孵育4 h。弃上清,加150 μl的DMSO,用空白孔调零后,检测492 nm的A值。
1.7细胞周期检测 以PI单染法流式细胞术检测各组细胞周期变化。取Control、NC、PHLPP1细胞,以0.25%的胰蛋白酶消化以后,收集106个细胞,用冰预冷的PBS洗涤2次,1 200 r/min离心10 min后,将PBS彻底吸除,以75%的乙醇悬浮细胞后,加入5 μl的PI染液,于避光条件孵育结合20 min。用流式细胞仪检测细胞周期变化。同时收集各组细胞,用Western印迹方法检测细胞中周期蛋白CyclinD1、Cdk4的表达水平,步骤同上。
1.8细胞凋亡检测 以双染法流式细胞术检测各组细胞凋亡情况。取Control、NC、PHLPP1细胞,以0.25%的胰蛋白酶消化以后,每组细胞收集106个,添加1 ml的预冷的PBS,震荡混合后,1 000 r/min离心10 min。用200 μl的上样缓冲液将细胞悬浮以后,加入10 μl的Annexin V-FITC和PI,轻摇混合后,避光反应15 min。添加300 μl的上样缓冲液,以流式细胞仪检测细胞凋亡。同时收集各组细胞,用Western印迹方法检测细胞中凋亡蛋白活化型Caspase-3、活化型Caspase-9的表达水平,步骤同上。
1.9统计分析 采用SPSS21.0软件进行单因素方差分析及SNK-q检验。
2 结 果
2.1PHLPP1在结直肠癌细胞中的表达水平低于人正常结肠上皮细胞 结直肠癌细胞HT29、Lovo、SW480中PHLPP1 mRNA和蛋白水平均显著低于人正常结肠上皮细胞FHC(P<0.05)。PHLPP1在结直肠癌细胞中低表达。见图1和表1。
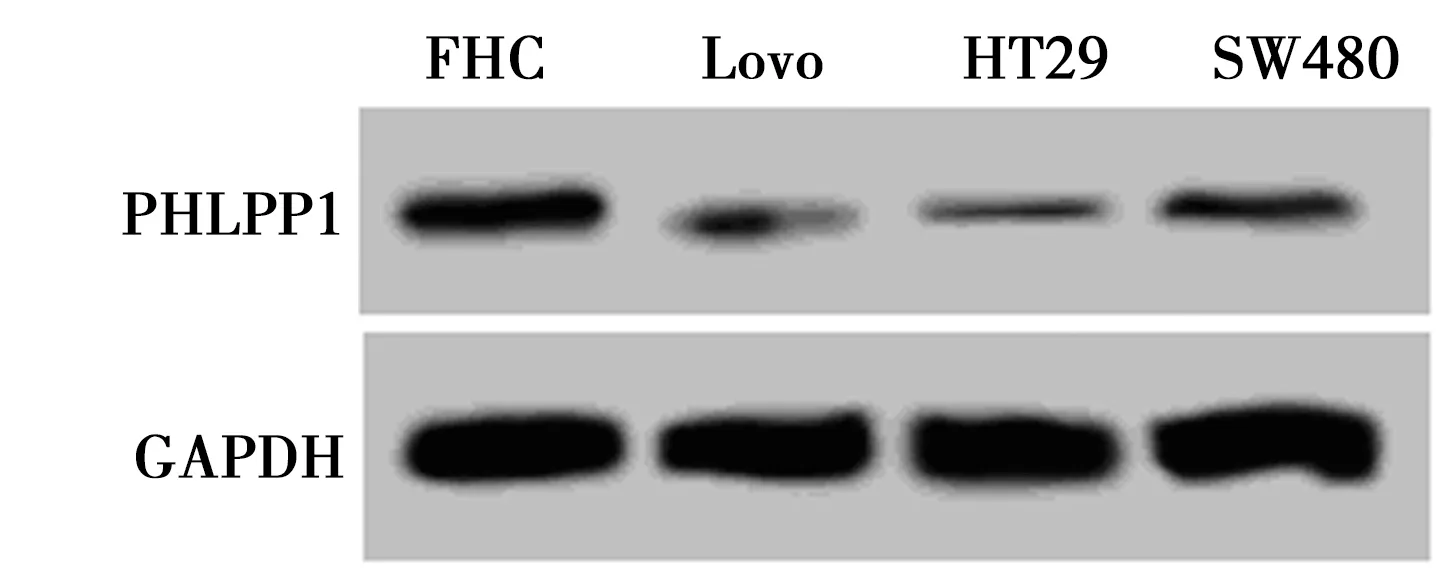
图1 Western印迹检测PHLPP1在各细胞中的表达

细胞PHLPP1 mRNAPHLPP1蛋白FHC1.00±0.000.78±0.09Lovo0.25±0.031)0.21±0.031)HT290.30±0.021)2)0.26±0.011)3)SW4800.48±0.061)2)3)0.32±0.031)2)3)
与FHC比较:1)P<0.05;与Lovo比较:2)P<0.05;与HT29比较:3)P<0.05
2.2pcDNA3.1-PHLPP1上调结直肠癌细胞中PHLPP1表达水平 稳定转染pcDNA3.1-PHLPP1的结直肠癌细胞中PHLPP1的表达水平高于未做转染和转染对照载体pcDNA3.1的细胞(P<0.05)。成功构建了高表达PHLPP1的结直肠癌细胞株,见图2和表2。
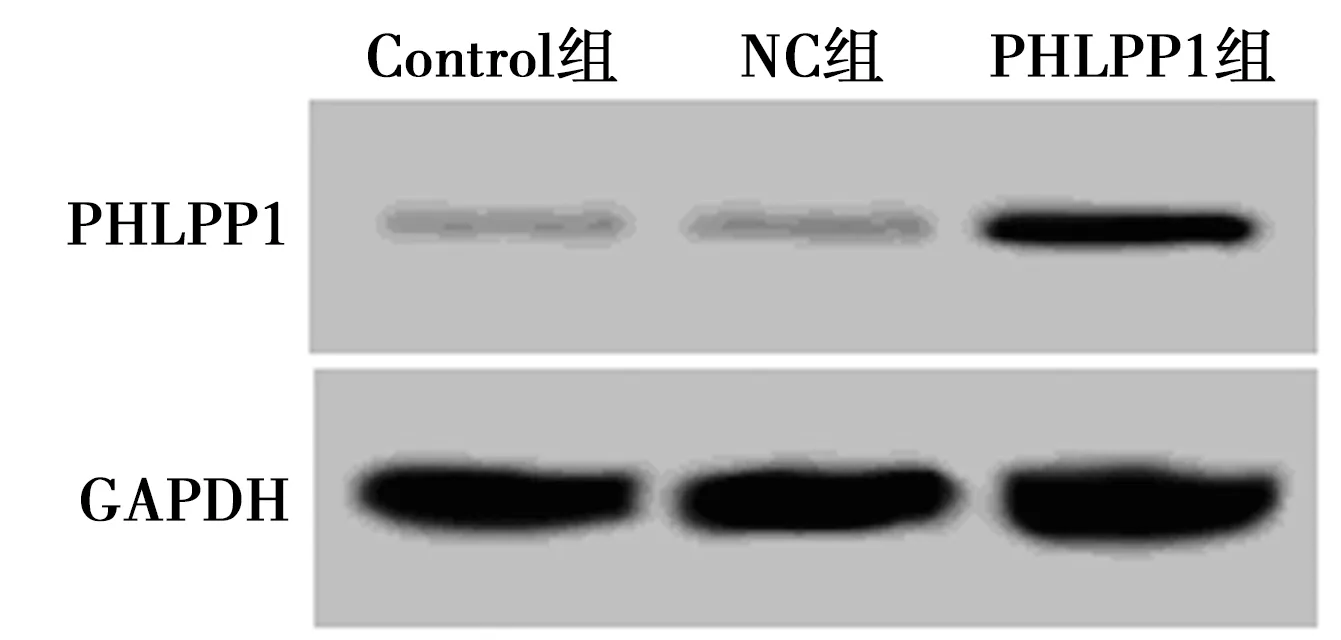
图2 Western印迹检测转染以后结直肠癌细胞中PHLPP1表达水平
2.3PHLPP1降低结直肠癌细胞的增殖活性 高表达PHLPP1的结直肠癌细胞在培养后1 d、2 d、3 d、4 d各时间点的增殖活性均明显低于未做转染和转染对照载体pcDNA3.1的细胞(P<0.05),表明PHLPP1抑制结直肠癌细胞的增殖活性,见表3。
表2 转染以后结直肠癌细胞中PHLPP1表达水平比较
与PHLPP1组比较:1)P<0.05;下表同
表3 各组结直肠癌细胞在培养后不同时间点A值比较
2.4PHLPP1阻滞结直肠癌细胞周期并下调CyclinD1、Cdk4蛋白表达水平 高表达PHLPP1的结直肠癌细胞G1期细胞比例均明显高于未做转染和转染对照载体pcDNA3.1的细胞(P<0.05)。同时高表达PHLPP1后的结直肠癌细胞中CyclinD1、Cdk4蛋白水平降低,表明PHLPP1阻滞结直肠癌细胞周期,并下调周期蛋白CyclinD1、Cdk4的表达,见图3和表4。

图3 Western印迹检测PHLPP1对结直肠癌细胞中周期蛋白CyclinD1、Cdk4表达影响
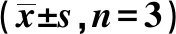
表4 各组结直肠癌细胞周期分布及CyclinD1、Cdk4表达水平比较
2.5PHLPP1诱导结直肠癌细胞凋亡并诱导细胞中活化型Caspase-3、活化型Caspase-9表达 高表达PHLPP1的结直肠癌细胞凋亡率均明显高于未做转染和转染对照载体pcDNA3.1的细胞(P<0.05),表明同时高表达PHLPP1后的结直肠癌细胞中活化型Caspase-3、活化型Caspase-9蛋白水平也升高。PHLPP1诱导结直肠癌细胞凋亡,并且可以诱导凋亡蛋白活化型Caspase-3、活化型Caspase-9的表达。见图4和表5。

图4 PHLPP1诱导结直肠癌细胞凋亡

组别凋亡率(%)活化型Caspase-3活化型Caspase-9Control组4.62±0.281)0.20±0.031)0.35±0.041)NC组4.86±0.421)0.21±0.051)0.34±0.031)PHLPP1组22.18±3.200.49±0.080.96±0.12
3 讨 论
PHLPP是一种丝氨酸/苏氨酸磷酸酶,这类磷酸酶具有阻碍细胞内生存信号转导的作用,在细胞生长中发挥负调控作用,其基因定位于18q21.33染色体上,其编码的蛋白质含有亮氨酸富集区、pleckstrin同源结构域、PDZ结构域、PP2C结构域,在调控细胞生长中具有重要作用〔6~9〕。研究显示,PHLPP1作为PHLPP的成员之一,在肿瘤组织中表达下调,在肿瘤发生中发挥抑制作用〔10〕。在结直肠癌中的研究发现,PHLPP1表达下调与肿瘤的分化程度、临床病理参数等具有相关性〔11〕。在乳腺癌、肺癌、食管癌等中的研究表明,PHLPP1不仅可以在体外抑制癌细胞的生长,还可以在体内下调癌细胞裸鼠成瘤能力〔12~14〕。本研究显示,PHLPP1在三株结直肠癌细胞中的表达水平均明显低于人正常结肠上皮细胞,并且过表PHLPP1后的结直肠癌细胞的增殖能力明显降低,这明确了PHLPP1在结直肠癌细胞增殖中的作用。
细胞周期有两个较为关键的检查点,为G1/S期和G2/M期,这两个检查点在受到相关因子的调节作用后可以顺利地进入下一个周期,细胞周期顺利进展是细胞增殖的关键〔15〕。在哺乳动物、酵母等生命体内已经证实,G1期决定着细胞是否可以完成的一个细胞周期,G1期是细胞DNA复制准备的关键时期〔16〕。细胞周期素是调控细胞周期的重要因子,其中CyclinD1在G1期合成水平较高,能够促进细胞从G1期向S期过渡〔17,18〕。周期素依赖性激酶可以同周期素结合,其表达水平的高低随着细胞周期进展而呈现规律性的变化,Cdk4在G1期同Cyclin结合促进细胞周期进展〔19〕。最近的研究显示,PHLPP1能够将细胞髓系白血病细胞周期阻滞在G1期,这可能是其抑制白血病细胞生长的原因之一〔20〕。本实验结果显示,PHLPP1同样可以阻碍结直肠癌细胞从G1期向S期过渡,并且可以下调Cdk4、Cyclin D1蛋白的表达,提示PHLPP1可能通过阻碍细胞周期进展下调结直肠癌细胞增殖能力。
肿瘤的发生和发展除了与肿瘤细胞恶性增殖有关以外,还与肿瘤细胞凋亡减少有关,肿瘤细胞的凋亡受到细胞内多种基因的共同调控作用,其中Caspase凋亡反应是细胞凋亡发生的主要原因,Caspase-3和Caspase-9作为该凋亡反应的执行因子和起始因子在凋亡过程中发挥标志性作用〔21~23〕。目前在肺癌、胃癌等肿瘤中发现,上调PHLPP1的表达可以激活细胞内Caspase凋亡反应,这可能是PHLPP1诱导细胞凋亡的机制之一〔24,25〕。本实验证实,上调PHLPP1后的结直肠癌细胞中Caspase-3和Caspase-9活化程度升高,细胞凋亡率也升高,提示PHLPP1可以激活Caspase凋亡反应诱导结直肠癌细胞凋亡。
