Fascin-1在甲状腺癌细胞中表达及其对细胞生物学行为的调控作用
2019-09-03王聚蒋茂燕杨培庆
王聚 蒋茂燕 杨培庆
(遵义医科大学附属医院核医学科,贵州 遵义 563003)
甲状腺癌起源于甲状腺滤泡旁细胞或甲状腺滤泡细胞,甲状腺癌具有恶性程度高、转移快等特点,研究甲状腺癌细胞生长、侵袭等生物学分子机制对甲状腺癌的治疗具有重要意义〔1,2〕。聚束蛋白(Fascin)-1是肌动蛋白结合蛋白,其具有促进肌动蛋白成束的作用,参与细胞骨架的调控过程,Fascin-1在内皮细胞、间质细胞、树突细胞、神经细胞中广泛表达,在其他正常细胞中几乎不表达〔3~5〕。研究显示,Fascin-1在肿瘤组织中高表达,目前在食管癌、结肠癌、肺癌等肿瘤中已经得以证实,肿瘤细胞敲低Fascin-1后,细胞凋亡增多,肿瘤细胞转移能力下调〔6~8〕。Fascin-1在甲状腺癌组织中表达上调,而对于其在甲状腺癌细胞增殖、凋亡、侵袭等生物学特性中的作用尚不明确〔9〕。本实验探讨敲低Fascin-1在甲状腺癌细胞生物学特性中的作用,为研究Fascin-1在甲状腺癌发生中的作用机制奠定基础。
1 材料与方法
1.1材料 基质金属蛋白酶(MMP)-2、-9抗体、活化的Caspase(C-Caspase)-9抗体购自美国Cell Signaling Technology公司;Trizol细胞总RNA抽提试剂购自上海史瑞克生物科技有限公司;SYBR实时定量聚合酶链反应(qRT-PCR)试剂盒购自上海吉凯基因化学技术有限公司;引物由上海生工生物合成;C-Caspase-3抗体、Fascin-1抗体购自美国Bioss;Fascin-1 shRNA重组慢病毒和阴性对照慢病毒购自山东维真生物科技有限公司;人甲状腺癌细胞K1、GTHW3、FTC-133和人甲状腺细胞Nthy-ori 3-1购自美国ATCC。
1.2实时PCR检测Fascin-1表达 收集人甲状腺癌细胞K1、GTHW3、FTC-133和人甲状腺细胞Nthy-ori 3-1,提取细胞中的总RNA,RNA溶解在无核糖核酸酶的超净水中,以紫外分光光度计检测A260和A280,A260和A280比值在1.8~2.0。按照逆转录试剂盒合成cDNA,以SYBR荧光染料法进行qRT-PCR。反应结束后获取各个反应的Ct值,根据2-△△Ct法对Fascin-1表达量进行分析,GAPDH作为参照。Fascin-1正义:5′-CTCCCTGCTAACCCCTTCTCC-3′,反义:5′-CCCAACCGTCCCTTAGCC-3′。GAPDH正义:5′-GTCAACGGATTTGGTCTGTATT-3′,反义:5′-AGTCTTCTGGGTGGCAGTGAT-3′。
1.3Western印迹检测Fascin-1表达 收集人甲状腺癌细胞K1、GTHW3、FTC-133和人甲状腺细胞Nthy-ori 3-1,添加放射免疫沉淀(RIPA)裂解液,迅速混合以后,放在冰上静置20 min,把各组细胞收集以后,4℃离心20 min,吸取上清,经二喹啉甲酸(BCA)法测定蛋白浓度以后,在蛋白样品中添加5×上样缓冲液混合液,100℃煮沸5 min,放在冰箱内备用。吸取50 μg的蛋白样品,添加到上样孔内,电泳开始的电压设置为80 V,溴酚蓝要进入分离胶时调整电压为100 V,电泳时间约3 h,此时溴酚蓝跑出凝胶。在4℃,100 V恒压条件下进行转膜,将凝胶上的蛋白转移到聚偏氟乙烯(PVDF)膜上。把PVDF膜放在5%牛血清白蛋白中孵育2 h后,置于一抗杂交袋内,一抗以1∶400稀释,4℃过夜,再置于二抗杂交袋内,二抗以1∶2 000稀释,在室温孵育2 h。电化学发光(ECL)显色,显影后,对蛋白条带进行半定量分析,内参为GAPDH。
1.4细胞分组和感染 K1细胞接种到6孔板内,细胞接种密度为104个细胞/孔,细胞生长密度为30%~40%时,在细胞中添加慢病毒,感染复数(MOI)=20,培养24 h后换液,继续培养72 h,观察绿色荧光蛋白(GFP)表达,转染效率高于85%用于后续实验。把感染Fascin-1 shRNA和阴性对照慢病毒的K1细胞记为Fascin-1 shRNA和shRNA-NC,把未做感染的细胞作为对照(Control)。用实时定量PCR和Western印迹检测Fascin-1 shRNA干扰效果,步骤同1.2和1.3。
1.5MTT检测细胞增殖 Control、shRNA-NC、Fascin-1 shRNA细胞接种到96孔板内,每孔加3×103个细胞,继续培养24 h以后,在每孔中添加20 μl的噻唑蓝(MTT)溶液,继续培养4 h,把孔内的液体弃掉,添加150 μl的二甲基亚砜(DMSO),溶解10 min后,检测490 nm的A值,经空白孔调零以后,分析细胞存活率变化。
1.6流式细胞术检测细胞凋亡 取Control、shRNA-NC、Fascin-1 shRNA细胞,在细胞中添加结合缓冲液约500 μl,添加5 μl的Annexin V-异硫氰酸荧光素(FITC),混匀后,再添加5 μl的碘化丙啶(PI),置于室温中避光反应5 min,在1 h内进行流式细胞仪检测。
1.7Transwell小室检测细胞侵袭 取Control、shRNA-NC、Fascin-1 shRNA细胞,用24孔8 μm滤膜微孔Transwell小室进行细胞侵袭实验,在小室内添加基质胶将小室湿化以后,在小室的上室每孔加入5×108个细胞(以不含血清的培养液稀释),下室内加入1 000 μl的细胞培养液,常规方法培养24 h后,把小室表面的细胞擦掉,用结晶紫染色以后,显微镜下观察细胞侵袭数目(×100)。
1.8划痕愈合实验检测细胞迁移 取Control、shRNA-NC、Fascin-1 shRNA细胞,接种到24孔板内,接种密度为每孔添加5×104个细胞,细胞汇合成片以后,在24孔板内划线,添加1%胎牛血清的杜尔伯科改良伊格尔培养基(DMEM)继续培养24 h。显微镜下观察0 h和24 h划痕的宽度(×40),计算细胞迁移距离(0 h划痕宽度-24 h划痕宽度)。
1.9Western印迹检测细胞中MMP-2、-9、C-Caspase-3、-9蛋白水平 取Control、shRNA-NC、Fascin-1 shRNA细胞,步骤同1.3,其中MMP-2、-9抗体以1∶400稀释,C-Caspase-3、-9抗体以1∶600稀释。
1.10统计分析 采用SPSS21.0软件进行单因素方差分析和SNK-q检验。
2 结 果
2.1Fascin-1蛋白和mRNA在甲状腺癌细胞中高表达 人甲状腺癌细胞K1、GTHW3、FTC-133中Fascin-1蛋白和mRNA表达水平显著高于人甲状腺细胞Nthy-ori 3-1(P<0.05)。K1细胞中Fascin-1蛋白和mRNA表达水平显著高于GTHW3、FTC-133细胞(P<0.05)。见图1和表1。选用表达水平较高的K1细胞做后续实验。
2.2Fascin-1 shRNA对甲状腺癌细胞中Fascin-1 mRNA和蛋白表达影响 Fascin-1 shRNA重组慢病毒感染后的甲状腺癌细胞中Fascin-1 mRNA和蛋白表达水平较其他两组显著降低(P<0.05)。Fascin-1 shRNA能够成功下调甲状腺癌细胞中Fascin-1 mRNA和蛋白的表达。见图2和表2。

图1 人甲状腺癌细胞K1、GTHW3、FTC-133和人甲状腺细胞Nthy-ori 3-1中Fascin-1蛋白水平

细胞Fascin-1 mRNAFascin-1蛋白K14.15±0.361)0.32±0.041)GTHW33.01±0.231)2)0.16±0.021)2)FTC-1333.56±0.141)2)0.22±0.021)2)Nthy-ori 3-11.00±0.000.03±0.01F/P值111.165/0.00070.520/0.000
与Nthy-ori 3-1比较:1)P<0.05;与K1比较:2)P<0.05

图2 Western印迹测定Fascin-1 shRNA对甲状腺癌细胞中Fascin-1蛋白表达影响
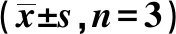
表2 慢病毒感染后甲状腺癌细胞中Fascin-1 mRNA和蛋白表达水平
与shRNA-NC、Control比较:1)P<0.05;下表同
2.3敲低Fascin-1抑制甲状腺癌细胞增殖并诱导凋亡 敲低Fascin-1后的甲状腺癌细胞的存活率显著较其他两组降低,细胞凋亡率显著升高(P<0.05),敲低Fascin-1抑制甲状腺癌细胞增殖并诱导细胞凋亡。见图3,表3。
2.4敲低Fascin-1降低甲状腺癌细胞侵袭和迁移能力 敲低Fascin-1后甲状腺癌细胞侵袭数目和迁移距离均较其他两组显著降低(P<0.05),敲低Fascin-1抑制甲状腺癌细胞侵袭和迁移能力。见表4。
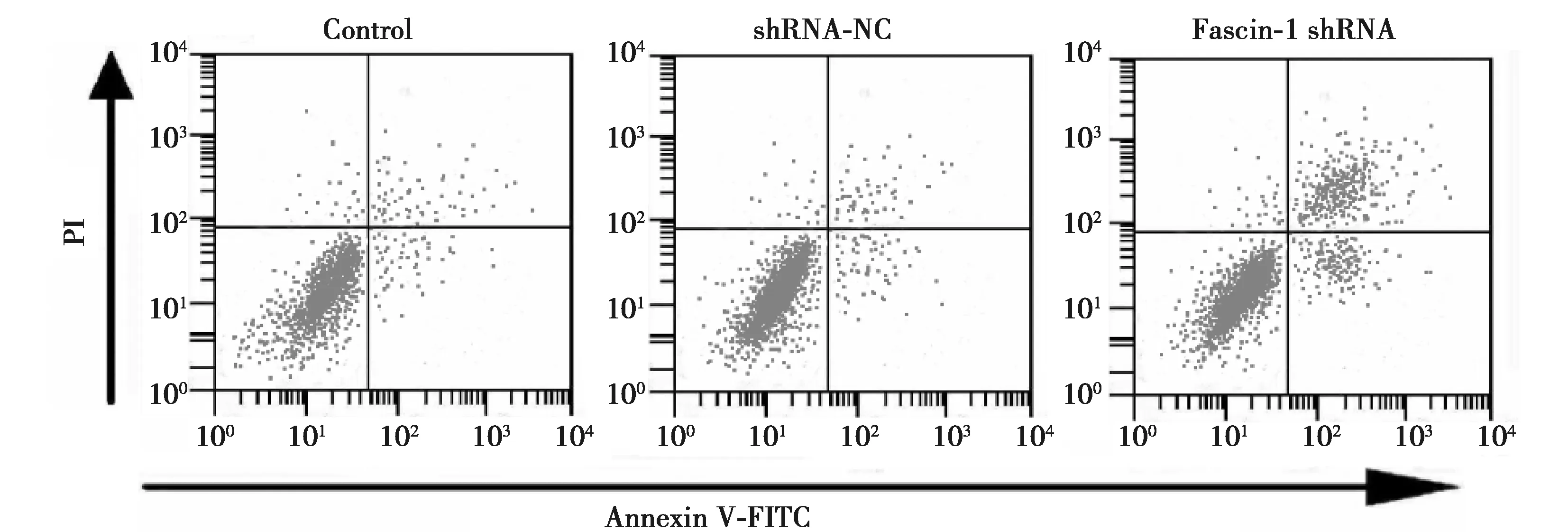
图3 流式细胞术测定敲低Fascin-1对甲状腺癌细胞凋亡的影响
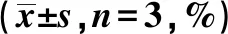
表3 敲低Fascin-1后甲状腺癌细胞存活率和凋亡率比较
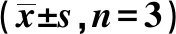
表4 敲低Fascin-1后甲状腺癌细胞侵袭数目和迁移距离比较
2.5敲低Fascin-1对甲状腺癌细胞中MMP-2、-9蛋白、C-Caspase-3、-9蛋白表达影响 敲低Fascin-1后的甲状腺癌细胞中MMP-2、-9蛋白水平较其他两组显著降低,C-Caspase-3、-9蛋白水平较其他两组显著升高,敲低Fascin-1抑制甲状腺癌细胞中MMP-2、-9蛋白表达,提高细胞中C-Caspase-3、-9蛋白水平。见表5和图4。
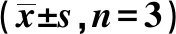
表5 敲低Fascin-1后甲状腺癌细胞中MMP-2、-9、C-Caspase-3、-9蛋白水平比较

图4 Western印迹检测敲低Fascin-1后甲状腺癌细胞中MMP-2、-9、C-Caspase-3、-9蛋白水平
3 讨 论
Fascin是从海胆卵母细胞中分离出来的一种结合蛋白,其可以与肌动蛋白紧密连接形成束状结构,在人类中已经发现Fascin的3种形式,其中Fascin-1在神经系统组织和间质组织中表达,Fascin-2在视网膜细胞中广泛表达,Fascin-3特异性表达于睾丸组织中,Fascin-1与肿瘤发生有关〔10~12〕。Fascin-1与肌动蛋白结合形成束状结构,并且Fascin-1定位于束状结构的核心部位,其可以促进细胞形成伪足样结构,促进细胞运动和迁移〔13〕。目前在卵巢癌、结肠癌等肿瘤组织中已经发现Fascin-1高表达,敲低其表达不仅可以下调肿瘤细胞的转移能力,还可以诱导肿瘤细胞凋亡〔14,15〕。本实验结果表明,Fascin-1在甲状腺癌细胞中表达水平高于正常甲状腺细胞,并且敲低其表达后的甲状腺癌细胞增殖、侵袭、迁移能力均降低,细胞凋亡增多,Fascin-1在甲状腺癌细胞中高表达,敲低Fascin-1表达具有抗甲状腺癌作用。
肿瘤细胞的凋亡与肿瘤细胞中Caspase凋亡反应有关,Caspase是一种广泛存在于人类各种组织和器官中的天冬氨酸蛋白水解酶,其在内皮细胞、上皮细胞、神经细胞等细胞凋亡中均具有调控作用,细胞在受到凋亡信号刺激以后,细胞内Caspase蛋白家族成员能够迅速激活,诱导细胞凋亡〔16,17〕。Caspase-9和Caspase-3分别是Caspase凋亡反应的起始和执行因子,正常情况下以没有活性的酶原形式存在,只有被激活后才可以诱导细胞凋亡〔18,19〕。敲低Fascin-1具有激活细胞内Caspase级联反应的作用〔20〕。本实验表明,敲低Fascin-1具有激活Caspase级联反应诱导甲状腺癌细胞凋亡的作用。
肿瘤细胞的侵袭和迁移过程是一个多步骤过程,细胞外基质降解是细胞转移的关键步骤之一,肿瘤细胞分泌的MMPs是细胞降解外基质的主要蛋白酶,MMP-2和MMP-9是MMPs家族中与肿瘤关系最密切的成员,二者几乎可以降解细胞外基质的所有成分,在肿瘤转移中发挥促进作用〔21~23〕。在胰腺癌、胆管癌等肿瘤细胞中的研究表明,敲低Fascin-1具有下调肿瘤细胞中MMPs表达水平的作用〔24,25〕。本研究提示敲低Fascin-1通过抑制甲状腺癌细胞合成MMP-2、-9降低细胞的侵袭和迁移能力。
综上,Fascin-1在甲状腺癌细胞中高表达,敲低Fascin-1具有抑制甲状腺癌细胞增殖、侵袭、迁移并诱导甲状腺癌细胞凋亡的作用,Fascin-1在甲状腺癌发生中可能发挥促进作用,靶向Fascin-1可能是治疗甲状腺癌的途径之一。
