B7-H4在肝癌组织中的表达及其对肝癌细胞侵袭、迁移的影响
2019-09-02何涛胡洪谢楠钱程胡明张楚悦柯恬恬李春满付必莽苏莹珍
何涛,胡洪,谢楠,钱程,胡明,张楚悦,柯恬恬,李春满,付必莽,苏莹珍
作者单位:1玉溪市人民医院胃肠外科,云南 玉溪 653100;2昆明医科大学第二附属医院,a肝胆胰外科,b麻醉科,云南 昆明 650101;3昆明学院医学院公共卫生教研室,云南 昆明 650214
肝细胞性肝癌(hepatocellular carcinoma,HCC)恶性程度极高,发现较晚,即使手术根治性切除,多数病人预后5年生存率仍不足20%[1]。B7-H4是免疫共刺激信号通路的关键分子之一,主要功能为负性共刺激分子,可参与细胞的周期调控、细胞增殖与凋亡以及影响细胞侵袭力等肿瘤发生的多个环节。研究发现,B7-H4蛋白在正常组织中不表达或者微量表达,但在多个肿瘤中呈高表达,同时其mRNA可在多个正常组织中被检测到[1-3]。我们前期在肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)的研究中,发现B7-H4与ICC的形成和细胞侵袭过程有关,且B7-H4表达与肿瘤分级密切相关,可作为ICC复发早期的诊断靶分子;B7-H4异常表达能够促进ICC细胞的体外肿瘤形成能力[2]。以上研究结果均提示B7-H4可能具有促癌基因的功能,但其与肝癌的关系尚不明确。因此,本研究结合免疫组织化学染色及细胞慢病毒抑制实验进行研究,为此特别挑选恶性程度较高的肝癌细胞系进行筛选,进行后续细胞实验。经过前期实验,筛选出部分高表达B7-H4细胞株。扩大培养后进行慢病毒转染,以期通过体外抑制B7-H4基因的表达,并分析抑制后对上述肝癌细胞在侵袭、迁移等能力上的可能影响作用。现结合具体实验过程及结果分析并报告如下。
1 材料与方法
1.1材料收集2013年8月至2019年1月昆明医科大学第二附属医院住院的肝癌病人的肝癌组织32例。人肝癌细胞株Hep3B、SMMC-7721、Huh-7购自中科院昆明细胞库;PLC/PRF/5、HepG2、HCCLM3肝癌细胞株购自中国科学院上海细胞库;细胞培养基DMEM、RPMI-1640培养基、胎牛血清及GAPDH单克隆抗体购自昆明贝尔吉生物公司;Trizol试剂和慢病毒转染试剂polybrene购自上海翊圣生物科技有限公司;RNA提取试剂盒和逆转录试剂盒购自大连宝生物工程有限公司;实时荧光定量PCR引物、慢病毒载体设计合成与验证均由北京安必奇生物科技有限公司完成;细胞裂解液(RIPA)、胰酶消化液和BCA蛋白定量试剂盒购自碧云天生物技术有限公司;兔抗单克隆抗体,购自美国BD公司;ECL成像系统,由上海天能科技有限公司提供;Transwell小室购自于美国Corning公司。
1.2免疫组织化学染色(1)取材及病理:将32例肝癌术后肝癌组织标本放入4%多聚甲醛溶液中固定,石蜡包埋,制成蜡块。(2)免疫组化方法:石蜡切片脱蜡和水化,修复抗原,滴加封闭液。加滴B7-H4一抗液,4℃过夜。再PBS冲洗3次,滴加二抗,PBS冲洗3次。DAB显色,苏木素复染,中性树胶封固。每次实验均做阳性与阴性对照,阳性细胞质着色为棕黄色,每例均设有HE切片作对照观察。(3)免疫组化结果判断标准:采用双盲法观察切片,B7-H4免疫组化在细胞膜上染黄色或褐色。实验样本根据细胞染色强度和细胞染色比例独立评分。根据被染色细胞在细胞总数中所占的比例进行评分即1%~25%,25%~50%,50%~75%和>75%分别评分为0、1、2、3和4分。该细胞染色的强度由颜色程度来确定,即无、弱、中、强评分分别为0、1、2和3分。每个病人综合得分为0~7分,将B7-H4低组的分数定为≤3分,B7-H4高组得分>3分。
1.3肝癌细胞的培养、筛选及沉默HCCLM3、SMMC-7721、Huh-7三种肝癌细胞使用DMEM高糖培养基培养,余下细胞均使用RPMI-1640培养基培养。分别在适宜条件下培养上述细胞,将培养好的细胞分瓶培养在6孔板中待细胞融合率为70%~80%时,收取蛋白利用WB法,筛选B7-H4各细胞表达量。同时将细胞采用随机数字表法分组转染慢病毒,分别为对照组、shRNA-1抑制组、shRNA-2抑制组。培养筛选后的各组细胞并观察细胞状态,分别实施转染操作。shRNA-1序列:5′-GCTAATGACAGAGAGAGGATC-3′,shRNA-2序列:5′-GAACGTCAGTGTAGAGTATGA-3′。shRNA-1组、shRNA-2组分别转染上述对应抑制序列,对照组只加转染试剂。具体过程:(1)培养细胞并计数,以1×105/孔在24孔板中培养,并最终达到2×105/孔;(2)配置polybrene转染液,使其终浓度达到6 μg/mL,转染时先用polybrene替换原培养基,加入目的基因病毒悬液,继续培养;(3)6 h后,加入1.5 mL新鲜培养基;(4)继续培养1 d,并用新鲜培养基培养细胞;(5)转染至2 d后进行荧光观察,并收集转染荧光最强时的各组细胞进行后续细胞功能实验。
1.4WB法及RT-PCR法检测B7-H4抑制效率取上述各组细胞并提取蛋白,同时行蛋白定量。加蛋白上样缓冲液混匀,沸水加热变性。配置WB胶版并上样,每孔约30 μg,110 V恒压电泳,220 mA恒流转膜。PVDF膜于TBS-T液漂洗10 s,脱脂牛奶封闭1 h,孵育目的抗体和内参,4℃孵育过夜。第二日TBS洗膜3次,TBS-T洗膜1次,加入二抗,室温孵育1 h,再次分别洗膜,曝光条带分析结果,筛选最适宜细胞HCCLM3进行下步实验,RT-PCR实验结果也与上述实验结果一致。
1.5细胞侵袭及迁移能力分别采用Transwell细胞侵袭试验和细胞划痕试验。细胞侵袭试验,Transwell小室放置于预先制备好Matrigel基质胶的24孔板中,按上述条件培养箱中过夜,向Transwell小室下室中加入500 μL含10%FBS的DMEM高糖培养基。用无血清的DMEM高糖培养液重悬各组细胞,取100 μL细胞悬液(细胞总数约1×105个)加至Transwell的上室。48 h后去除下室中的培养液,将小室置于4%的多聚甲醛中固定15 min,擦去小室内室膜上的细胞,结晶紫溶液(0.1%)染色10 min,PBS缓冲液漂洗后,显微镜下观察,每孔随机选取5个视野拍照,统计并分析。细胞划痕试验,在6孔板中培养前述肝癌细胞,将细胞在无血清中持续饥饿24 h后使用移液枪头进行划伤,再用PBS洗涤,在0、24、48 h使用相差显微镜进行拍照。随后通过手动计数进行细胞抑制率的测定,相关结果用百分比表示,上述所有实验均常规进行3次。
1.6统计学方法采用SPSS19.0统计软件分析。计量资料以±s表示,组间比较采用单因素方差分析,两组比较采用成组t检验。P<0.05为差异有统计学意义。
2 结果
2.1肝癌中B7-H4表达与临床病理特征的相关性32例肝癌组织中,有14例被染色,染色阳性率为43.75%,其中,强阳性8例,中等及弱阳性6例,同时,该研究中有5例肝癌复发病人。表1的结果表明,肿瘤的BCLC分期等和B7-H4的表达密切相关(P=0.013)。B7-H4在肝癌组织中的表达明显高于癌旁组织,肝癌中B7-H4表达越高,病人术后越容易复发,见图1。

图1 肝癌病人中的B7-H4表达情况,可见B7-H4表达越高越容易复发(A为免疫组织化学×200;B为免疫组织化学×400)
2.2HCC细胞筛选B7-H4的表达量上述各组肝癌细胞的B7-H4相对表达量见图2,从结果可见HCCLM3和PLC/PRF/5两株细胞B7-H4表达量较高。
2.3慢病毒载体抑制细胞B7-H4表达情况HCCLM3的WesternBlot相对表达量:对照组(5.32±1.03)、shRNA-1组(1.42±0.29)、shRNA-2组(2.06±0.68),而PT-PCR结果:对照组(7.21±0.38)、shRNA-1组(1.71±0.25)、shRNA-2组(2.27±0.38)。PLC/PRF/5组与HCCLM3组结果相似。shRNA-1组、shRNA-2组均被抑制,shRNA-1组抑制明显(P<0.05)。见图3~6。

表1 32例肝癌中B7-H4表达与临床病理特征的相关性/例

图2 不同肝癌细胞系中的B7-H4表达情况
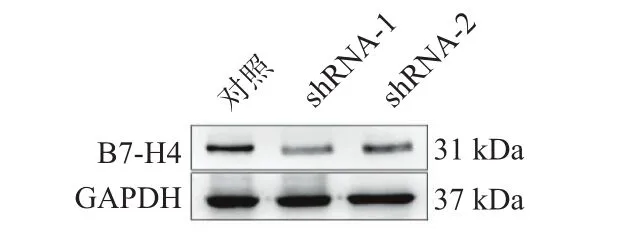
图3 肝癌细胞HCCLM3慢病毒载体抑制(WB)

图4 肝癌细胞HCCLM3慢病毒载体抑制(RT-PCR)

图5 肝癌细胞PLC/PRF/5慢病毒载体抑制(WB)
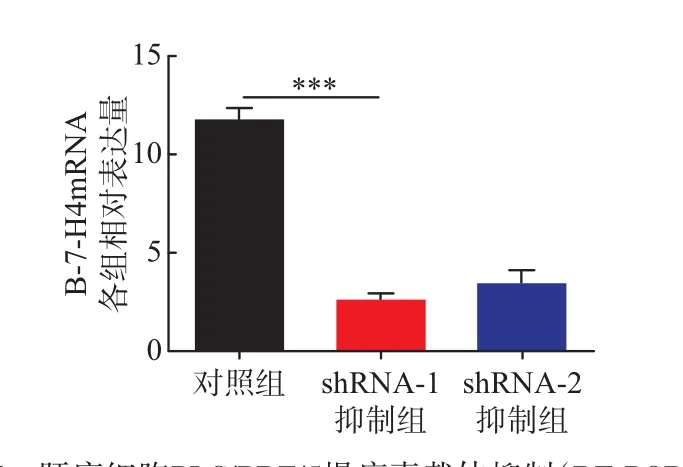
图6 肝癌细胞PLC/PRF/5慢病毒载体抑制(RT-PCR)
2.4慢病毒载体抑制B7-H4表达对HCCLM3和PLC/PRF/5细胞侵袭能力的影响HCCLM3对照组的细胞数为(365±21)、shRNA-1组(128±8);PLC/PRF/5组的细胞数为(267±44)、shRNA-1组(79±12)。与对照组相比较,shRNA-1组可明显抑制HCCLM3和PLC/PRF/5的细胞侵袭能力(P<0.01)。见图7,8。
2.5慢病毒载体抑制B7-H4表达对HCCLM3和PLC/PRF/5细胞迁移能力的影响HCCLM3对照组的细胞迁移率为(82%±13%)、shRNA-1组(44%±6%);PLC/PRF/5对照组细胞迁移率为(77%±9%)、shRNA-1组(41%±6%)。与对照组相比较,shRNA-1组明显抑制HCCLM3和PLC/PRF/5的细胞迁移能力(P<0.05)。见图9,10。

图7 肝癌细胞HCCLM3慢病毒载体抑制后的各组侵袭情况(×200)
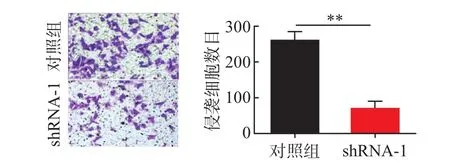
图8 肝癌细胞PLC/PRF/5慢病毒载体抑制后的各组侵袭情况(×200)
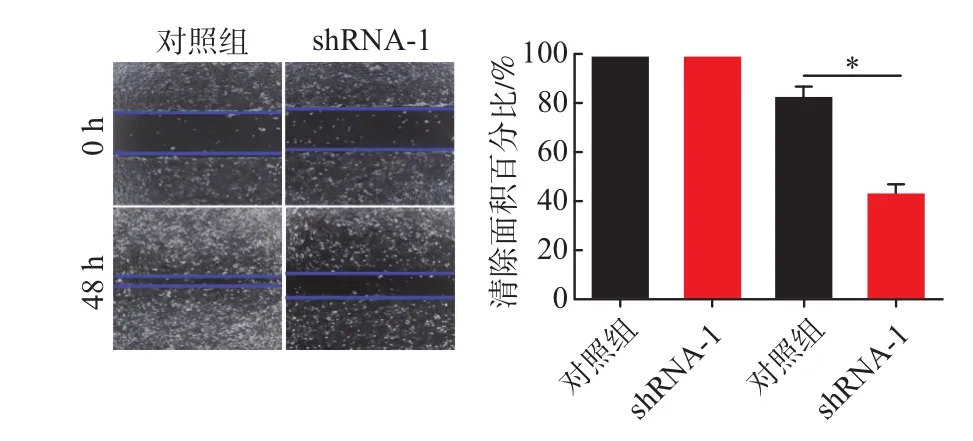
图9 肝癌细胞HCCLM3慢病毒载体抑制后的各组迁移情况图(×100)
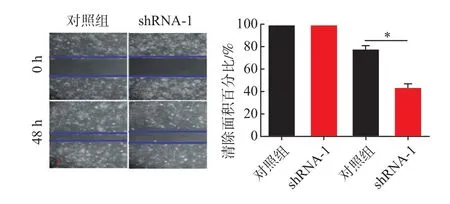
图10 肝癌细胞PLC/PRF/5慢病毒载体抑制后的各组迁移情况(×100)
3 讨论
B7-H4是B7家族近年来最新发现的新型共免疫分子,其主要定位于细胞膜及细胞质。数年来,其研究重点在于共免疫分子机制上,很少关注到该分子在肿瘤发生发展中的详细机制。该分子一般不在组织中表达,但其在多数肿瘤中呈现高表达。如结肠癌、ICC等[1-2,4]。我们在对结肠癌的研究中,发现该分子可能参与结肠癌的肺转移过程。同时在ICC的研究中,发现其可明显促进肿瘤进展,可参与肿瘤的EMT过程及抑制ICC细胞的凋亡。过表达B7-H4可增加ICC细胞的侵袭及转移,同时抑制细胞凋亡过程。该过程与Bcl-2/bax的表达失调可能有关[2-6]。Qian等[7]的研究也发现,B7-H4可增加细胞内Bax表达,抑制Bcl-2表达,最终使得caspese-3表达发生改变并促进凋亡。另有研究指出,B7-H4可调节激酶1/2erk等的表达,影响肿瘤细胞凋亡过程[2,5-6]。此外,B7-H4的过表达可能与Fas/FasL信号通路相关,对细胞的凋亡同样有一定作用[8-9]。Jeon等通过研究发现,B7-H4可诱导NF-κB信号激活。而NF-κB通路的抑制可阻止癌细胞侵袭。同时NF-κB信号传导也与细胞EMT有关。
B7-H4可参与肿瘤发生的多个过程,如研究发现过表达B7-H4可增强细胞增殖。Zhang等[9-11]研究认为,B7-H4可能发生从细胞质-细胞核的穿梭。因其基因包含核定位序列,而核内的B7-H4与Cyclin E/D1的表达有关,参与细胞周期G/S期的调控。还有研究发现,B7-H4可促使人结肠癌SW-620及RKO的增殖。同时,体内过表达B7-H4可使裸鼠肿瘤生长加速。一些研究指出B7-H4可能与JAK2/STAT3及缺氧诱导因子HIF信号通路有关。
B7-H4的过表达还可增强肿瘤细胞的侵袭、转移能力。我们的实验发现,过表达B7-H4可导致肿瘤细胞侵袭及转移能力增加。我们最终发现该过程可能与细胞的EMT转化及PI3K/AKT通路激活有关[1,4,10-12]。同时研究发现,B7-H4与CXCL-12趋化因子及其受体的转录及蛋白表达有关,B7-H4表达被下调后,细胞侵袭能力也随之下调[10-13]。Kang等[14]的研究认为,B7-H4 的抑制可通过提高CD107a颗粒酶A颗粒酶B穿孔素和IFN-γ的表达和分泌水平来帮助CD8+T恢复抗肿瘤免疫。同时他们在HCC的荷瘤小鼠模型中,B7-H4的过表达可以增加实验组的小鼠平均肿瘤体积。同时另有研究发现,通过酶联免疫吸附试验检测来自93例HCC病人和55名健康志愿者的血液样本中的循环sB7-H4水平,并统计分析sB7-H4水平与临床病理因素、总生存期(OS)和复发时间的关系,结果表明血清中sB7-H4的表达水平可作为诊断或预测HCC病人临床结果的独立预测因子[14-15]。我们最新研究发现,B7-H4下调的裸鼠其肝内肝癌癌细胞向肺部转移的倾向也会受抑制。而血清中的B7-H4与病人的临床各指标密切相关,血清中B7-H4越高,其预后越差,越易复发。同时在后续的研究中,我们发现基于HCCLM3的肝癌细胞研究层面上,肿瘤的侵袭和转移过程更容易在裸鼠上进行体内实验,相比其他细胞系来说,可以更好的研究B7-H4的远处转移和肿瘤细胞侵袭与迁移的抑制。
本研究发现,B7-H4在肝癌组织中的表达明显高于癌旁组织,且肝癌中B7-H4表达越高,病人越容易复发。同时,抑制B7-H4后,HCCLM3肝癌细胞侵袭及迁移能力均明显减弱,而肿瘤细胞的运动能力对肿瘤的转移至关重要。结果表明,shRNA-1组抑制效果较为理想,shRNA-2组抑制效果较差,可能存在脱靶效应。本研究揭示可通过抑制B7-H4表达减弱HCCLM3肝癌细胞侵袭及迁移能力,这与我们以往多个研究结果基本一致。
综上所述,慢病毒载体抑制HCCLM3肝癌细胞B7-H4表达可抑制该细胞侵袭及迁移活性,B7-H4有望成为HCC潜在的治疗靶点及肝癌治疗药物研发新方向。
(本文图1见插图9-3)
