5种黑曲霉粗酶液对乌龙茶溶液挥发性成分的影响
2019-09-02李利君李文静于智超
李利君,李文静,于智超,张 婷,李 红,倪 辉
(1.集美大学食品与生物工程学院,福建 厦门 361021.2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021)
0 引言
茶叶是我国重要的经济作物之一,根据加工过程中茶多酚的变化方式和变化程度的不同,茶叶可分为6大类:绿茶(不发酵),白茶(微发酵),黄茶(轻发酵),乌龙茶(半发酵),红茶(全发酵),黑茶(后发酵)[1-2]。其中,乌龙茶是中国特有的茶类,主要品种有:广东乌龙(凤凰单枞、凤凰水仙、岭头单枞等);闽北乌龙(武夷岩茶、水仙、大红袍、肉桂等);闽南乌龙(铁观音、奇兰、水仙、黄金桂等);台湾乌龙(冻顶乌龙)[3]。乌龙茶深受消费者喜爱,名优特色产品众多[4],福建省是最重要的产区,对社会经济产生了重要推动作用。
香气是评价茶叶质量优劣的重要指标之一[5]。酶是决定茶叶香气质量的重要因素,茶叶中的内源酶如β-樱草糖苷酶、β-D-葡萄糖苷酶和巢菜糖苷酶等,它们分别催化β-樱草糖苷、β-D-葡萄糖苷和巢菜糖苷转化成的香气成分是茶叶香气品质形成的重要途径[6-8]。此外,相关研究还发现,夏季乌龙茶经外源酶漆酶和α-半乳糖苷酶处理后,其滋味和香气品质均具有明显的改善[2],外源酶β-葡萄糖苷酶处理绿茶汤对其有明显的增香作用[9]。
黑曲霉(Aspergillusniger)属于丝状真菌,被美国食品药品管理局(food and drugs administration,FDA)认定为安全菌种之一,并且是常用的食品酶制剂生产菌株,它在不同的培养基中发酵能够产生多种不同类别的胞外酶,包括糖苷酶、淀粉酶、蛋白酶等[10]。最近研究发现,黑曲霉胞外酶液处理绿茶粉后,2-乙基呋喃和癸醛含量显著增加,且花香和青草香味增强,整体香气品质显著改善[9]。但是,目前尚未系统对比研究不同培养基发酵的黑曲霉胞外酶液对茶叶香气的影响,因此还不明确不同培养基制备的胞外酶液对茶叶香气的改良效果,限制了应用黑曲霉胞外酶改良茶叶风味品质的技术开发。本文以福建特色乌龙茶为研究对象,采用5种不同培养基(PDA、察氏、果胶、麦麸和柚皮)制备黑曲霉胞外粗酶液,研究不同胞外酶对茶叶水溶液香气的影响,为高效制备改良茶叶香气的黑曲霉胞外酶及开发新型茶叶风味改良技术奠定基础。
1 材料与方法
1.1 材料与试剂
黑曲霉菌株(编号为41034)购于中国工业微生物菌种保藏管理中心(CICC);麦麸和马铃薯购于厦门当地市场;柚皮粉是由新鲜柚皮烘干后粉碎过40目筛;食品级果胶购于厦门唯康食品科技有限公司;秋季铁观音乌龙茶叶购于厦门当地超市;正构烷烃(C8~C20)和环己酮购于Sigma-Aldrich(中国)公司;正己醛、苯甲醛、月桂烯、乙酸己酯、柠檬烯、苯乙醛等标准品分别购于美国Sigma-Aldrich(中国)公司和英国Alfa Aesar(中国)公司;其余试剂均为分析纯,购于上海化学试剂有限公司。
1.2 仪器与设备
小型高速药物粉碎机,上海烨昌食品机械有限公司;SW-CJ-2FD型双人单面净化工作台,苏州净化设备有限公司;可见光分光光度计,上海尤尼柯仪器有限公司;HQ45B恒温摇床,中国科学院武汉科学仪器厂;JKOPZ电热恒温培养箱,上海跃进医疗器械厂;HH-4数显恒温水浴锅,国华电器有限公司;QP-2010 Plus气相色谱-质谱联仪,日本岛津公司;Rtx-5MS毛细管色谱柱(60 m×0.32 mm×0.25 μm),美国Restek公司;HH-157330-U手动SPME进样器、50/30 μm CAR/PDMS萃取头,美国Supelco公司。
1.3 实验方法
1.3.1 孢子悬液的制备
称取去皮马铃薯200 g,加入约1 L水煮沸20 min,用纱布滤渣后,在马铃薯煮出液中加入蔗糖20 g,加水定容至1 L,加入琼脂18 g,加热溶解后取5 mL装入试管,121 ℃高压蒸汽灭菌20 min制备斜面培养基,接种黑曲霉置于30 ℃培养箱中活化培养3~4 d,得到成熟孢子[12]。之后采用质量分数0.75%的无菌氯化钠溶液洗脱孢子,并倒入带有无菌玻璃珠的锥形瓶中,再加入质量分数0.75%的无菌氯化钠溶液振荡均匀,稀释至A600= 2.0(孢子浓度约为1×108个/mL),即为单孢子菌悬液。
1.3.2 黑曲霉发酵粗酶液的制备
将孢子悬液接种到以下5种培养基中并进行培养。
1)马铃薯葡萄糖液体培养基(以下简称PDA):称取去皮马铃薯200 g并切小块,再加适量水煮沸20 min,过滤马铃薯渣,滤液中加入20 g葡萄糖,溶解后加水至1 L。量取30 mL制备好的培养基分装到250 mL的摇瓶中,121 ℃高压蒸汽灭菌20 min,冷却后接种2 mL孢子悬液(1×108个/mL),转速180 r/min,30 ℃培养6 d。
2)察氏液体培养基(以下简称察氏):参照常用察氏培养基配方[12],准确称量硝酸钠3.00 g,磷酸氢二钾1.00 g,氯化钾0.50 g,硫酸亚铁0.01 g,硫酸镁0.50 g,蔗糖30.00 g,加水定容至1 L。量取30 mL制备好的培养基分装到250 mL的摇瓶中,121 ℃高压蒸汽灭菌20 min,冷却后接种2 mL孢子悬液(1×108个/mL),转速180 r/min,30 ℃培养6 d。
3)果胶液体培养基(以下简称果胶):参考Thakur等[13]发酵生产果胶酶的配方,准确称量氯化钾0.50 g,七水合硫酸镁0.10 g,柠檬酸三钠二水合物1.00 g,无水柠檬酸1.00 g,酵母提取物1.00 g,干酪素水解物1.00 g,果胶10.00 g,加水定容到1 L,用1 mol/L的HCl调pH=4.0。量取25 mL分装到250 mL的摇瓶中,121 ℃高压蒸汽灭菌20 min,冷却后接种2 mL孢子悬液(1×108个/mL),转速180 r/min,30 ℃培养4 d。
4)麦麸固体培养基(以下简称麦麸):参考Kumar等[14]发酵黑曲霉果胶酶和纤维素酶的配方,准确称量硫酸铵1.00 g,硫酸镁5.00 g,七水合硫酸亚铁0.005 g,磷酸二氢钾5.00 g,溶于1 L超纯水中,并调节pH=4.8,即为无机盐溶液。准确量取2.10 g麦麸、1.40 g柚皮和6.5 mL无机盐溶液分装到250 mL的锥形瓶中,搅拌均匀,121 ℃高压蒸汽灭菌20 min,冷却后接种2 mL孢子悬液(1×108个/mL),30 ℃培养箱中静置培养6 d。
5)柚皮粉固体培养基(以下简称柚皮):参考本实验室前期发酵棘孢曲霉的配方[15]。准确称量柚皮粉5.00 g,硫酸铵0.50 g,并加入8 mL水溶解,然后分装到250 mL锥形瓶中,121 ℃高压蒸汽灭菌20 min,冷却后接种2 mL孢子悬液(1×108个/mL),30 ℃培养箱中静置培养8 d。
发酵完成后,将液体培养基制备的发酵液进行抽滤去除菌体,得到粗酶液(PDA粗酶、察氏粗酶、果胶粗酶),放入-20 ℃冰箱保存备用。麦麸和柚皮的固态发酵产物中分别加入30 mL的pH=7.0的磷酸盐缓冲液,20 ℃、180 r/min振荡洗脱1 h后进行抽滤,制备得到麦麸粗酶和柚皮粗酶,放入-20℃冰箱保存备用。
1.3.3 黑曲霉发酵粗酶液处理乌龙茶水溶液
称取2 g乌龙茶叶置于50 mL萃取瓶中,同时加入30 mL粗酶液,再加入10 μL环己酮(1 g/L)作为内标,拧紧瓶盖后,置于40 ℃水浴锅中反应60 min。空白对照分别为:1)乌龙茶叶中加入30 mL超纯水;2)30 mL酶液加上2 mL水。
1.3.4 乌龙茶水溶液挥发性成分的固相微萃取及GC-MS分析
将50/30 μm CAR/PDMS萃取头插入气相色谱进样口中,230 ℃老化3 min,载气的流量为3 mL/min。将老化后的萃取头插入萃取瓶并停留在萃取瓶顶空部分,吸附20 min。吸附完成后,将固相微萃取头插到气相色谱的进样口解吸3 min,按照如下条件进行GC-MS分析。
色谱柱为Rtx-5MS(60 m×0.32 mm×0.25 μm),以高纯氦气(纯度99.999%)作为载气,进样口温度为230 ℃,不分流进样。柱流量设为3 mL/min,柱温度初始为50 ℃保持2 min,2 ℃/min升温至120 ℃,再5 ℃/min升温至200 ℃,在200 ℃保持1 min。离子源温度为220 ℃,电离方式为EI,电离能量为0.80 kV,接口温度为250 ℃,扫描方式选择SCAN模式进行定性分析,离子碎片的扫描范围(m/z)为35~500。溶剂延迟时间为1.5 min。
对挥发性成分采用3种方式进行定性:1)运用质谱数据库(NIST08、NIST08s、FFNSC1.3)进行相似度检索,根据不同物质的基峰、质荷比以及相对峰度进行串连检索与人工解析,根据质谱匹配度大于80%的标准进行物质鉴定;2)将待测物质的特征离子与标准品比较进行定性;3)计算待测物质的保留指数,与文献报道及标准品进行对比定性。保留指数运算参考Dool等[16]的方法:RIx=100n+100[t(m)-t(n)]/[t(n+1)-t(n)],式中:RIx为待测定成分的保留指数;t(m)为待测成分的调整保留时间;t(n)表示具有n个碳原子数的正构烷烃的调整保留时间;t(n+1)表示具有n+1个碳原子数正构烷烃的调整保留时间。
定量分析时质谱扫描方式设为SIM模式,具有标准品的化合物采用的该物质标准曲线用外标法定量;不具有标准品的化合物通过计算与环己酮峰面积的比值来进行相对定量。
在定性分析的基础上,进一步计算香气强度值(odour activity value,OAV)用于评价香气贡献成分,其计算公式为:OAV=挥发性物质浓度/风味阈值。
1.4 统计分析
参照相关文献[17],通过Microsoft Office Excel 2010 软件计算实验数据的均值和标准差,并绘制相关图表,利用SPSS 19.0软件对挥发性成分含量的数据进行显著性分析。
2 结果与分析
2.1 挥发性成分的定性分析
对黑曲霉粗酶液处理前后的乌龙茶水溶液挥发性成分进行GC-MS分析,得到其总离子流图(见图1),根据相似度检索、特征离子碎片、标准品比对并参考相关文献,共鉴定出28种挥发性成分(见表1),包括酯类10种、醛类4种、醇类5种、烯烃类6种和其他类化合物3种。由此可知,主要挥发性成分为酯类、醛类和醇类,这与有关研究[18]对乌龙茶叶挥发性成分种类的研究结果基本一致。
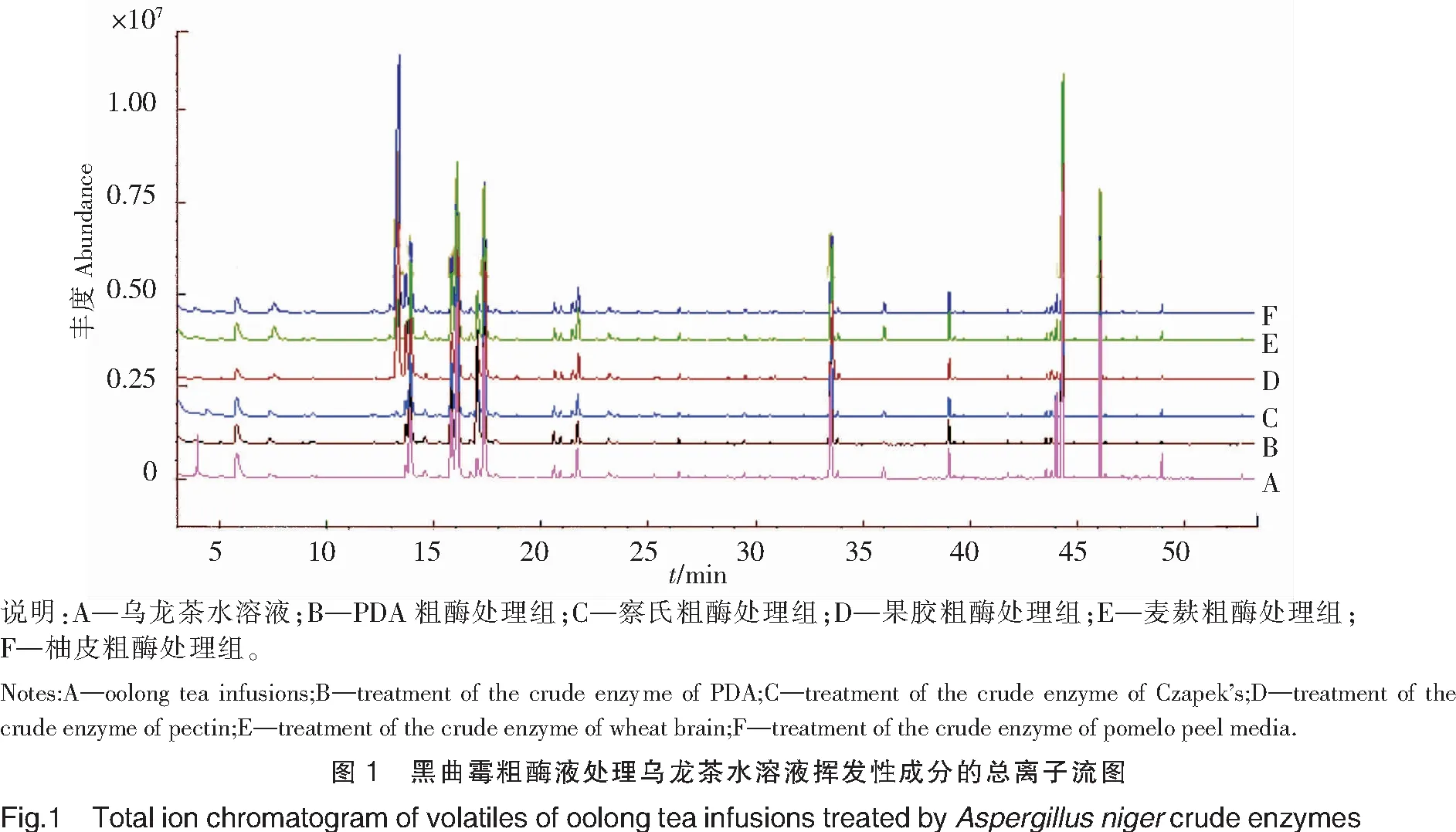
表1 黑曲霉粗酶液处理乌龙茶水溶液挥发性成分鉴定结果
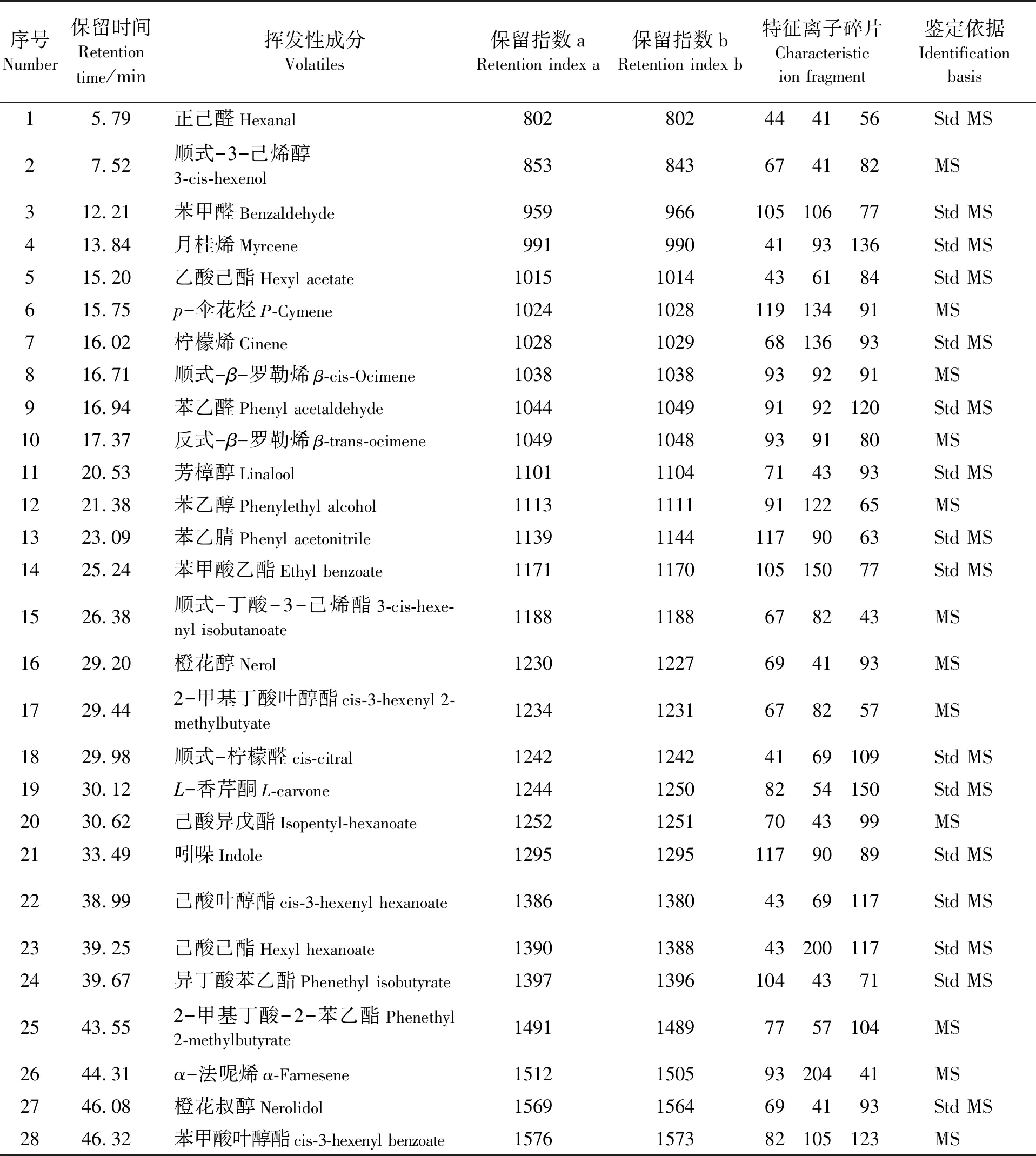
序号Number保留时间Retentiontime/min挥发性成分Volatiles保留指数aRetention index a保留指数bRetention index b特征离子碎片Characteristicion fragment鉴定依据Identificationbasis15.79正己醛Hexanal802802444156Std MS27.52顺式-3-己烯醇3-cis-hexenol853843674182MS312.21苯甲醛Benzaldehyde95996610510677Std MS413.84月桂烯Myrcene9919904193136Std MS515.20乙酸己酯Hexyl acetate10151014436184Std MS615.75p-伞花烃P-Cymene1024102811913491MS716.02柠檬烯Cinene102810296813693Std MS816.71顺式-β-罗勒烯β-cis-Ocimene10381038939291MS916.94苯乙醛Phenyl acetaldehyde104410499192120Std MS1017.37反式-β-罗勒烯β-trans-ocimene10491048939180MS1120.53芳樟醇Linalool11011104714393Std MS1221.38苯乙醇Phenylethyl alcohol111311119112265MS1323.09苯乙腈Phenyl acetonitrile113911441179063Std MS1425.24苯甲酸乙酯Ethyl benzoate1171117010515077Std MS1526.38顺式-丁酸-3-己烯酯3-cis-hexe-nyl isobutanoate11881188678243MS1629.20橙花醇Nerol12301227694193MS1729.442-甲基丁酸叶醇酯cis-3-hexenyl 2-methylbutyate12341231678257MS1829.98顺式-柠檬醛cis-citral124212424169109Std MS1930.12L-香芹酮L-carvone124412508254150Std MS2030.62己酸异戊酯Isopentyl-hexanoate12521251704399MS2133.49吲哚Indole129512951179089Std MS2238.99己酸叶醇酯cis-3-hexenyl hexanoate138613804369117Std MS2339.25己酸己酯Hexyl hexanoate1390138843200117Std MS2439.67异丁酸苯乙酯Phenethyl isobutyrate139713961044371Std MS2543.552-甲基丁酸-2-苯乙酯Phenethyl 2-methylbutyrate149114897757104MS2644.31α-法呢烯α-Farnesene151215059320441MS2746.08橙花叔醇Nerolidol15691564694193Std MS2846.32苯甲酸叶醇酯cis-3-hexenyl benzoate1576157382105123MS
说明:保留指数为Rtx-5MS色谱柱结果;保留指数a为本研究得到的数值,保留指数b为文献报道的数值;Std为标准品定性,MS为质谱库检索结果,文献报道的保留指数均来源于网站(http://webbook.nist.gov/chemistry)。
Notes:The retention index is the result of Ttx-5MS;the retention index a is the value obtained in this study;the retention index b is the value reported in the literature;Std is the standard qualitative;MS is the mass spectral library search result,and the retention index of the literature is derived from the website(http://webbook.nist.gov/chemistry).
2.2 挥发性成分的定量分析
由表2可知,乌龙茶水溶液、PDA酶处理组、察氏粗酶处理组、果胶粗酶处理组、麦麸粗酶处理组和柚皮粗酶处理组分别鉴定出25,26,26,27,28和27种挥发性成分。
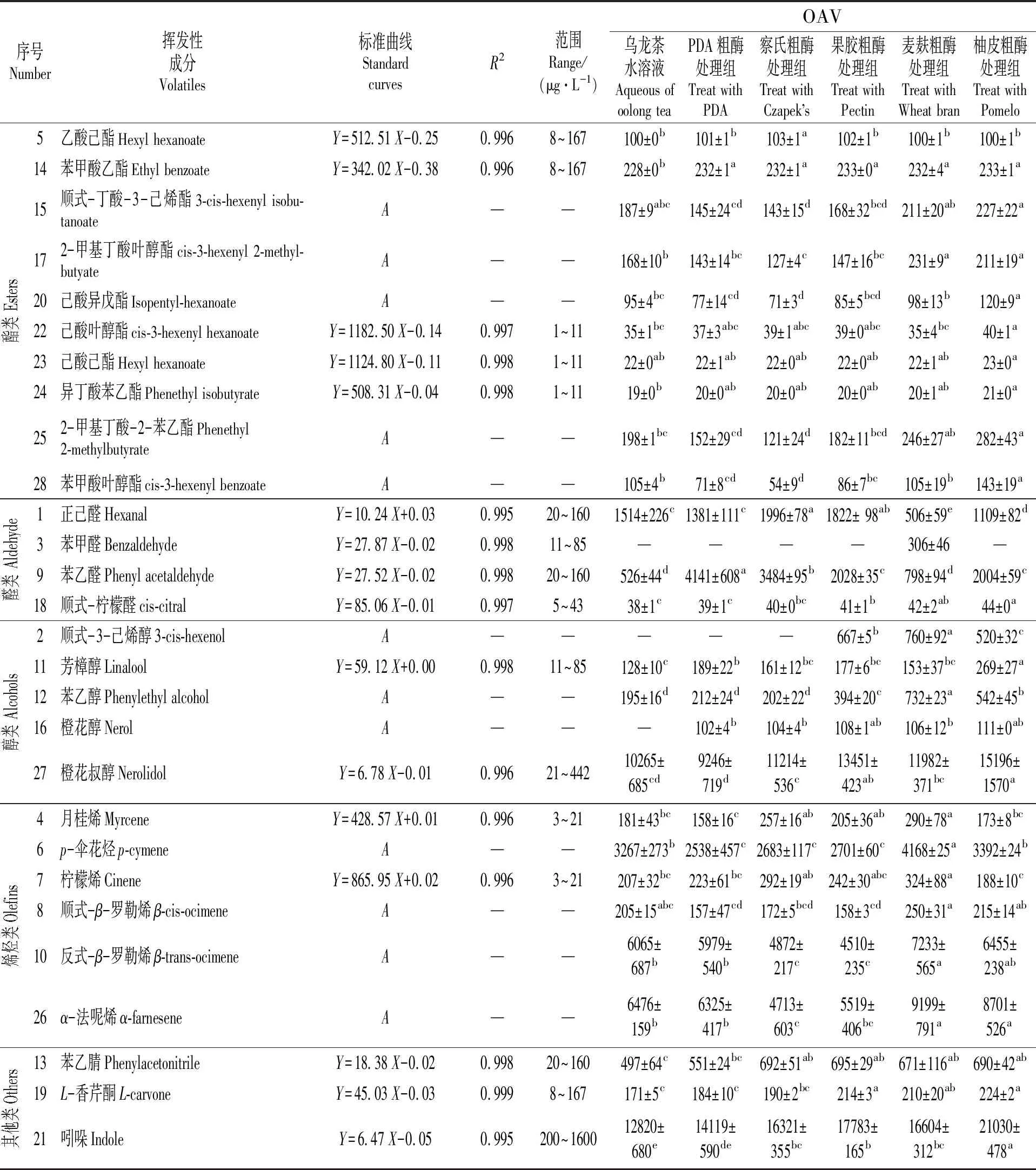
表2 黑曲霉粗酶液处理乌龙茶水溶液的挥发性成分定量分析结果
说明:该序号为定性表中对应的序号;A为采用内标法进行定量;每一行中,不同的字母(a,b,c,d,e)代表数值间存在着显著性差异(P<0.05)。
Notes:The serial number is the corresponding serial number in the qualitative table;A is quantified by the internal standard method;different letters(a,b,c,d,e)represent significant.
对于酯类物质,乌龙茶水溶液中含量较高的(≥100 μg/kg)为乙酸己酯、苯甲酸乙酯、顺式-丁酸-3-己烯酯、2-甲基丁酸叶醇酯、2-甲基丁酸-2-苯乙酯和苯甲酸叶醇酯。与乌龙茶水溶液相比,麦麸粗酶处理组酯类物质中的顺式-丁酸-3-己烯酯和2-甲基丁酸叶醇酯含量分别增加了24 μg/kg和63 μg/kg;柚皮粗酶处理组中的顺式-丁酸-3-己烯酯、2-甲基丁酸叶醇酯、己酸异戊酯、2-甲基丁酸-2-苯乙酯和苯甲酸叶醇酯含量均显著增加。茶叶中酯类是由于脂氧合酶介导脂质氧化而产生的[8],这表明在麦麸粗酶和柚皮粗酶中可能存在脂氧合酶。
乌龙茶水溶液中醛类物质含量较高的(>500 μg/kg)为正己醛和苯乙醛。与乌龙茶水溶液相比,察氏粗酶处理组和果胶粗酶处理组醛类物质中的正己醛含量分别增加了482和308 μg/kg,且5种粗酶处理后苯乙醛含量均显著增加。此外,在麦麸粗酶处理组中增加了苯甲醛。相关研究[19]发现,茶叶中存在香气化合物的单糖苷和二糖苷类前体,并已知苯甲醛的糖苷前体为野黑樱苷(β-D-苯乙腈葡萄糖苷)。同时,相关研究[18,20]表明,β-葡萄糖苷酶和黑曲霉胞外酶液处理速溶乌龙茶粉后,苯甲醛、苯乙醛和香叶醇含量显著增加。本研究结果与相关文献对比说明,不同培养基制得的粗酶液中含有不同种类糖苷酶水解酶。
乌龙茶水溶液中醇类物质含量较高的(>100 μg/kg)为芳樟醇、苯乙醇和橙花叔醇。与之对比,柚皮粗酶处理组中芳樟醇和橙花叔醇的含量分别增加了141和4931 μg/kg;麦麸粗酶处理组中苯乙醇含量增加了537 μg/kg;果胶粗酶处理组、麦麸粗酶处理组和柚皮粗酶处理组中新增了顺式-3-己烯醇化合物。此外,5种粗酶液处理都可以产生橙花醇化合物。相关文献[20]报道,苯乙醇的前体为β-樱草糖苷类物质,顺式-3-己烯醇的前体为β-葡萄糖苷和β-樱草糖苷,橙花醇的前体为β-樱草糖苷。这些研究表明,黑曲霉发酵粗酶液中可能含有β-葡萄糖苷酶和β-樱草糖苷酶。
乌龙茶水溶液中烯烃类物质含量较高的(>3000 μg/kg)为p-伞花烃、反式-β-罗勒烯和α-法呢烯,其中α-法呢烯是乌龙茶叶中含量较高的烯烃,这与文献报道一致[2]。与乌龙茶水溶液相比,麦麸粗酶处理组和柚皮粗酶处理组中,α-法呢烯的含量分别增加了2723和2225 μg/kg。已有研究表明[2],漆酶和α-半乳糖苷酶处理乌龙茶叶能显著增加α-法呢烯的含量,这表明麦麸粗酶和柚皮粗酶中可能含有漆酶和α-半乳糖苷酶。
此外,乌龙茶水溶液中含量较高的还有吲哚(12 820 μg/kg),该结果与Lin等[21]发现乌龙茶叶具有较高含量的α-法呢烯、橙花叔醇和吲哚的结果相似。
2.3 挥发性成分的OAV分析
参考相关文献报道的香气阈值[10,22-24],计算乌龙茶水溶液及黑曲霉粗酶处理后的样品中挥发性成分的OAV值,结果见表3。由表3可知,乌龙茶水溶液、PDA粗酶、察氏粗酶、果胶粗酶、麦麸粗酶和柚皮粗酶处理组中香气化合物的总OAV分别为101.0,130.8,138.1,132.1,115.6,142.9,表明黑曲霉粗酶处理乌龙茶水溶液能明显增加总香气强度。此外,由图2和表3可知,醛类、醇类和烯烃类物质是乌龙茶水溶液的重要香气贡献成分,该结果与以往报道乌龙茶中主要香气化合物为醇类和醛类是相似的[25]。
醛类中,正己醛(OAV=10.1,青草香)和苯乙醛(OAV=5.6,甜香)对乌龙茶水溶液的香气具有影响。与乌龙茶水溶液相比,在察氏粗酶和果胶粗酶处理组中,正己醛(察氏粗酶处理组OAV=13.3,果胶粗酶处理组OAV=12.1)的OAV均有增加;在PDA粗酶、察氏粗酶、果胶粗酶、麦麸粗酶和柚皮粗酶处理组中,苯乙醛(PDA粗酶处理组OAV=43.8,察氏粗酶处理组OAV=36.9,果胶粗酶处理组OAV=21.5,麦麸粗酶处理组OAV=8.4,柚皮粗酶处理组OAV=21.2)的OAV也是明显增加。表明黑曲霉粗酶处理可增加正己醛、苯乙醛的香气强度值,这两种成分主要与青草香和甜香有关。因此,本研究与相关文献[9]报道的PDA培养基发酵的黑曲霉胞外酶液处理绿茶粉后减弱了青草香和花香是不一致的,其主要原因可能是乌龙茶和绿茶粉的香气特征及其中存在的香气前体的差异。
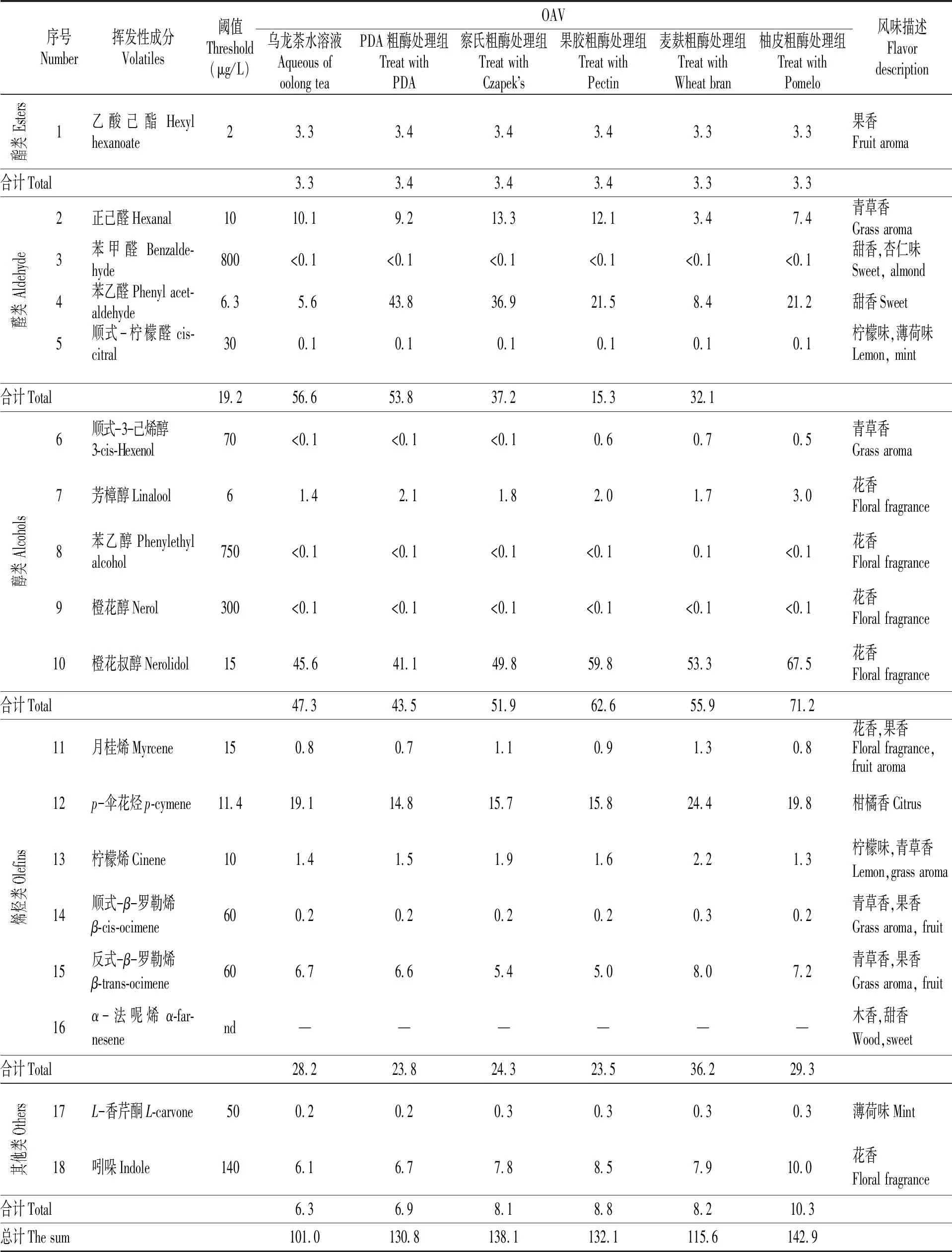
表3 黑曲霉粗酶液处理乌龙茶水溶液的挥发性成分OAV分析
说明:nd表示文献中未报道该化合物的阈值。
Notes:nd indicates that the threshold of the compound is not reported in the literature.
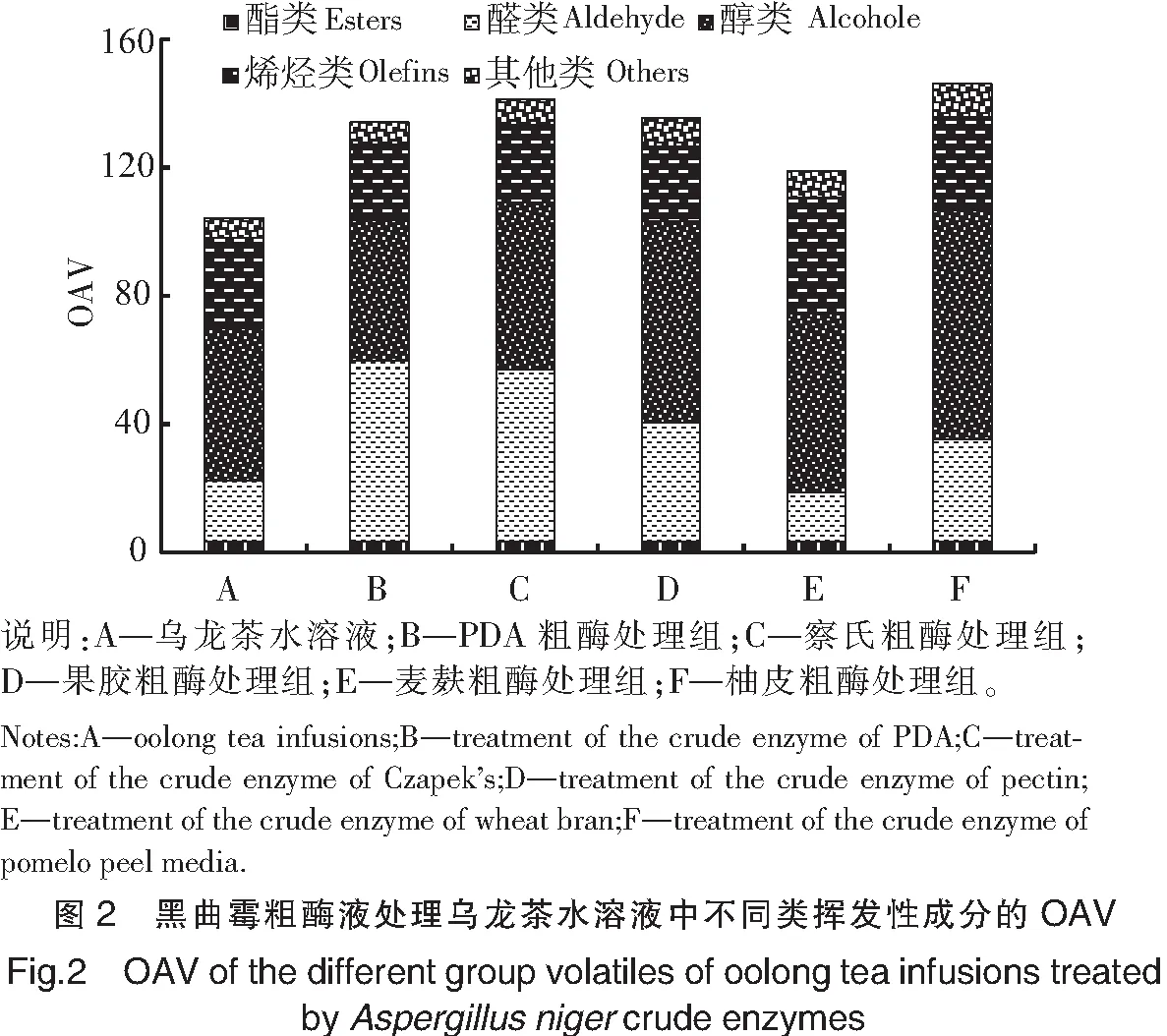
醇类中,芳樟醇(OAV=1.4,花香)和橙花叔醇(OAV=45.6,花香)对乌龙茶水溶液香气具有重要影响。PDA粗酶、果胶粗酶和柚皮粗酶处理组芳樟醇的OAV分别为2.1,2.0,3.0,与乌龙茶水溶液相比明显增加;在察氏粗酶、果胶粗酶、麦麸粗酶和柚皮粗酶处理组中,橙花叔醇的OAV分别为49.8,59.8,53.3和67.5,与乌龙茶水溶液相比增加明显。芳樟醇和橙花叔醇主要呈现出花香气味。因此,黑曲霉粗酶处理后这两种醇类物质OAV的增加与相关研究[9]茶梗培养基发酵黑曲霉胞外酶液能显著增加绿茶水溶液花香味的结果相一致。
烯烃类中,p-伞花烃(OAV=19.1,柑橘香)和反式-β-罗勒烯(OAV=6.7,青草香,果香)对乌龙茶水溶液香气具有重要影响。在麦麸粗酶和柚皮粗酶处理组中,p-伞花烃的OAV分别为24.4和19.8,反式-β-罗勒烯的OAV分别为8.0和7.2,与乌龙茶水溶液相比增加明显。该结果与前人研究[20]发现β-葡萄糖苷酶显著增加乌龙茶水溶液的顺式-β-罗勒烯和反式-β-罗勒烯的OAVs值是相似的。
3 结论
从黑曲霉粗酶液处理前后的乌龙茶水溶液中共鉴定出28种挥发性化合物,其中,正己醛、橙花叔醇、p-伞花烃、反式-β-罗勒烯、α-法呢烯和吲哚是乌龙茶水溶液中含量较高的挥发性成分;且正己醛(OAV=10.1,青草香)、苯乙醛(OAV=5.6,甜香)、橙花叔醇(OAV=45.6,花香)、p-伞花烃(OAV=19.1,柑橘香)和反式-β-罗勒烯(OAV=6.7,青草香和果香)对乌龙茶水溶液香气具有重要影响。黑曲霉粗酶液处理乌龙茶水溶液后,正己醛、苯乙醛、苯乙醇、橙花叔醇、α-法呢烯、吲哚、橙花醇、苯甲醛和顺式-3-己烯醇的含量显著增加,且苯乙醛、芳樟醇、橙花叔醇和吲哚的OAVs显著增大。5种不同培养基发酵制备的粗酶处理后各成分含量及OAV值增大的规律不同。
