杂交鲍染色体GISH的优化
2019-09-02刘富江朱齐春张健鹏蔡明夷
刘富江,朱齐春,张健鹏,蔡明夷
(1.集美大学水产学院,福建 厦门 361021;2.农业农村部东海海水健康养殖重点实验室,福建 厦门 361021)
0 引言
鲍是我国传统的海珍品,是重要的海水养殖贝类。近年来,鲍的遗传育种研究发展迅速,其中杂交育种的成果最为突出。基于杂交,我国科研工作者已先后育成“大连1号”、“东优1号”和“西盘鲍”等品种,推动了我国鲍养殖产业的健康发展[1-3]。在鲍的杂交育种中,杂交后代的遗传分析是结果鉴定的重要内容,也是深入研究杂种优势机理的基础[4]。
基因组原位杂交(genomicinsituhybridization,GISH)是分析远缘杂交染色体组结构的有力工具。它以一个亲本的总DNA制备杂交探针,对染色体进行原位杂交,可以用不同颜色的荧光区别显示染色体的亲本来源[5]。目前 ,GISH已广泛应用于动植物远缘的杂交结果鉴定、异源多倍体识别,以及基因流与基因渗入检出等研究中[6-8]。在鲍的远缘杂交研究中,GISH也初步应用于杂交子代的染色体组成及其动态变化[9-11]。然而,前期研究结果显示,对于亲本亲缘关系较近的杂交鲍,利用GISH分辨父母本染色体的难度仍然较高,较难得到稳定结果[11]。因此,本文拟以皱纹盘鲍(Haliotisdiscushannai)和杂色鲍(H.diversicolor)杂交子代为研究对象,分析杂交缓冲液中探针、封阻DNA、去离子甲酰胺(dFA)、硫酸葡聚糖(DS)或聚乙二醇(PEG)6000的含量对GISH信号强度的影响,为提高杂交鲍染色体GISH的灵敏度与稳定性,也可为其他探针的荧光原位杂交(FISH)提供借鉴。
1 材料与方法
1.1 样品采集
实验所用杂色鲍足部肌肉组织采自福建省晋江福大鲍鱼水产有限公司,固定于无水乙醇中-20 ℃保存。取性腺成熟的雌性杂色鲍和雄性皱纹盘鲍,采用阴干、流水刺激和经过紫外照射的海水刺激等手段催产,获得杂色鲍卵子与皱纹盘鲍精子。按蔡明夷等描述的方法获得杂色鲍×皱纹盘鲍的杂交鲍幼体[12]。杂交鲍幼体在秋水仙素液体中培养后经低渗、固定等处理,然后置于-20 ℃保存[13]。
1.2 GISH探针和封阻DNA的制备
用杂色鲍足部肌肉组织提取DNA,具体操作参照血液/细胞/组织基因组DNA提取试剂盒(天根生化有限公司)说明书。采用切口平移法制备生物素标记的杂色鲍基因组DNA探针,操作方法参考试剂盒说明书(Roche)。将鲑精DNA(厦门海琪生物技术有限公司)用高压灭菌剪切法剪切成合适片段(100~200 bp)。用1%琼脂糖凝胶电泳检测探针和封阻DNA的质量。将符合要求的探针和鲑精DNA混合后采用乙醇沉淀法进行纯化,再用不同体积的TE缓冲液溶解沉淀,-20 ℃保存备用。
1.3 染色体制片的准备
取杂交鲍担轮幼体,采用蒸汽滴片法进行染色体制片,具体操作方法参考蔡明夷等[13]的描述,滴好的制片经空气干燥后于60 ℃恒温箱中老化30 min。
1.4 基因组荧光原位杂交
GISH的一般程序包括探针变性、染色体制片变性、杂交、杂交后洗涤和信号放大等5个步骤,操作程序与蔡明夷等[13]的FISH方法描述相同。除特殊说明外,研究所用杂交缓冲液各成分组成为:30%(体积分数)dFA、10%(体积分数)2×SSC、12.5%(体积分数)DS、6.25 ng/μL探针、62.5 ng/μL鲑精DNA。杂色鲍探针杂交信号预期显示为绿色荧光。
1)探针含量试验 各试验组探针的终质量浓度分别为1.56 ng/μL、3.13 ng/μL、6.25 ng/μL、12.50 ng/μL、25.00 ng/μL。
2)鲑精DNA含量试验 各试验组鲑精DNA的质量浓度分别为探针的0倍(0 ng/μL)、5倍(31.3 ng/μL)、10倍(62.5 ng/μL)、20倍(125.0 ng/μL)、40倍(250.0 ng/μL)。
3)dFA含量试验 各试验组杂交缓冲液中dFA的体积分数分别为10%、20%、30%、40%和50%。
4)DS含量试验 各试验组DS的体积分数分别为2.5%、7.5%、12.5%、17.5%、25.0%。
5)PEG6000替代DS试验 用PEG6000替代杂交缓冲液中的DS,各试验组PEG6000的体积分数分别为2.5%、7.5%、12.5%、17.5%、25.0%。
1.5 显微观察、测量与数据处理
在荧光显微镜下,用固定条件拍照,获取分散良好、形态清晰且数目完整的杂交鲍的中期分裂相。每个试验选取5个分裂相,利用Image-pro plus 6.0软件测量有阳性信号(绿色荧光)染色体的平均荧光强度,计算平均值与标准差,并作折线图。用SPSS 21.0作单因素方差分析。
2 实验结果
2.1 探针含量对杂交信号的影响
探针含量单因素试验中,在其不同质量浓度下的GISH图像如图1a~图1e所示,其中绿色荧光为杂色鲍探针杂交信号,红色为负染的PI信号。

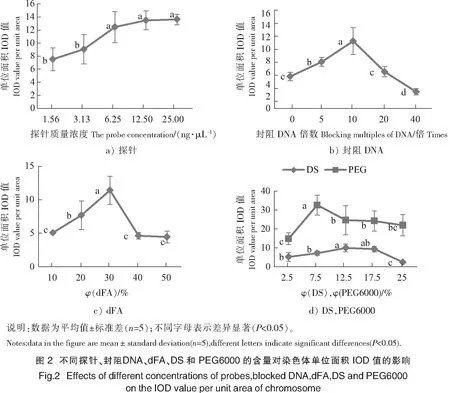
当探针质量浓度为1.56 ng/μL(见图1a)和3.13 ng/μL(见图1b)时,杂交信号均较弱,不能明显区分杂交子代中染色体的亲本来源。当探针质量浓度高于6.25 ng/μL时,杂交信号强,染色体亲本来源明显区别为红绿两色。定量分析结果表明:当探针质量浓度从1.56 ng/μL增加至6.25 ng/μL时,靶染色体的平均荧光强度由(7.53±1.76)上升至(12.46±2.38);当探针质量浓度从6.25 ng/μL增加至25.00 ng/μL时,染色体平均荧光强度依然有所增强,但是增强趋势已趋于平缓,平均值间的差异不显著(P>0.05,见图2a)。
2.2 封阻DNA含量对杂交信号的影响
封阻DNA含量单因素试验中,在其不同质量浓度下的GISH图像如图1f~图1j所示,其中绿色荧光为杂色鲍探针杂交信号,红色为负染的PI信号。各试验组间均可明显区别染色体亲本来源,当鲑精DNA质量浓度为探针10倍时信号最强。定量分析结果表明:当封阻DNA质量浓度由0倍增加至10倍过程中,靶染色体的平均荧光强度由(5.41±0.71)逐渐增强到(11.39±2.28);当封阻DNA质量浓度由10倍增加至40倍过程中,荧光强度又逐步减弱至(2.81±0.55),各处理水平间荧光强度差异显著(P<0.05,见图2b)。
2.3 dFA含量对杂交信号的影响
dFA含量单因素试验中,在其不同体积分数下的GISH图像如图1k~图1o所示,其中绿色荧光为杂色鲍探针杂交信号,红色为负染的PI信号。当dFA体积分数为30%时,染色体亲本来源的区分度最明显,探针杂交信号涂布的完整性最好(见图1m);当dFA体积分数高于40%时,探针杂交的涂布均一性变差,杂交信号只出现于某些异染色质区域,无法明确区分染色体的亲本来源(见图1n,图1o)。定量分析结果表明:当dFA体积分数由10%增至30%时,靶染色体的平均荧光强度由(5.07±0.15)逐渐增强到(11.40±2.09);而当dFA体积分数由30%增至40%,靶染色体的平均荧光强度度急剧变弱至(4.63±0.49)(见图2c)。
2.4 DS或PEG6000含量对杂交信号的影响
DS含量单因素试验中,在其不同体积分数下的GISH图像如图1p~图1t所示,其中绿色荧光为杂色鲍探针杂交信号,红色为负染的PI信号。结果直观显示,DS体积分数为12.5%和17.5%时信号最强,涂布均匀,亲本来源区分度较高(见图1q,图1s)。定量分析结果表明:DS试剂的体积分数由2.5%增加至12.5%的过程中,靶染色体的平均荧光强度由(5.25±2.41)逐渐增强到(9.96±2.05);当其体积分数由12.5%增加至17.5%时荧光强度略略下降;当其体积分数由17.5%增加至25.0%时,荧光强度骤减至(2.45±0.80)(见图2d)。
在PEG6000不同体积分数下的GISH图像如图1p~图1y所示,其中绿色荧光为杂色鲍探针杂交信号,红色为负染的PI信号。图像显示:7.5% PEG6000荧光信号极强,但亲本来源区分度并不高(见图2v)。定量分析结果表明:当PEG6000的体积分数由2.5%增加至7.5%时,染色体单位面积上的荧光强度由(14.91±3.13)剧增到(32.65±5.31);当PEG6000的体积分数继续增加至12.5%,荧光强度反而减弱到(24.7±7.71),并随着PEG6000的体积分数继续增加而略微下降,但差异不显著(P>0.05,见图2d)。
DS和PEG6000两组试验结果比较说明,使用PEG6000组荧光强度明显高于用DS组。
3 讨论
3.1 探针含量的影响
核酸杂交的反应速度与溶液中参与杂交的互补链核苷酸质量浓度的乘积成正比[14]。染色体GISH中,染色体制片上固定的DNA量基本稳定,因此探针质量浓度是影响核酸杂交效率的关键因素[15]。本研究结果显示,当探针的质量浓度为1.56 ng/μL时,GISH信号强度微弱,且对异源染色体的区分度差;随探针的质量浓度的升高,信号强度和染色体区分度均相应提高;当探针的质量浓度升高到6.25 ng/μL时荧光强度达到平台,但继续提高探针的质量浓度也不再显著提升GISH信号强度。可见,杂交鲍GISH试验中,探针的质量浓度应大于6.25 ng/μL。综合考虑试验的成本控制和稳定性,本研究建议杂交鲍的GISH探针用量为6.25 ng/μL。
不同研究所使用探针的质量浓度并不相同。Bi等[16]在运用GISH鉴定两种异源三倍体蝾螈(A.laterale-2jeffersonianum,A.2laterale-jeffersonianum)的核基因组成中所使用的蓝点钝口螈(A.laterale)基因组探针的质量浓度为5 ng/μL 。Sczepanski等[17]在运用FISH研究两种海洋鲶鱼(Genidensgenidens,Aspistorluniscutis)细胞分类和核型进化中所使用银色鲮脂鲤(Prochilodusargenteus)18S rDNA探针的质量浓度为2.5 ng/μL。Jowett[18]用双色FISH研究斑马鱼(Barchydanioreriovar)胚胎基因表达模式时所使用的反义探针的质量浓度为0.5 ng/μL。Zhang等[19]在运用FISH研究栉孔扇贝(Chlamysfarreri)的染色体定位与鉴定中所使用的Fosmid DNA探针的质量浓度为10 ng/μL。探针种类、染色体结构差异、探针标记效率、杂交后洗涤严谨度等因素均可能影响探针检出下限,导致GISH试验信号太弱甚至无法检出。因此,不同实验室在进行荧光原位杂交实验时,有必要结合自身条件优化探针使用的质量浓度。
3.2 鲑精DNA含量的影响
在杂交缓冲液中加入鲑精DNA的目的是封闭普遍同源性的重复序列,以此降低非特异杂交信号[20-21]。Mukai等[22]通过加入鲑精DNA,在小麦背景下成功检测到大麦染色体。本研究结果显示,最佳的鲑精DNA的质量浓度约为探针质量浓度的10倍,过高或过低均会显著影响GISH信号强度和异源染色体的区分度。可能的原因是质量浓度过低不足以封闭同源序列造成微小的跨基因组杂交,质量浓度过高会影响探针在整个目标染色体长度上的均匀杂交。
不同研究中,鲑精DNA的使用量有所差异。Hu等[23]在运用GISH研究紫扇贝(Argopectenpurpuratus)和海湾扇贝(A.irradiansirradians)杂交种基因组时所用鲑精DNA的质量浓度为探针的100倍。Bi等[24]在运用GISH研究蝾螈(Ambystoma(Amphibia:Caudata))的基因组交换减数分裂机制时所用鲑精DNA的质量浓度为探针的100倍。Rampin等[25]在运用GISH研究鲤科鱼杂交(Squaliusalburnoidescomplex)的亲本染色体和基因组重排时所用鲑精DNA的质量浓度为探针的25倍。即在不同研究中,鲑精DNA质量浓度的使用范围为探针的25~100倍。鲑精DNA的适宜用量的差异可能与研究对象的基因组结构不同有关。
3.3 dFA含量的影响
变性的探针和染色体DNA的复性是荧光原位杂交的关键步骤。已有研究证明,特定DNA复性的适宜温度约为Tm-25℃[26]。然而,为了避免长时间高温孵育破坏染色体形态,探针与靶序列的复性通常在37℃中完成[27]。因此,研究人员一般在杂交缓冲液中添加适量dFA来调整DNA的Tm,以降低复性温度[28]。目前已知,dFA的体积分数每提高1%,溶液中DNA的Tm约下降0.60~0.73℃[29]。本文研究了杂交缓冲液中dFA的体积分数对杂交鲍幼体GISH信号的影响。结果显示,GISH信号强度相对dFA体积分数的变化曲线为单峰曲线,峰值对应的dFA体积分数为30%(见图1c);dFA体积分数过高或过低均会同时导致杂交信号强度和均一性的下降(见图2k~图2o)。这一曲线的特征与Mcconaughy[28]在研究dFA体积分数对膜结合枯草芽孢杆菌DNA杂交效率的影响所得的结果相符。可见,杂交缓冲液中dFA的含量高低是影响分子杂交效率的重要因素,其含量过低或过高均会严重影响杂交信号的强度与均匀性。
不同研究报道中,杂交缓冲液中dFA的含量可能不同。例如,Barranger等[30]在运用rDNA基因(5S rRNA,18-5.8-28S rRNA)做探针,用胚胎细胞核染色体制片的FISH,研究太平洋牡蛎(Crassostreagigas)的胚胎染色体受敌草隆胁迫而导致非整倍性时所用的dFA的体积分数为50%;Rampin等[25]在用S.alburnoides的AA基因组做探针,用S.alburnoides的二倍体和三倍体细胞悬液制片的GISH研究鲤科杂交鱼(Squaliusalburnoidescomplex)的亲本染色体和基因组重排,其所用的dFA的体积分数为75%;Bi等[24]用蓝点钝口螈(A.laterale)基因组做探针,用火蜥蜴(Salamandrasalamandra)卵母细胞做染色体制片的GISH,研究蝾螈的基因组交换减数分裂机制,其所用的dFA的体积分数为50%。本研究结果显示,杂交鲍GISH中dFA的适宜体积分数约为30%,低于多数研究报道。DNA的Tm值受GC含量、长度、复杂性、构像等因素的影响,也受缓冲液中变性剂种类和含量、一价阳离子浓度、pH等因素的影响[31-32],这些都可能导致dFA的适宜含量的变化。因此,在GISH试验中出现杂交信号太弱或不均匀的问题时,在保证探针含量充分的前提下,需检查杂交缓冲液中dFA的含量是否适宜。
3.4 DS或PEG6000含量的影响
在核酸杂交中,常常在杂交缓冲液中加入适量DS以促进杂交速度[14]。DS是一种大分子多聚化合物,具有极强的水合作用。它在杂交缓冲液中的作用可以归纳为两点:一是,增加探针含量;二是,增加溶液的粘稠度[33]。本研究结果显示,杂交鲍GISH杂交缓冲液中DS最适宜的体积分数约为12.5%。其体积分数太低,探针浓缩不充分;其体积分数太高,溶液过于粘稠,导致分子扩散速度降低。因此,其体积分数太低或太高均会影响杂交效率。不同研究中DS的使用量差别不大。Bi等[24]在利用GISH研究蝾螈的基因组交换减数分裂机制时,所用的DS的体积分数为10%;Yang等[34]在利用FISH研究虾夷扇贝(Patinopectenyessoensis)免疫相关基因定位时,Feng等[35]在用FISH研究栉孔扇贝(Chlamysfarreri)微卫星标记的细胞遗传图谱时,他们所用的DS的体积分数都为10%;Rampin等[25]在利用GISH研究鱼类(Squaliusalburnoidescomplex)的亲本染色体和基因组重排时,Boonanuntanasarn等[36]在利用FISH研究石斑鱼(Epinephelusfuscoguttatus)vasa基因表达时,他们所用的DS的体积分数都为10%。可见,与其他因素相比,杂交缓冲液中DS含量的作用相对独立且相对稳定,在不同的研究中无需特别优化。然而值得注意的是,DS液体比较粘稠,精确量取较困难,在配液中要注意准确量取。
Amasino[37]在Southern杂交中用PEG6000替代核酸杂交缓冲液中的DS,发现PEG6000具有信号强、粘度低和价格低等优势。因此,本研究尝试用PEG6000替代GISH杂交缓冲液中的DS。结果显示,PEG6000组的信号强度总体高于DS组,适宜的体积分数为7.5%。但研究结果也显示,PEG6000组存在杂交信号不稳定、信号噪点多、制片标本易“掉片”等问题。
4 结论
本文提出一种染色体荧光强度定量测量方法,并利用该方法研究了杂交缓冲液中探针深度、鲑精DNA用量、DS含量对杂盘杂交鲍染色体GISH信号的影响,同时尝试用PEG6000替换缓冲液中的DS。研究结果为提高杂交鲍GISH的分辨率提供了依据,也为其他FISH相关研究提供了借鉴。
