象草与皇竹草不同比例组合对山羊瘤胃体外发酵特性的影响
2019-09-02吴征敏凡超杰李龙文杨善雄王志敬吴浩浩赵志辉尹福泉
吴征敏,凡超杰,李龙文,杨善雄,刘 娟,王志敬,吴浩浩,赵志辉,尹福泉
(1. 广东海洋大学农学院,广东 湛江 524088;2. 广东省清远市农业局 / 动物疾病预防控制中心,广东 清远 511515)
不同种类牧草之间存在着特异性,这种特异性可影响牧草的营养品质,进而影响动物的生长性能。在生产实践中人们利用这种特异性,将不同种类牧草混合饲喂反刍动物,可达到均衡饲粮营养的目的[1]。不同的饲粮组合,当饲粮间的整体互作使饲粮内某些养分的消化率不等于组成该饲粮的各饲料消化率加权值时,说明不同饲粮间产生了组合效应[2]。李妍等[3]通过体外产气法评价玉米秸秆、稻草和玉米秸秆青贮饲料组合效应研究表明,当玉米秸秆与谷草以60∶40组合时,可提高营养物质利用率和瘤胃挥发性脂肪酸的浓度;韩肖敏等[4]研究表明,玉米秸秆与稻草以60∶40比例组合时有助于瘤胃微生物的生长,提高干物质降解率及产气量等;张亚格等[5]研究表明,在皇竹草(Pennisetum sinese)中添加适宜比例的柱花草(Stylosanthes guianensiasSW)能够提高体外发酵产气量、菌体蛋白浓度和瘤胃微生物活性,产生正组合效应等。
我国南方热带亚热带地区,高温多雨同期,适合各种植物生长,象草(Pennisetum purpureum)与皇竹草则为最为普遍种植的牧草。象草(PP)是禾本科黍族多年生丛生大型草本植物,又称狼尾草;皇竹草(PS)为多年生禾本科植物,又称粮皇竹、王草。象草和皇竹草因质优、高产、营养价值高等而被南方地区广泛种植[6]。本研究以象草与皇竹草不同比例组合物作为体外发酵底料,探讨象草与皇竹草不同比例组合对雷州山羊瘤胃体外发酵特性的影响,筛选出最佳组合比例,为指导南方饲料配合奠定理论基础。
1 材料与方法
1.1 试验设计
试验将象草与皇竹草按干物质比100∶0、75∶25、 50∶50、 25∶75和 0∶100分 为 T1、 T2、 T3、T4和T5五组,分别培养4、8、12、24和48 h,每组设置3个重复,每个时间点设3个空白对照。培养结束后终止产气瓶微生物活动,测定发酵滤渣及发酵液的各项指标,并计算各项指标的组合效应值。原料及组合后化学组成如表1所列。
1.2 试验材料
象草和皇竹草取自广东海洋大学后山牧草基地,于10月份收割(留茬30~50 cm),斩碎后放于烘箱烘干,经粉碎机粉碎后过孔径为0.069 mm筛保存备用。选取健康、体重接近(25.75 ± 0.78) kg的两只成年雷州山羊作为瘤胃液供体羊。
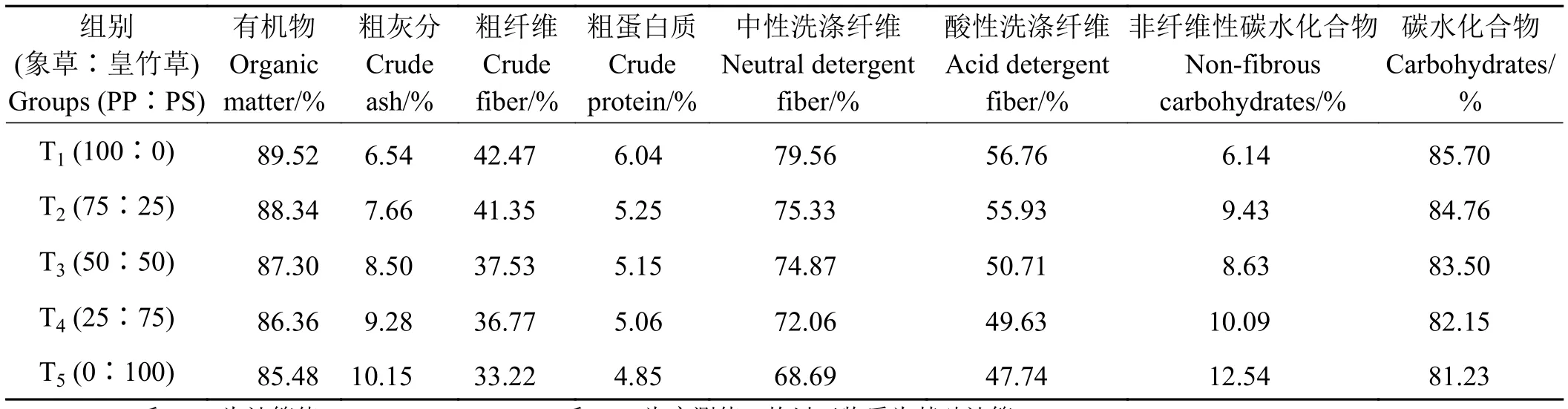
表1 试验原料化学组成Table 1 Chemical composition of test materials
1.3 发酵液的制备
1.3.1 人工唾液的配制
人工唾液参照Menke等[7]方法配制。
1.3.2 瘤胃液采集
晨饲前将雷州山羊颈静脉处死后,取瘤胃液放于保温瓶内立即带回实验室,置于(39.0 ± 0.5) ℃恒温水浴锅,用纱布过滤,滤液持续通入CO2。发酵液参照Mauricio等[8]方法配制。
1.4 体外培养
取70 mL发酵液加入到装有1.25 g左右样品,充满CO2且体积为200 mL的产气瓶内,封闭后放于(39.0 ± 0.5) ℃的恒温振荡培养箱内,分别培养4、8、12、24和48 h。空白对照组只添加70 mL发酵液。
1.5 样品收集与处理
培养结束后,将各时间点产气瓶取出,放入4 ℃冰箱终止微生物活动。静置后取2 mL上清液,加入0.4 mL 8.2%的偏磷酸溶液放于-20 ℃冰箱保存,用于挥发性脂肪酸的测定;用尼龙布过滤,滤渣用自来水冲洗干净后,于65 ℃烘箱烘24 h称重后放于-20 ℃冰箱保存待测。
1.6 指标测定与方法
采用AOAC[9]的常规方法测定发酵原料的干物质(dry matter, DM)、粗灰分(crude ash, Ash)、粗蛋白 (crude protein, CP)、粗纤维(crude fiber, CF);有机物(organic matter, OM)为干物质去除粗灰分部分;中性洗涤纤维(neutral detergent fiber, NDF)和酸性洗涤纤维(acid detergent fiber, ADF)含量采用范氏(Van Soest)纤维测定法测定;采用Agilent 6890气相色谱仪测得挥发性脂肪酸浓度[10]。
1.7 结果计算
1.7.1 养分降解率
养分降解率参考以下公式[1]计算。
某养分降解率 = [(试验原料中某养分含量 - 发酵后滤渣中某养分含量) / 试验原料中某养分的含量 ] × 100%。
1.7.2 组合效应值计算
组合效应值参考以下公式[1]计算。
单项组合效应值 = [(实测值 - 加权估计值) / 加权估计值] × 100%;实测值为实际测定样品消化率;加权估算值 = A样品实测值 × A样品配比 + B样品实测值 × B样品配比。∑
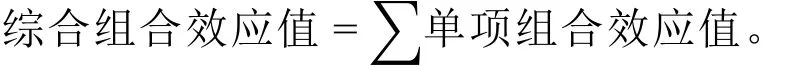
1.8 数据的处理
试验数据通过SPSS 20.0软件中的ANOVA模型进行单因素方差分析,采用LSD与Duncan氏法相结合进行统计分析,结果以“平均值 ± 标准差”表示,P< 0.05表示差异显著。
2 分析与结果
2.1 象草与皇竹草组合对山羊体外瘤胃有机物降解率的影响
象草与皇竹草组合对山羊体外瘤胃OMD产生了影响(表2)。在发酵4 h时,添加皇竹草T3、T5组山羊体外瘤胃有机物降解率显著高于单一象草T1组(P< 0.05);象草与皇竹草组合组T2、T3及T4,随皇竹草比例的增加OMD差异不显著(P> 0.05)。在体外发酵8 h时,组T3、T4和T5有机物降解率显著高于组 T1和 T2(P< 0.05);组 T3、T4及 T5之间差异不显著(P> 0.05)。在体外发酵12 h时,添加皇竹草T3、T4和T5组有机物降解率显著高于单一象草组T1(P< 0.05);随皇竹草组合比例的增加,组T2、T4和T5有机物降解率显著增大(P< 0.05),组T3和T4之间差异不显著(P> 0.05)。在体外发酵24 h时,添加皇竹草T3、T4和T5组有机物降解率显著高于单一象草组T1(P< 0.05);添加75%皇竹草T4组有机物降解率显著高于添加25%组T2和50%组T3(P< 0.05)。在体外发酵48 h时,添加皇竹草T3、T4和T5组有机物降解率显著高于单一象草组T1(P<0.05);添加75%皇竹草T4组与添加50% T3组之间有机物降解率差异不显著(P> 0.05),但显著高于添加25%组T2(P< 0.05)。在体外发酵12至48 h,随发酵时间的延长体外瘤胃有机物降解率显著增高 (P< 0.05)。
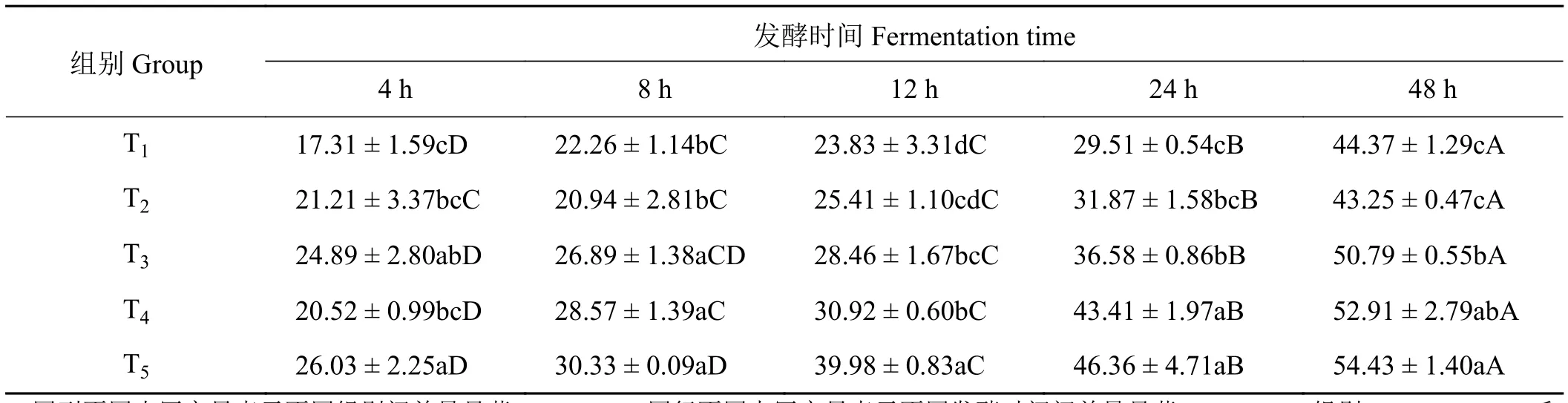
表2 象草与皇竹草组合对山羊体外瘤胃有机物降解率(OMD)的影响Table 2 Effects of Pennisetum purpureum and Pennisetum sinese combinations on the rumen OMD of goats in vitro%
2.2 体外瘤胃有机物降解率的组合效应
象草与皇竹草组合产生了组合效应(表3)。在体外发酵4 h时,添加25%和50%皇竹草组产生了正组合效应,组T3的组合效应值高于组T2,但差异不显著(P> 0.05)。在体外发酵8 h时,组T3和T4产生了正组合效应,但差异不显著(P> 0.05)。在发酵12 h时,象草与皇竹草组合均产生负组合效应。在发酵24 h时,添加75%皇竹草组产生正组合效应。在体外发酵48 h时,添加50%和75%皇竹草组产生正组合效应。
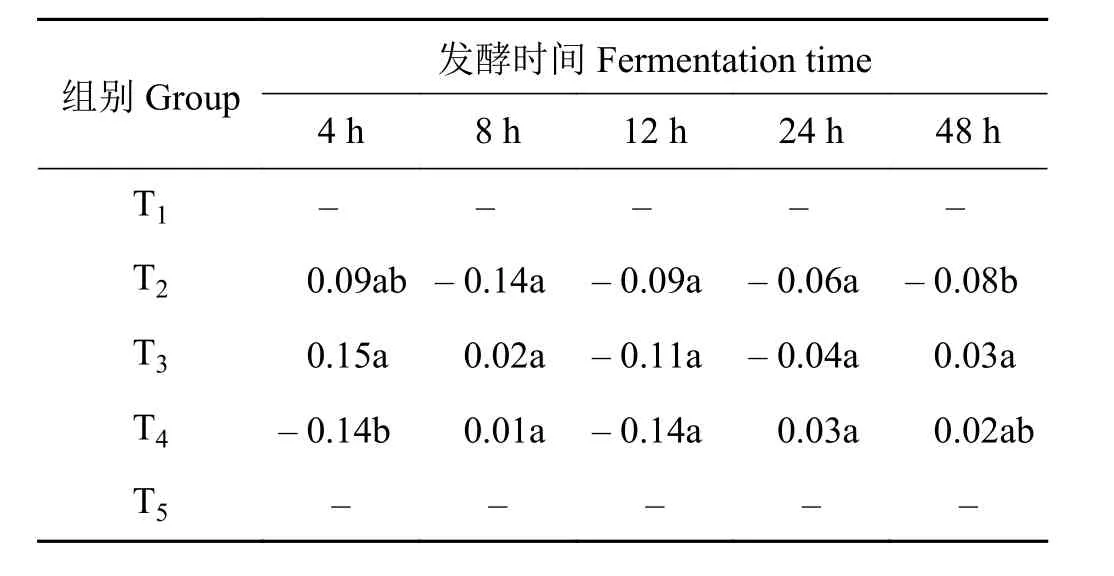
表3 象草与皇竹草组合对山羊体外瘤胃有机物降解率(OMD)的组合效应Table 3 Associative effect of Pennisetum purpureum and Pennisetum sinese on the rumen OMD of goats in vitro
2.3 象草与皇竹草组合对山羊体外瘤胃粗纤维降解率的影响
象草与皇竹草组合对山羊体外瘤胃粗纤维降解率产生了影响(表4)。在体外发酵4 h时,组T2与T3之间体外瘤胃粗纤维降解率差异不显著(P> 0.05),但都高于组T4(P< 0.05)。在体外发酵8 h时,添加75%皇竹草T4组体外瘤胃粗纤维降解率显著高于组T2和T3(P< 0.05);单一象草组T1与单一皇竹草组T5之间差异不显著(P> 0.05)。在体外发酵12 h时,各组之间体外瘤胃粗纤维降解率差异均不显著(P>0.05)。在体外发酵24 h时,随着皇竹草比例的增加,组T1、T3、T4及T5体外瘤胃粗纤维降解率逐渐增加,但各组之间差异均不显著(P> 0.05);添加75%皇竹草T4组粗纤维降解率分别较组T2和T3高16.77%和24.08%。在体外发酵48 h时,添加75%皇竹草T4组粗纤维降解率显著高于25%皇竹草 T2组 (P< 0.05),与组 T3之间差异不显著 (P>0.05)。在体外发酵12至48 h,随发酵时间的延长,瘤胃体外粗纤维降解率显著增高(P< 0.05)。
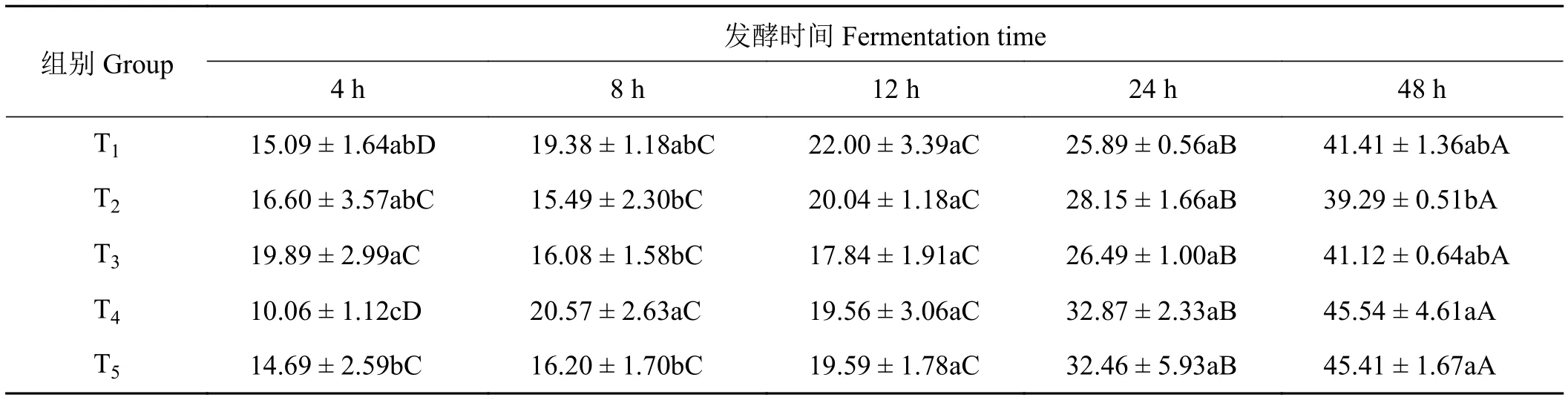
表4 象草与皇竹草组合对山羊体外瘤胃粗纤维降解率(CFD)的影响Table 4 Effect of Pennisetum purpureum and Pennisetum sinese combinations on the rumen CFD of goats in vitro%
2.4 体外瘤胃粗纤维降解率的组合效应
在体外发酵4 h时,添加25%、50%比例皇竹草组产生了正组合效应,组T2和T3的组合效应值差异不显著(P> 0.05),但显著高于组 T4(P< 0.05)(表5)。在体外发酵8 h时,添加75%比例皇竹草T4组产生正组合效应,且显著高于T2和T3组(P<0.05)。在体外发酵12 h时,象草与皇竹草组合均产生负组合效应且差异不显著(P> 0.05)。在体外发酵24 h时,添加25%、75%比例皇竹草组产生正组合效应,但T2与T4组的组合效应值差异不显著(P> 0.05)。在体外发酵48 h时,添加75%皇竹草T4组产生了正组合效应,25%、50%皇竹草组组产生负组合效应。
2.5 象草与皇竹草组合对山羊体外瘤胃乙酸浓度的影响
象草与皇竹草组合对山羊体外瘤胃乙酸的比例产生了影响(表6)。在体外发酵4、8、12和24 h时,单一象草T1组和添加50%皇竹草T3组的体外瘤胃乙酸比例显著高于添加皇竹草T2和T4组(P<0.05),T1与 T3组差异不显著 (P> 0.05);除在体外发酵4 h时,各时间点添加75%皇竹草T4组乙酸比例均显著低于其他处理组(P< 0.05)。在体外发酵48 h时,T1、T2、T3及T5组乙酸比例差异不显著(P> 0.05)。在整个发酵期,随发酵时间的延长,T3组乙酸比例呈下降趋势,T2、T4和T5组乙酸比例呈先下降后上升趋势。在体外发酵4至8 h,各组乙酸比例显著降低(P< 0.05);在体外发酵4至24 h,添加50%皇竹草T3组乙酸比例显著降低(P< 0.05)。
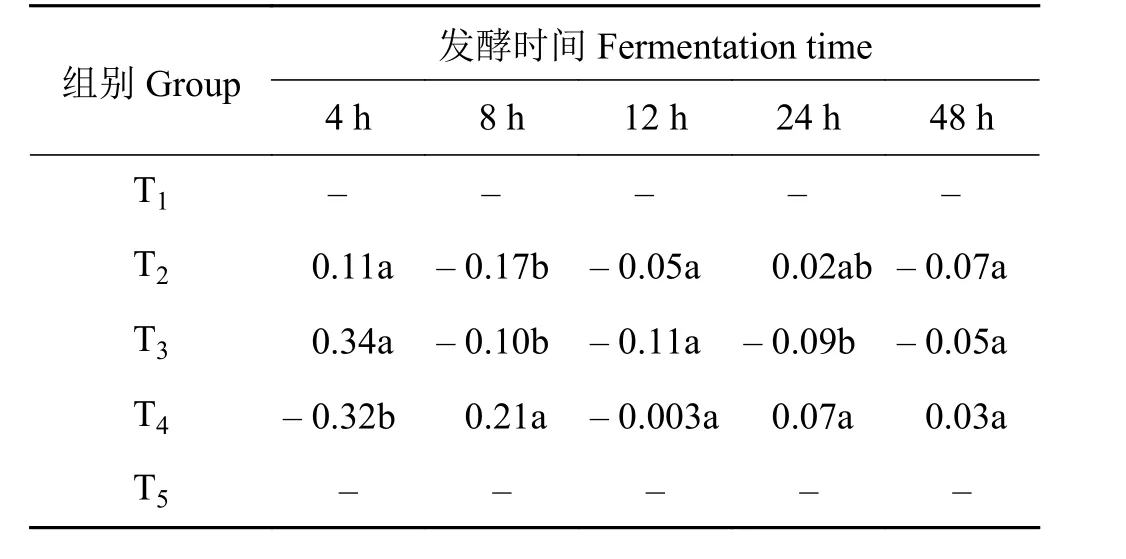
表5 象草与皇竹草对山羊体外瘤胃粗纤维降解率(CFD)的组合效应Table 5 Associative effect of Pennisetum purpureum and Pennisetum sinese on the rumen CFD of goats in vitro
2.6 山羊体外瘤胃乙酸浓度的组合效应
象草与皇竹草组合产生了组合效应(表7)。在体外发酵4 h时,象草与皇竹草不同比例组合均产生正组合效应(P> 0.05)。在体外发酵8、24和48 h时,添加25%皇竹草T2组和添加75%皇竹草T4组均产生正组合效应,两组间差异不显著(P> 0.05),但均显著大于T3组(P< 0.05)。在体外发酵12 h时,添加75%皇竹草T4组的组合效应值显著高于T2和T3组 (P< 0.05)。
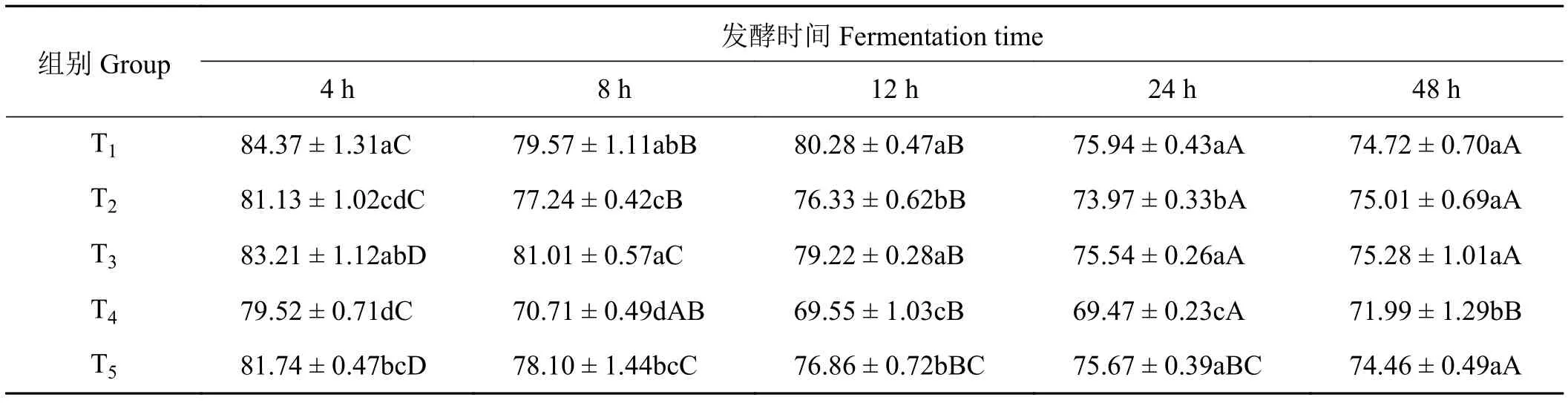
表6 象草与皇竹草组合对山羊体外瘤胃乙酸浓度的影响Table 6 Effect of the combination of Pennisetum purpureum and Pennisetum sinese on rumen acetic acid concentrations of goats in vitro%
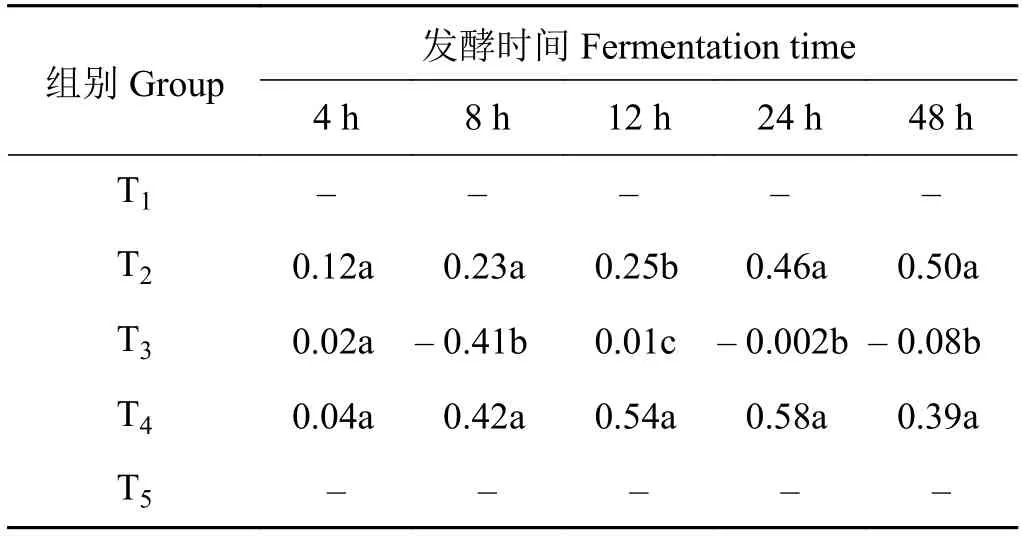
表7 象草与皇竹草组合对山羊体外瘤胃乙酸浓度的组合效应Table 7 Associative effect of Pennisetum purpureum and Pennisetum sinese on rumen acetic acid concentrations of goats in vitro
2.7 象草与皇竹草组合对山羊体外瘤胃丙酸浓度的影响
象草与皇竹草组合对山羊体外瘤胃丙酸比例产生了影响(表8)。在体外发酵4 h时,添加75%皇竹草T4组丙酸比例显著高于T1和T3组(P< 0.05),与T2和T5组之间差异不显著(P> 0.05)。在体外发酵8、12和24 h时,T4组丙酸比例显著高于其他各组(P< 0.05)。在体外发酵48 h时,添加75%皇竹草组T4丙酸比例显著高于添加25%皇竹草T2组(P< 0.05),与添加50%皇竹草T3组差异不显著(P> 0.05)。在整个发酵期,随发酵时间的延长,T3和T5组丙酸比例逐渐增加;T2和T4组乙酸比例在发酵4至24 h逐渐增加,在发酵24至48 h逐渐下降,且T4组显著降低(P< 0.05);在体外发酵4至8 h,各组丙酸比例显著增加(P< 0.05);在体外发酵8至12 h,各组乙酸比例逐渐增加(P> 0.05)。
2.8 山羊体外瘤胃丙酸浓度的组合效应
象草与皇竹草组合产生了组合效应(表9)。在体外发酵4 h时,添加皇竹草T2、T3和T4组均产生正组合效应,T4组与T2和T3组差异不显著(P>0.05)。在体外发酵8、12和24 h时,添加75%皇竹草T4组的组合效应值显著高于T2和T3组(P<0.05)。在体外发酵48 h时,添加75%皇竹草T4组的组合效应值显著高于T3组(P< 0.05),与T2组间差异不显著 (P> 0.05)。
2.9 象草与皇竹草组合对山羊体外瘤胃丁酸浓度的影响
象草与皇竹草组合对山羊体外瘤胃丁酸比例产生了影响(表10)。在体外发酵4 h时,T4组丁酸比例显著高于T1和T3组(P< 0.05),与T2和T5组差异不显著(P> 0.05)。在体外发酵8 h时,T4组丁酸比例显著高于其他各组 (P< 0.05),T1、T2、T3和T5组差异不显著(P> 0.05)。在体外发酵12、24和48 h时,T4组丁酸比例显著高于其他各组(P< 0.05),T2组丁酸比例显著高于T3组(P> 0.05),单一皇竹草T5组显著高于单一象草T1组(P< 0.05)。随发酵时间的延长,各组丁酸比例发生了变化。在发酵4至8 h,各组丁酸比例显著增加(P< 0.05);在发酵8至24 h,各组丁酸比例差异不显著(P> 0.05);在发酵24 h至48 h,除T4组丁酸比例显著下降(P<0.05),其余各组差异均不显著(P> 0.05)。
2.10 山羊体外瘤胃丁酸浓度的组合效应
象草与皇竹草组合产生了组合效应(表11)。在体外发酵4 h时,添加75%皇竹草T4组的组合效应值显著低于T2组(P< 0.05),与T3组间差异不显著(P> 0.05)。在体外发酵8和48 h时,T4组的组合效应值显著高于T3组(P< 0.05),与T2组间差异不显著(P> 0.05)。在体外发酵12和24 h时,添加75%皇竹草T4组的组合效应值显著高于T2和T3组(P< 0.05)。
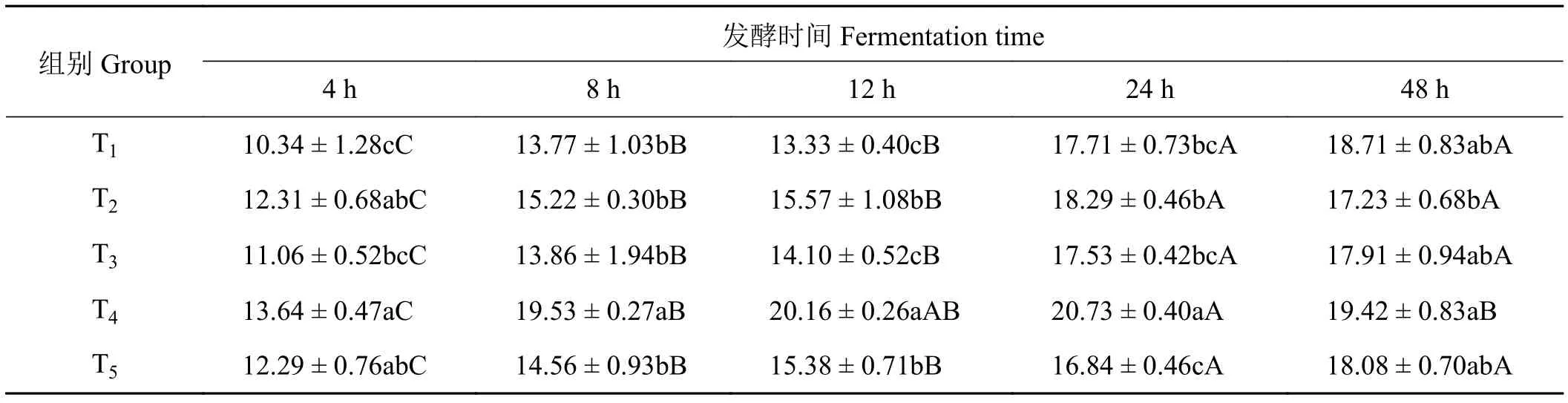
表8 象草与皇竹草组合对山羊体外瘤胃丙酸浓度的影响Table 8 Effect of the combination of Pennisetum purpureum and Pennisetum sinese on rumen propanoic acid concentrations of goats in vitro%
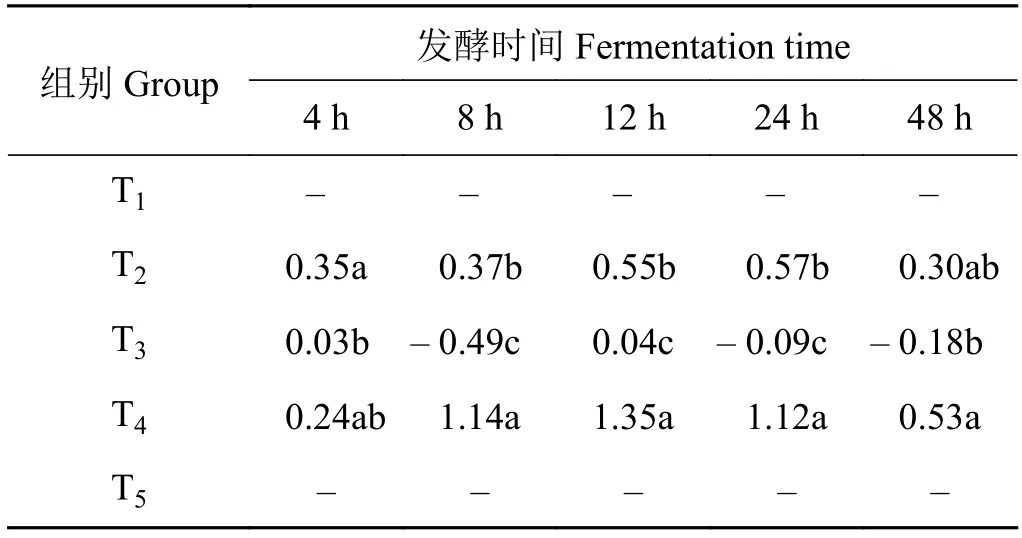
表9 象草与皇竹草组合对山羊体外瘤胃丙酸浓度的组合效应Table 9 Associative effect of Pennisetum purpureum and Pennisetum sinese on rumen propanoic acid concentrations of goats in vitro
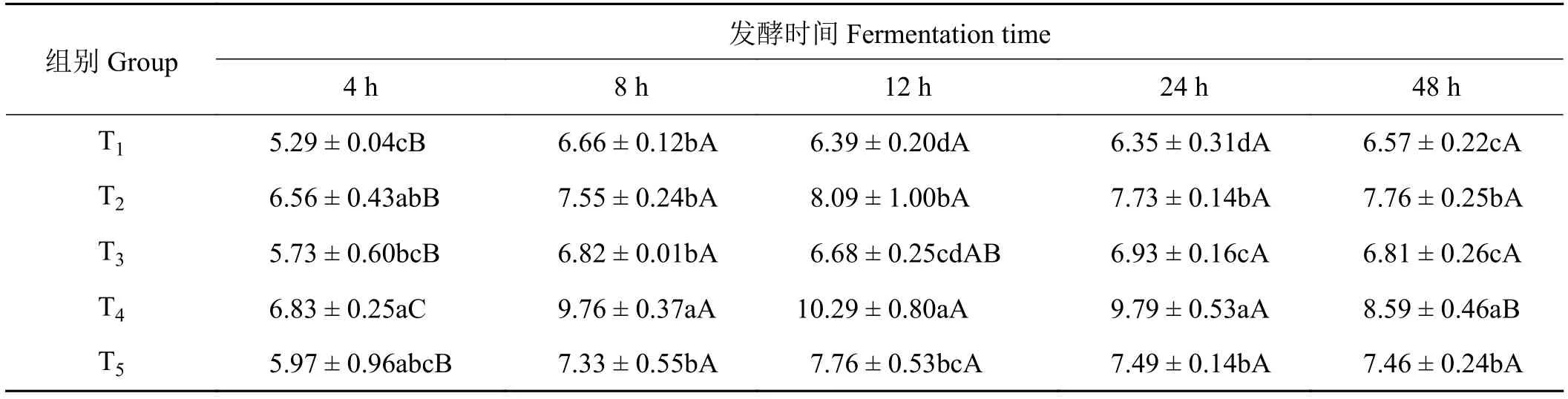
表10 象草与皇竹草组合对山羊体外瘤胃丁酸浓度的影响Table 10 Effects of the combination of Pennisetum purpureum and Pennisetum sinese on rumen butyric acid concentrations of goats in vitro%
2.11 象草与皇竹草组合对山羊体外瘤胃乙酸与丙酸比值的影响
象草与皇竹草组合对山羊体外瘤胃乙丙酸比值产生了影响(表12)。在体外发酵4 h时,单一象草组T1的乙丙酸比值显著高于组T3、T4和T5(P<0.05)。在体外发酵8 h时,各组乙丙酸比值差异不显著(P> 0.05)。在体外发酵12 h时,组T1乙丙酸比值显著高于组T3、T4和T5(P< 0.05);添加75%皇竹草T4组显著低于T2组(P< 0.05),与组T3差异不显著(P> 0.05)。在体外发酵24 h时,单一皇竹草组T5的乙丙酸比值显著低于单一象草组(P<0.05),象草与皇竹草组合组差异不显著(P> 0.05)。在体外发酵48 h时,添加75%皇竹草T4组的乙丙酸比值显著高于组T1(P< 0.05),与组T2和T3差异不显著(P> 0.05)。在体外发酵12至24 h时,随发酵时间的延长,T1、T2、T4和T5组乙丙酸比值显著降低 (P< 0.05),而 T3组差异不显著 (P> 0.05);在体外发酵24至48 h时,各组乙丙酸比值变化差异不显著 (P> 0.05)。
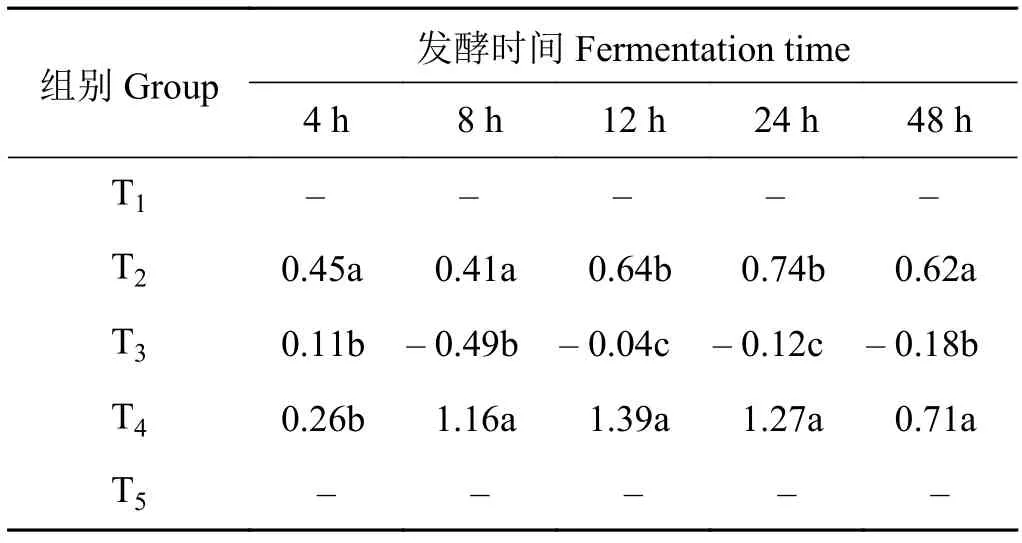
表11 象草与皇竹草组合对山羊体外瘤胃丁酸浓度的组合效应Table 11 Associative effect of Pennisetum purpureum and Pennisetum sinese on rumen butyric acid concentrations of goats in vitro
2.12 体外发酵48 h时各单项发酵指标的多项组合效应值
象草与皇竹草组合在体外发酵48 h时,添加25%皇竹草T2组OMD和CFD均产生负组合效应(表13);添加50%皇竹草T3组除OMD指标外均产生负组合效应;添加75%皇竹草T4组的各发酵指标均产生正组合效应。综合各单项指标组合效应,添加75%比例皇竹草T4组的多项组合效应值达到最大,为1.68。
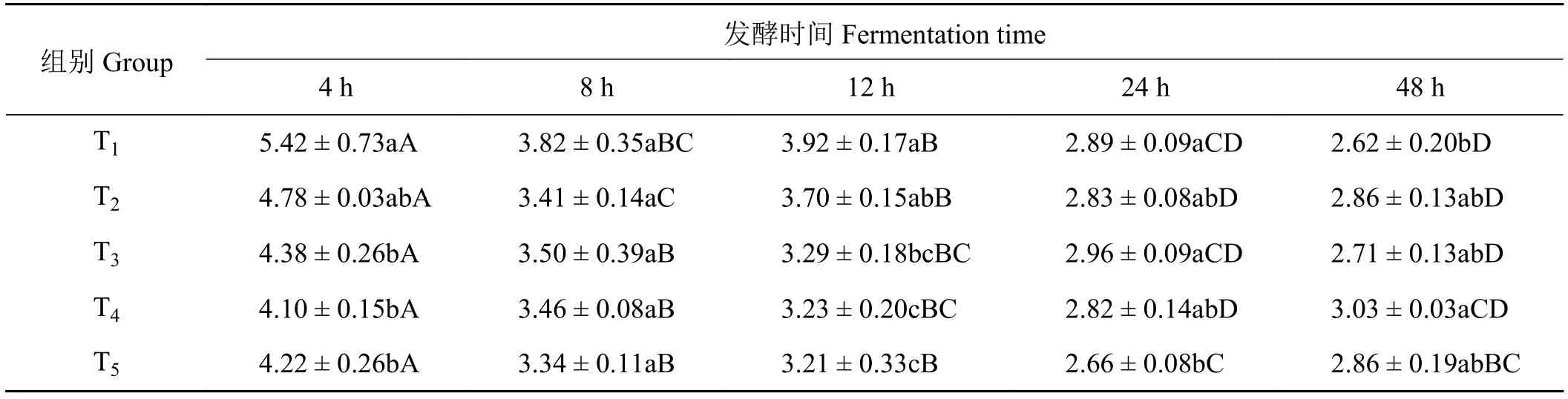
表12 象草与皇竹草组合对山羊体外瘤胃乙酸与丙酸比值的影响Table 12 Effects of the combination of Pennisetum purpureum and Pennisetum sinese on rumen acetic acid to propanoic acid ration of goats in vitro
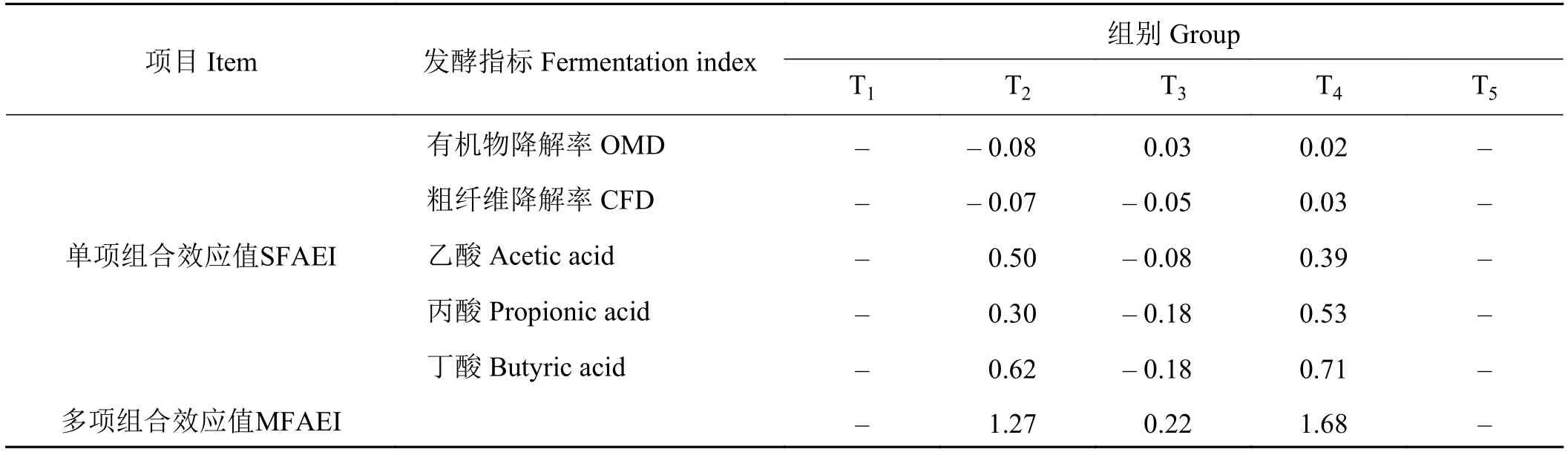
表13 象草与皇竹草组合体外发酵48 h时的多项组合效应值Table 13 Associative effect of Pennisetum purpureum and Pennisetum sinese on in vitro fermentation after 48 h
3 讨论
3.1 象草与皇竹草组合对山羊体外瘤胃营养物质降解率的影响
饲料的营养物质降解率是衡量动物机体对饲粮养分利用率的重要指标。对于反刍动物而言,不同种类牧草间的特异性影响其生长性能,在生产实践中人们利用这种特异性,将不同种类牧草混合饲喂反刍动物,可达到均衡饲粮营养,提高营养物质利用率的效果[11]。冯仰廉[12]研究表明,粗饲料的有机物质体外消化率与粗饲料的中性洗涤纤维含量呈负相关关系。本研究得出,随皇竹草添加比例的增加,象草与皇竹草组合的中性洗涤纤维含量降低,而有机物降解率逐渐增加,这与其研究结果一致。王之盛和李胜利[13]研究表明,饲料中有机质分为结构性碳水化合物和非结构性碳水化合物,而后者消化率及降解率高于前者。本研究中,随皇竹草比例增加,有机物质降解率逐渐增加,这可能是因为皇竹草的非结构性碳水化合物高于象草造成的;而非结构性碳水化合物又可为瘤胃微生物提供更多的糖类,提高瘤胃微生物的活性,从而提高瘤胃微生物对营养物质的利用率[14]。
粗纤维是草食动物不可缺少的营养物质来源,日粮纤维的特点与性质也可影响反刍动物的采食、咀嚼和瘤胃发酵类型,对动物的健康和生产起着重要作用[15]。本研究得出,在山羊体外瘤胃发酵24和48 h时,随着皇竹草比例的增加,饲粮中粗纤维含量逐渐降低,而粗纤维降解率逐渐增大;当皇竹草添加比例达到75%时,随粗纤维含量的降低,粗纤维降解率反而降低,这与孟梅娟等[16]的研究结果一致。本研究得出,在体外发酵4至12 h时粗纤维降解率呈无规律变化,可能是因为反刍动物通过瘤胃微生物利用纤维物质,而瘤胃微生物通过物理过程消化和化学过程产生纤维素分解酶降解粗纤维则需要一定时间过程[17]。本研究得出,象草与皇竹草组合组的营养物质降解率随发酵时间的延长而增大,可能是因为瘤胃微生物的数量及活性随发酵时间延长而增大,加大了营养物质的降解程度所致[1]。
3.2 象草与皇竹草组合对山羊体外瘤胃挥发性脂肪酸组成的影响
pH是影响瘤胃挥发性脂肪酸产生的因素之一,也是反映瘤胃发酵正常与否的重要指标,研究表明,象草与皇竹草组合后的pH和NH3-N浓度均在正常范围内,说明象草与皇竹草组合在体外瘤胃中可正常发酵[1]。挥发性脂肪酸是反映瘤胃微生物活性的指标之一,主要包括乙酸、丙酸和丁酸等[15,18]。陈光吉等[19]研究表明,瘤胃中挥发性脂肪酸的组成及浓度受饲料精粗比、加工方式和添加剂等的影响,在瘤胃挥发性脂肪酸组成中均以乙酸含量最高;本研究得出,同一组别在同一发酵时间均以乙酸含量最高,这与前人研究结果一致。Copani等[20]研究表明,挥发性脂肪酸组分中碳原子含量越多,吸收速度越快,其中丁酸吸收速度大于丙酸,乙酸吸收最慢。试验中乙酸含量总是高于丙酸,这可能也与挥发性脂肪酸的吸收速率有关,也可能是因为两种牧草中的纤维素和半纤维素含量较高,发酵后产生的乙酸比例较高,而丙酸比例较低[21]。本研究得出,添加75%皇竹草组体外瘤胃中乙酸所占比例显著低于其他各组(P< 0.05),而丙酸和丁酸所占比例均高于其他各组,说明象草与皇竹草以25∶75组合可提高丙酸产量,其品质高于其他各组,有利于提高动物的生产性能[22]。本研究得出,随着体外发酵时间的延长,乙酸、丙酸和丁酸的浓度均逐渐增大,这可能是因为产气瓶中产物积累而不能排出及无瘤胃上皮使挥发性脂肪酸不能被机体吸收利用导致的[12]。
反刍动物采食日粮不同,瘤胃内乙酸、丙酸和丁酸所占挥发性脂肪酸的比例也不同,在正常情况下乙丙酸比值范围为2.0~3.6[23]。本研究得出,在山羊体外瘤胃发酵8~48 h,象草与皇竹草50∶50和25∶75组的乙丙酸比值范围为2.71~3.50,在正常比值范围。在体外发酵4 h时,试验各组乙丙酸比值均大于3.60,这可能是因为不同粗饲料组合对瘤胃纤维素降解菌产生了不同程度的影响。在发酵前期,纤维素降解酶的活性较低,影响了纤维素的降解,而组合中纤维含量较高,降解为乙酸,使瘤胃中丙酸比例相应降低所致[24-25]。
3.3 象草与皇竹草不同比例组合对组合效应的影响
不同饲粮组合会产生不同组合效应,单项组合效应值(SFAEI)是从单一发酵指标评价饲粮组合效应的,难以对饲料作出全面的评价;多项组合效应值(MFAEI)是结合SFAEI对饲粮组合进行的综合效应评定,结果更有说服力[3-4]。本研究得出,象草与皇竹草不同比例组合体外瘤胃发酵48 h,当象草与皇竹草比例为75∶25时,OMD和CFD均产生负组合效应,其余指标均产生正组合效应,综合效应值为1.27;当象草与皇竹草比例为50∶50时,除OMD产生正组合效应外,其余指标均产生负组合效应,综合效应值为-0.46;当象草与皇竹草比例为25∶75时,各体外发酵指标均产生正组合效应,综合效应值为1.68。象草与皇竹草组合产生正组合效应,可能是因为不同饲料混合达到适宜比例后,其营养物质之间、非营养物质之间和抗营养物质之间互作的整体效应,增大了饲粮发酵程度,提高了饲料的消化利用率[2,26]。综上所述,象草与皇竹草的最佳组合比例为 25∶75。
4 结论
1)象草与皇竹草组合产生了组合效应,皇竹草的品质优于象草。
2)若以象草和皇竹草组合为粗饲料饲喂山羊,建议组合比例为25∶75。
