紫花苜蓿对陇东黄土高原油污土壤场地生态修复的综合响应
2019-09-02王金成井明博刘光琇吴胜伟周天林
宋 曦,王金成,井明博,刘光琇,陈 拓,吴胜伟,周天林
(1. 陇东学院农林科技学院,甘肃 庆阳 745000;2. 甘肃省高校陇东生物资源保护与利用省级重点实验室,甘肃 庆阳 745000;3. 陇东学院生命科学与技术学院,甘肃 庆阳 745000;4. 甘肃省极端环境微生物资源与工程重点实验室 / 中国科学院寒区旱区环境与工程研究所,甘肃 兰州 730000;5. 西安环发环保工程有限公司,陕西 西安 710068)
现已成为全国第一大油田的长庆油田公司是陇东地区主要经济支柱产业,但因石油开采、贮存及运输造成该地区原油污染的土壤面积达1.02 万hm2,其北部地区土壤总石油烃含量已高出土壤油污临界值近300倍[1]。目前油污土壤生态修复技术主要包括物理修复法、化学修复法和生物修复法,而生物修复法以其成本低、可大面积原位操作和环境友好等优点而备受青睐[2],其中植物修复法以其处理效果好、美化环境和无生物性二次污染等优点已逐渐成为石油污染土壤生态恢复领域的首选技术之一[3]。
应用于油污退化生态系统的植物应具备抗逆性强、生长迅速和抗旱耐寒等特点,如红三叶草(Trifolium pratense)、鞑靼滨藜(Atriplex tatarica)、狗尾草(Setaria viridis)、沙打旺(Astragalus adsurgens)、盐地碱蓬 (Suaeda salsa)、柠条(Caragana korshinskii)和盐角草(Salicornia europaea)等[4-6]。但在油污土壤场地修复过程中植物发挥活性的条件相对苛刻[7],易受多种环境因素的影响,其中包括场地修复时外部环境因素和植物生理因素[8]。我国大陆境内原油主产区均位于东北和西北地区,因此外部环境因素会直接或间接影响生物修复技术的选择与修复方式的准确定位[9],而修复植物本身生理特性则成为制约油污土壤生物降解速率和修复效果的决定性因素[10]。因此,系统分析修复植物在油污土壤实际场地修复过程中的生理响应机制是解决上述问题的关键因素之一。
紫花苜蓿 (Medicago sativa) 作为我国北方适生植物,因其根系发达、抗逆性强[11]、固氮及根际微环境共代谢水平高[12]等特点,已被广泛运用于油污土壤生态修复技术研究[13]。然而以往有关油污土壤植物修复技术相关研究大多以盆栽试验为主,运用紫花苜蓿开展油污土壤实际场地生态修复相关研究则鲜有报道。为此,本研究以紫花苜蓿为试验材料,在长庆油田公司第二采油厂陇东污泥处理站进行为期3个月的场地修复试验,分析了紫花苜蓿应对4种陇东地区常见油污浓度 (1%、3%、5%和7%) 时19种植物生理和生物降解相关环境指标的变化情况,旨在揭示场地修复过程中紫花苜蓿应对不同油污浓度胁迫时的生理响应情况,优化场地修复降解条件、加速生物降解速率,为陇东地区油污土壤植物生态修复的大面积实地推广应用提供参考和基础数据资料。
1 材料与方法
1.1 供试样地选择和试验设置
场地修复地点位于甘肃省庆阳市马岭镇长庆油田公司采油二厂陇东油泥处理站(107°22′19″ E,36°36′15″ N)。供试油污土样的初始总石油烃 (total petroleum hydrocarbons,TPH)含量设置为1%、3%、5%和7%,浇水平衡2周后测得TPH含量依次为0.98%、2.95%、4.82%和6.89%,以不加油泥的井场周边撂荒地清洁土壤为空白对照组(TPH浓度为0)。
由西安环发环保工程有限公司负责修建束沿,深度为50 cm,大小为3 m × 3 m,土层铺设厚度为25~30 cm,土样容重为1.78 g·cm-3,自然含水为量8.59%,pH为8.82。包括对照组(CK)在内,每个油污浓度设置3个重复,共计15个束沿修复池。试验于 2017年4月6日开始,7月5日结束,试验周期为91 d,每个束沿播撒供试植物种子1 000粒,覆土厚度约为1 cm,每3 d浇水一次,使土壤田间持水量保持在65%左右,从5月中旬起由自然降水提供水分。
1.2 测定指标及方法
试验结束后在每个束沿池内随机收获20株供试植物,随机分为2组(每组10株),第1组采用程立娟和周启星[14]的方法测定其株高、根长、地上及地下生物量和根冠比,同时收集每株供试植物的根际土壤,采用稀释培养测数法 (MPN) 测定烷烃降解菌和芳烃降解菌数量;第2组取植株新鲜叶片,采用考马斯亮蓝法测定可溶性蛋白含量[15],采用硫代巴比妥酸 (TBA) 测定丙二醛 (MDA) 含量[16],采用氮蓝四唑法 (NBT) 测定超氧化物歧化酶 (SOD)活性[17],采用Rao等[18]的方法检测过氧化物酶 (POD)活性,采用H2O2法予以测定过氧化氢酶 (CAT) 活性[19],上述指标均以供试植物鲜重计算。土壤TPH残留量和植物体各部TPH含量采用超声-索氏萃取-重量法测定[20]。采用张麟君等[23]的方法测定植物地上部和地下部总石油烃含量。
1.3 数据处理与计算
利用 SPSS 18.0和 R2.15.2 (http:∥www.r-project.org/) 对数据进行分析,用Origin 8.0和R 2.15.2作图。为了解析陇东黄土高原地区不同油污浓度胁迫时紫花苜蓿生长及生理指标间相互关系,本研究对不同油污浓度影响下各指标进行Pearson's相关性分析,使用R语言“corrplot”程序包进行相关矩阵排序和显著性水平计算[10]。
2 结果与分析
2.1 不同油污浓度胁迫下紫花苜蓿根际土壤TPH降解率变化
土壤TPH降解率是直接反映生态修复过程中植物对石油烃吸收和转化能力强弱的重要指标[21]。不同油污浓度胁迫下紫花苜蓿TPH降解率变化不尽相同 (P< 0.01),随着油污浓度增加紫花苜蓿处理组根际土壤TPH降解率逐步下降(P< 0.05),相较于1%油污浓度时(75.23%),当油污浓度分别增至3%、5%和7%时,其TPH降解率依次显著下降了9.53%、30.07%和87.41%(图1)。这说明随着油污浓度不断增加,其毒性效应随之增强,阻碍了根际微环境植物与微生物的共代谢水平。

图1 不同油污浓度胁迫下紫花苜蓿根际土壤总石油烃降解率变化Figure 1 Changes in the TPH removal rate by Medicago sativa under stress from different TPH concentrations
2.2 不同油污浓度胁迫下紫花苜蓿生长指标变化
F检验结果(图2)显示,不同油污浓度对紫花苜蓿的株高、根长、地上部生物量、地下部生物量和根冠比有极显著影响 (P< 0.01)。
当油污浓度为1%时,紫花苜蓿株高与CK组间无显著差异(P> 0.05),说明较低的油污浓度对紫花苜蓿的株高无显著影响;而随着油污浓度增至3%~7%时其株高显著降低(P< 0.05)。当油污浓度增至3%和5%时,紫花苜蓿株高较CK分别下降了25.94%和 24.06%,说明上述2种油污浓度对紫花苜蓿株高的抑制程度较为一致。当油污浓度达到7%时,紫花苜蓿株高较CK降低了80.46%,表明高浓度油污土壤对紫花苜蓿的株高的抑制作用尤为明显。随着油污浓度增加,紫花苜蓿地下生物量和根冠比呈显著降低趋势 (P< 0.05),表明重度石油污染对紫花苜蓿地下生物量的积累具有明显的抑制作用,致使其根冠比也随之降低(图2)。
紫花苜蓿根长、地上及地下部生物量和根冠比方面,随着油污浓度从1%增至7%,与CK组相比,根长依次降低了26.28%、15.95%、23.71%和94.49%,地上部生物量分别降低了11.52%、19.62%、1.67%和85.82%,地下部生物量分别降低了44.51%、82.49%、86.96%和99.23%,而根冠比则依次下降了37.25%、78.28%、85.85%和94.45%(图2)。上述结果说明重度污染对紫花苜蓿根长和地上部生物量和根冠比的抑制作用尤为显著。相较而言,地下部生物量和根冠比对油污浓度变化则较为敏感,当油污浓度大于3%时,其地下部生物量和根冠比降低程度相对较大。
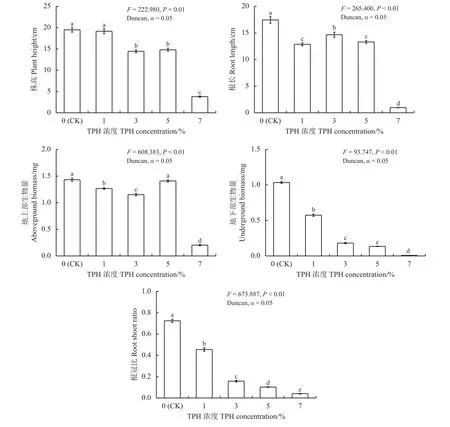
图2 场地修复过程中不同油污浓度胁迫下紫花苜蓿生长指标变化情况Figure 2 Changes in growth indicators for Medicago sativa under stress from different TPH concentrations during the site remediation period
2.3 不同油污浓度胁迫下紫花苜蓿生长对TPH的转移及富集
植物修复油污土壤主要通过根际微环境中植物与微生物协同作用将持久性有机污染物矿化后,经蒸腾作用被运输到植物的茎叶部分,通过生物化学反应将石油烃进行彻底分解为CO2,进而通过植物呼吸作用释放到空气中[22],为了说明修复植物对持久性有机污染物矿化和转化能力,通常采用生物转移系数 (TF) 和生物富集系数 (BCF) 来表征植物对污染物的迁移转化和吸收程度,其中生物转移系数是指植物地上部与地下部总石油烃含量的比值;生物富集系数是指植物体内总石油烃含量与土壤总石油烃含量的比值[23]。
当油污浓度在 3%和5%时,决定BCF系数高低的植物体地上及地下部TPH含量在不同油污浓度胁迫时变化也不尽相同 (P< 0.01)。其中TPH浓度为3%时紫花苜蓿地上部TPH含量最高,7%时最低(P<0.05),而地下部TPH含量则以5%时最高,7%时最低(P< 0.05);根据上述结果,分别计算不同油污浓度影响下紫花苜蓿的BCF系数和TF系数,且BCF和TF系数表现出相似的变化趋势,即1%和3%油污浓度时两种系数均显著高于其他浓度处理(P< 0.05)(表1),说明土壤中TPH含量过高时,紫花苜蓿对TPH的富集转化将受到抑制,原因可能是土壤中的TPH含量超出了紫花苜蓿所能承受的最高阈值,烃类物质的生态毒性可抑制植物体对TPH的吸收。
2.4 不同油污浓度胁迫下紫花苜蓿生理指标变化
F检验结果(表2)显示,紫花苜蓿可溶性蛋白含量、叶绿素含量、MDA含量以及CAT酶、POD酶和SOD酶活性在不同油污浓度间存在极显著差异 (P<0.01)。多重比较结果显示,紫花苜蓿可溶性蛋白含量在油污浓度1%和3%时最高,且显著高于其他浓度处理(P< 0.05) ;而叶绿素含量则在TPH浓度为5%时达到最高,7%胁迫组最低;不同油污浓度胁迫时紫花苜蓿CAT和POD酶活性表现出与叶绿素含量相似的变化趋势,即5%浓度时最高,7%时最低;SOD酶活性和MDA含量在应对不同油污浓度胁迫时二者亦表现出相似的变化规律,随着TPH浓度的增加而逐渐降低,其中1%浓度组与CK组间无显著差异 (P> 0.05),且显著高于其他浓度组 (P< 0.05)。
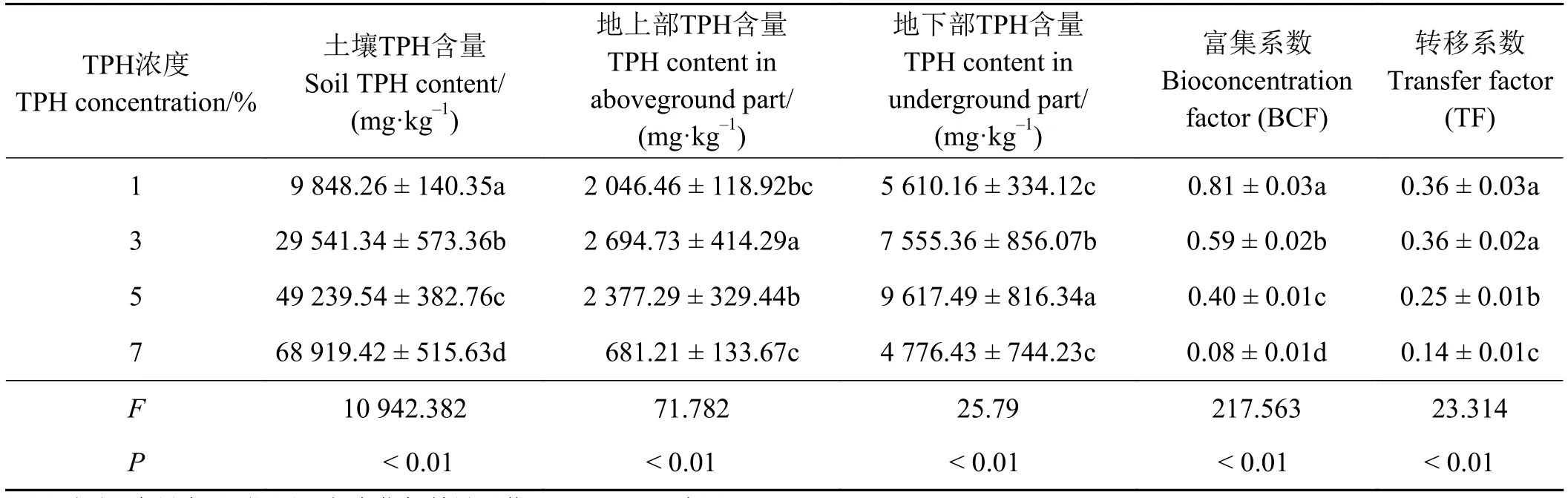
表1 场地修复过程中不同油污浓度胁迫下紫花苜蓿对土壤TPH的富集系数(BCF)及转移系数(TF)Table 1 Bioconcentration factor and transfer factor values for Medicago sativa under stress from different TPH concentrations

表2 场地修复过程中不同油污浓度胁迫下紫花苜蓿生理指标变化情况Table 2 Changes in the physiological indexes for Medicago sativa under stress from different TPH concentrations during the site remediation period
2.5 不同油污浓度胁迫下紫花苜蓿根际土壤中石油烃降解菌数量变化
当油污浓度从0增至3%时,其烷烃降解菌数量由 0.32 × 105CFU·g-1增至 4.41 × 105CFU·g-1,但之后逐步降低,当油污浓度增至5%和7%时,与1%浓度组相比,其烷烃降解菌数量分别下降了39.42%和77.93%,说明紫花苜蓿根际烷烃降解菌数量对重度污染相对敏感,而中度污染时抑制作用相对较小(图3)。芳烃降解菌数量则在3%浓度组时最高,为6.21 × 103CFU·g-1;1%浓度时次之,为5.23 × 103CFU·g-1;3%浓度以上,随油污浓度增加芳烃降解菌数量降低 (P< 0.05),说明中低油污浓度时土壤石油烃为土著石油降解菌提供了大量的碳源,有助于土壤石油降解数量的提升[14];但当油污浓度高于5%时,石油烃会破坏土壤结构,加剧根际土壤粘度进而抑制土壤透气性[11],加之石油降解菌大多为好氧菌[13],因此造成高浓度土壤烷烃降解菌和芳烃降解菌数量的下降。
2.6 中度和重度油污浓度胁迫下紫花苜蓿各项指标的相关分析
为了综合解析陇东地区不同油污浓度胁迫时供试指标间内在关系,本研究选取中度(3%)和重度 (7%)两种油污浓度进行Pearson's相关性分析。分析可知,当油污浓度为3%时,BCF系数与紫花苜蓿地上部分TPH含量 (r= 0.899,P= 0.001) 和可溶性蛋白含量 (r= 0.660,P= 0.045) 呈正相关关系,而与转移系数间呈负相关关系 (r= -0.643,P= 0.038),这说明紫花苜蓿对TPH的吸收主要发生并富集在根际区域(图4)。土壤TPH残留量分别与植物体TPH残留量(r= 0.786)、叶绿素总量 (r= 0.893)、烷烃降解菌 (r=0.894) 和芳烃降解菌数量(r= 0.880)呈正相关关系(P< 0.01),说明中度污染时,紫花苜蓿TPH富集量随土壤中TPH含量增加而增加,进而引起了包括叶绿素 (r= 0.882)、MDA含量 (r= 0.776)、烷烃降解菌(r= 0.909) 和芳烃降解菌数量 (r= 0.896) 的显著增加(P< 0.01)。
当油污浓度为7%时,土壤中TPH残留量与植物体内TPH含量 (r= 0.845,P= 0.002)和烷烃降解菌数量 (r= 0.722,P= 0.018) 存在正相关关系,而植物体内TPH残留量又与BCF系数 (r= 0.908,P<0.01) 和烷烃降解菌数量 (r= 0.681,P= 0.030) 存在正相关关系,且BCF系数与烷烃降解菌亦存在正相关关系 (r= 0.670,P= 0.034),上述结果在某种程度上说明紫花苜蓿在如此高浓度油污胁迫下依然进行了TPH的转移,而此时植物体内TPH残留量与TF系数无相关性则说明TPH含量在植物体内分布较为一致,即地上及地下部分间无显著差异。

图3 场地修复过程中不同油污浓度胁迫下紫花苜蓿根际土壤石油烃降解菌数量变化情况Figure 3 Changes to the quantity of TPH degrading bacteria in the rhizosphere soil around Medicago sativa under stress from different TPH concentrations during the site remediation period
3 讨论与结论
石油烃对土壤污染主要表现为破坏土壤结构、降低土壤透性,引起根部腐烂,阻碍植物根系呼吸及养分吸收等[11]。因此利用植物进行油污土壤生态修复,需通过检测其株高、生物量、根冠比等诸多植物体生长指标,来评价植物是否具备修复油污土壤潜力[13]。本研究中紫花苜蓿5种生长指标在不同油污浓度胁迫时呈极显著差异 (P< 0.01)。首先,紫花苜蓿株高和根长均随油污浓度增加明显降低 (P< 0.05),这与山宝琴等[24]研究结果相一致。但本研究中当油污浓度为3%紫花苜蓿根长显著增长,究其原因可能是由于中度石油污染可刺激植物根际的生长所致[22]。其次,植物体地上及地下生物量在油污浓度低于5%时其影响程度不尽相同,但在7%胁迫组时二者均为最低,这与时腾飞等[25]研究结果基本一致。说明不同浓度石油烃对紫花苜蓿生长指标的影响不尽相同,但总体表现为油污浓度增加对植物生长的抑制作用则愈加明显[14,25],而5%的油污浓度却对紫花苜蓿地上生物量的积累有明显的促进作用。
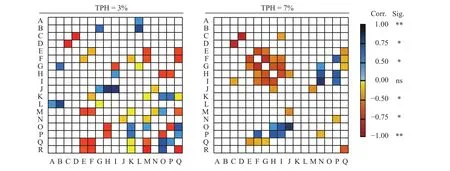
图4 场地修复过程中3%和7%油污浓度胁迫下紫花苜蓿各指标间相关性Heatmap图谱Figure 4 Heatmap diagrams showing the correlation analyses of the physiological and biochemical indexes for Medicago sativa under TPH concentration stress levels of 3% and 7% during the site remediation period
石油烃的生物降解主要发生在修复植物的根际微环境中,通过植物根际分泌物与土壤微生物群落共代谢作用将持久性有机污染物矿化从而达到生物降解的目的,因此油污土壤植物修复过程中植物体地下部生物量对于油污土壤生物生态修复效果尤为重要[14]。本研究中,紫花苜蓿根冠比随油污浓度的增加呈显著下降 (P< 0.05),说明石油烃对紫花苜蓿的生长影响主要体现在对地下生物量的影响,因此如何有效保护紫花苜蓿根际生长对于提高根际微环境石油烃矿化速率至关重要。
可溶性蛋白是调控植物代谢的主要物质,其含量高低是表征植物合成和代谢能力的重要指标。当石油烃污染土壤后,植物体可通过增加蛋白质合成量或将不可溶性蛋白转化成可溶性蛋白的方式来维持植物体正常新陈代谢[12]。本研究中紫花苜蓿可溶性蛋白含量在油污浓度1%和3%时达到最高(P< 0.05),之后随着油污浓度的增加而逐步降低,这与雒晓芳等[26]研究结论基本一致。结合Pearson's相关性分析可知,当油污浓度小于3%时,紫花苜蓿可通过增加可溶性蛋白的含量予以补偿,且TPH可能在根部积累的含量高于其地上部分。但当油污浓度大于3%时,补偿方式则受到显著抑制。此外,雒晓芳等[26]采用盆栽试验时石油烃对紫花苜蓿可溶性蛋白合成的抑制浓度仅为 0.75%,而在本研究实际场地生态修复时其抑制浓度出现在5%以上,说明大面积实施场地修复时紫花苜蓿可溶性蛋白对于石油烃毒害作用的补偿作用更加明显。
植物体在逆境条件下亦可通过增加光合作用来适应或补偿土壤逆境带来的生长损失,因此叶绿素含量高低是衡量植物体该补偿效应的重要参数[27]。本研究中紫花苜蓿叶绿素含量在TPH浓度为5%时达到最高,说明石油烃浓度在5%时对紫花苜蓿的生态毒性最大,紫花苜蓿通过光合作用进行最大程度的生理补偿,同时增加烷烃降解菌和芳烃降解菌数量加速植物体根际微环境的TPH浓度(图4)。但当石油烃浓度增至7%时,其叶绿素含量已降至0.63 mg·kg-1(表2),说明重度污染时石油烃可以直接进入植物体内造成直接伤害,进而影响叶绿体正常生理功能[28]。
CAT是植物组织一种保护植物体免受过氧化氢积累危害的重要酶类,因此其活性的高低是反映植物抗性的重要生理指标[13]。于君宝等[29]在温室条件下模拟了2种不同油污浓度(0.5%和2%)对黄河三角洲地区芦苇(Phragmites australis)和盐地碱蓬(Suaeda salsa)幼苗生长的影响,结果表明,盐地碱蓬幼苗叶片CAT活力随油污浓度增加而下降,但对芦苇幼苗叶片CAT活性无显著影响;而芦苇幼苗叶片POD活性随油污浓度增加而升高,但盐地碱蓬叶片中POD活力随油污浓度的增加呈先升后降的变化趋势。弓晓峰等[30]模拟了4种不同油污浓度(0、1%、5%和 10%)对玉米(Zea mays)生长的影响,结果显示重度污染 (TPH ≥ 5%) 可有效增加玉米CAT活性,但会抑制POD活性。上述试验结果与本研究结果基本一致。本研究中5%浓度组紫花苜蓿CAT活性明显增加,但7%浓度组时该酶活性受到抑制。说明中低油污浓度时(< 5%),紫花苜蓿抗氧化能力明显,并有效解除过氧化氢和过氧化物积累,但当油污浓度达到7%时,植株为解除上述积累毒害作用而消耗了大量CAT和POD,同时抑制了紫花苜蓿抗氧化酶的活性和抗氧化剂的产生,对抗氧化系统造成损伤[31],进而引起CAT和POD活性在此浓度下明显下降。
本研究中紫花苜蓿SOD酶活性和MDA含量在油污浓度1%时与CK组间无显著差异,且二者显著高于其他浓度组 (表2)。说明SOD酶对石油烃污染较为敏感,这一结果也印证了宋雪英等[32]在分析不同油污浓度对小麦生态毒性中所提出的SOD酶对持久性有机污染物极为敏感的试验结论。SOD酶是植物体内重要的膜保护酶之一,可防御活性氧或其他过氧化物自由基对细胞膜系统的伤害和逆境胁迫,在石油污染土壤后其活性相对较高[30]。但本研究中随着油污浓度由1%增至5%时该酶活性逐渐升高,但在7%胁迫组时其活性骤然下降,说明一定浓度范围内油污浓度的增加可诱导紫花苜蓿SOD酶活性的增加以清除自由基对植物的毒害作用[27],但当氧自由基含量超过紫花苜蓿可承受范围时,石油烃的生理毒性则会直接破坏紫花苜蓿抗氧化酶体系[31],进而导致SOD酶活性大幅降低。MDA数量能够表征膜脂过氧化程度和抗氧化能力强弱,当石油烃污染土壤后植物体往往发生细胞膜脂过氧化作用,MDA含量则随油污浓度的增加而升高[29]。雒晓芳等[26]在研究不同石油烃胁迫浓度下小麦(Triticum aestivum)和玉米两种供试植物盆栽观测试验后指出,小麦叶片中的MDA含量随着石油浓度的升高而降低,但玉米叶片中的MDA含量则是随着石油浓度的增加而升高。弓晓峰等[30]研究表明,玉米MDA含量随着污土浓度的增加呈现低-高-低的趋势。上述结果与本研究结果不尽相同,同时也说明不同植物应对石油烃污染时MDA含量变化因种而异,在不同油污浓度胁迫时紫花苜蓿和小麦MDA含量较为相似,究其原因可能是重度污染对植物细胞的膜结构破坏所致。
此外,本研究发现,3%胁迫组时土壤石油烃降解菌数量明显增加(图3),因此需要消耗大量POD酶分解紫花苜蓿根际微环境中由于降解菌在进行TPH生物降解时所产生大量的过氧化物,进而造成原油降解菌数量越多,POD酶活越低的试验结果(图4)。但就两种石油烃降解菌相关性结果来看,烷烃降解菌在进行饱和烷烃生物降解时产生的超氧化物含量相对较高,表现为SOD酶与烷烃降解菌负相关关系,这与Chang等[33]对烷烃降解菌转录组学研究结果相吻合。而重度污染时叶绿素含量的提升有助于土壤TPH的转移,进而在其根际刺激了烷烃及芳烃降解菌生长繁殖,但油污浓度达到7%时,TPH转移、富集和膜系统及抗氧化体系造成了严重破坏(图4),由此推断随着油污浓度等继续增加,植物体膜系统及抗氧化体系的持续破坏,其TPH转移和富集程度将随植物体枯黄死亡而中断。
综上所述,紫花苜蓿实际场地修复3个月后,TPH积累降解率随油污浓度增加而逐渐降低。实际场地修复中紫花苜蓿在油污浓度1%时TPH降解率最高为73.39%,而7%油污浓度时TPH降解率仅为9.44%;株高、根长和根冠比均随TPH浓度增加而明显降低。5%油污浓度有助于其地上生物量的积累但却明显抑制了地下生物量。由此说明,陇东黄土高原地区采用紫花苜蓿开展石油污染土壤生态修复时油污浓度5%应设为临界值。
