荻幼穗诱导不同类型愈伤组织的差异
2019-09-02赵浩雁刘建秀陈静波李建建宗俊勤
赵浩雁,刘建秀,陈静波,李建建,汪 毅,王 凯,宗俊勤
(江苏省中国科学院植物研究所,江苏 南京 210014)
荻(Miscanthus sacchariflorus)属于禾本科芒属(Miscanthus),为多年生C4草本,植株高大[1],是起源于我国的优良能源植物。其在我国分布区域广泛,从沿海到内陆山区、从温带到热带均有分布,可在含盐0.35%以上、pH 6.5~7.5的土壤中旺盛生长[2]。荻具有投入少、适应强、生物质产量高、燃烧特性好和再生能力强的特点[3],也是用于植被修复、防沙护坡、改善生态环境等的理想的草本能源植物[4]。此外,还可作为生产上用于土壤改良的生物炭的原料,乃至用于化学工业、制造业和其他产业,如可生物降解建筑材料等[5]。
荻的无性繁殖方式一般有根茎直播法、根茎育苗栽培法、茎秆育苗移栽法等多种方法[6]。荻的有性繁殖多采用种子繁殖,其种子来源广泛,幼苗根系发达,环境适应性强[7],但通过种子繁殖的后代背景复杂且生长发育过于缓慢,而由于荻为异花授粉植物,具有禾本科植物中广泛存在的自交不亲和的特性,因此在自然环境下主要还是通过根状茎进行营养繁殖[8]。荻的根茎繁殖虽然相对于种子繁殖生长发育速度略快,但也仅比种子繁殖面积增加3倍[9]。由此可以看出,采用常规手段对荻进行大规模繁育存在诸多限制。而通过组织培养进行无性繁殖,不仅能提高扩繁效率、保持材料的优良性状,而且还是进行体细胞筛选和遗传转化等遗传改良的有效手段[7]。
植物再生体系的建立,不仅需要选择合适的外植体,同时培养基的选择和所诱导出的愈伤组织的状态也是能否成功建立再生体系的关键因素[10]。芒属植物愈伤组织的诱导和胚性愈伤组织的形成取决于外植体的类型和发育阶段[11]。目前芒属植物不同外植体诱导愈伤组织的研究已有相关报道,主要以种子[12]、腋芽[13-15]、花药[16]、幼穗[15,17]、叶片[11]等为外植体进行了再生体系的建立。但Holme和Petersen[11]以叶尖、叶片、根系以及未成熟的花序,研究了不同外植体诱导出愈伤组织再生能力间差异,发现以幼穗为外植体建立再生体系效率最高,而以长度为0.1~2.5 cm幼穗为外植体的愈伤组织诱导率明显高于长度为2.6~5.0 cm较成熟花序[17]。Chae等[18]在构建荻再生体系时,同样认为幼穗为外植体的最佳选择。
现有报道表明,不同的激素组合对荻再生的影响不同,选用紫色、紫褐色愈伤组织构建再生体系最佳,黄绿色愈伤组织次之,其紫褐色愈伤诱导率为59.20%[19]。进一步研究表明,紫褐色愈伤组织形成早,通过进一步继代得到的淡黄色致密愈伤组织效果最佳,能够成功分化且分化率可达75.00%[20]。而Katarzyna[21]在构建荻植株再生体系时则发现白色致密愈伤组织分化率最高,该结论与Zhao等[22]报道一致。综合现有报道表明,幼穗为构建芒属植物再生体系的最佳选择,通过幼穗诱导愈伤组织可以获得不同类型的愈伤组织,然而不同类型愈伤组织的愈伤组织诱导率、分化率、再生率等方面在不同的报道中存在明显的差异。
本研究以采集自滨海盐碱地的耐盐荻资源的幼穗为外植体,以MS为基本培养基,分析不同激素组合对荻愈伤组织诱导、分化、生根的影响,进一步对从荻外植体中诱导出不同状态愈伤组织之间的差异进行研究,从而建立高效再生体系并明确荻再生体系建立的最佳愈伤组织类型,为构建高效遗传转化体系进行荻种质改良提供基础和必备条件。
1 材料与方法
1.1 试验材料
供试的荻资源材料于2008年采自山东省东营市(37°43′ N, 119°01′ E)的滨海盐碱地中 (土壤可溶性盐含量为0.6%),现种植于江苏省中国科学院植物研究所草业研究中心试验基地 (32°02′ N, 118°28′ E),材料在自然条件下保存和繁殖。
1.2 试验方法
以荻幼穗为外植体建立其再生体系的方法主要参考YI等[23],略加改进。
1.2.1 外植体的处理
外植体选取正在生长发育中的幼穗,在试验地将幼穗取下后立即放入存有冰袋的保温盒中进行低温保存带回实验室,在佳宝JB-CJ-1FD洁净工作台上将幼穗放入1.0%的氯化汞中浸泡2 min后用无菌水冲洗3次,确保洗掉氯化汞残留,再用75%的酒精浸泡1 min后用无菌水冲洗3次,确保洗掉酒精残留。将灭菌完毕的幼穗放置在无菌滤纸上,吸干外植体表面水分,并将其剪成2.5 cm的小段后,剥离幼穗外叶鞘和苞叶后备用。
1.2.2 愈伤组织诱导
将剥离的幼穗接入高10.5 cm、底径6.5 cm、口径5.5 cm的组培瓶中,每瓶含有30 mL灭完菌的愈伤诱导培养基,培养基为MS + 30.0 g·L-1蔗糖 +0.72 g·L-1脯氨酸 + 1.0~3.0 mg·L-12,4-D + 0.01~0.1 mg·L-16-BA + 3.0 g·L-1植物凝胶,pH 5.8~6.0。接种后材料放置于培养室中进行暗培养,温度控制在(25 ± 1)℃。每100节幼穗作为一个重复,每个处理3个重复,3 d观察一次,30 d后统计不同培养基诱导的愈伤组织的数量,并统计最佳愈伤培养基上不同类型愈伤组织的数量。
1.2.3 愈伤组织继代
待愈伤长到直径1~1.5 cm时,进行继代操作。继代时,用镊子取出不同类型愈伤组织放至无菌滤纸上,并用镊子将其解离成0.4~0.5 cm大小的愈伤块,分别接入高10.5 cm、底径6.5 cm、口径5.5 cm的组培瓶中,每瓶含有30 mL灭完菌的继代培养基,培养基为 MS + 30.0 g·L-1蔗糖 + 1.44 g·L-1脯氨酸 + 3.0 mg·L-12,4-D + 0.1 mg·L-16-BA + 3.0 g·L-1植物凝胶,培养条件与愈伤诱导时相同。每39块愈伤作为一个重复,每种类型愈伤3个重复,28 d继代一次,继代后统计不同类型愈伤的数量。
1.2.4 愈伤组织分化
选取不同类型的愈伤组织接入高10.5 cm、底径6.5 cm、口径5.5 cm的组培瓶中,每瓶含有30 mL灭完菌的分化培养基,分化培养基为MS + 30.0 g·L-1蔗糖 + (1.0~4.0) mg·L-16-BA + (0.5~1.0) mg·L-1NAA +7.0 g·L-1琼脂,pH 5.8,放置于培养室中进行24 h光照培养,光照强度为 100 μmol·(m·s)-1,温度 为(25 ± 1) ℃。每100个愈伤作为一个重复,每个处理3个重复,5 d观察一次,30 d后统计不同培养基上不同类型的愈伤能够分化的愈伤数量。
1.2.5 生根
待分化苗长至3~5 cm高后,将由不同类型愈伤组织分化得到的分化苗分别接入高10.5 cm、底径6.5 cm、口径5.5 cm的组培瓶中,每瓶含有30 mL灭完菌的生根培养基,生根培养基为1/2 MS + 0.5 mg·L-1NAA + 7.0 g·L-1琼脂,pH 5.8~6.0[24]。培养条件与愈伤分化时一样。每30株分化苗作为一个重复,每种类型愈伤组织分化得到的分化苗3个重复,3 d观察一次,21 d后统计其生根苗数量。
1.2.6 炼苗与移栽
待无菌苗根长2~3 cm时,可进行炼苗处理。炼苗时,打开培养瓶瓶盖,加入1 cm高的自来水,放置于培养室中光照培养,温度控制在(25 ± 1) ℃,每天定时换水。培养3~4 d后,小心取出无菌苗,用自来水洗去附着于无菌苗根部的培养基后,种植于装有蛭石(将蛭石提前放于100 ℃ 的烘箱中烘干24 h)的穴盆(口径10 cm、高9.5 cm)中。适当浇水,保持土壤湿润。放置于赛福PGX-280L型恒温光照培养箱中培养,培养温度设置为(25 ± 1) ℃,12 h光照培养,12 h暗培养,每30株作为一个重复,每种类型愈伤组织分化得到的分化苗3个重复,20 d后以植株直立、新叶长出、长势健壮为成活标准,统计其成活数量。
1.3 数据处理
各个指标具体计算方法如下:愈伤诱导率=产生的愈伤组织数/接种的外植体数 × 100%;愈伤增殖系数 = 继代后愈伤数/继代前愈伤数 × 100%;愈伤分化率 = 分化的愈伤数/接种总愈伤数 × 100%;生根率 = 生根分化苗数/接种总分化苗数 × 100%;成活率 = 成活的分化苗数/总移栽分化苗数 × 100%。
以上各项指标的实测值分别按照上述进行计算,用Excel 2000进行数据处理,然后用SPSS 13.0对所有数据进行方差分析,并用Duncan法进行多重比较。
2 结果与分析
2.1 愈伤组织诱导
以荻的未成熟花序作为外植体,消毒后接种于含有不同浓度的6-BA和2,4-D的MS基础培养基上,观察不同激素浓度及配比对其愈伤组织诱导的影响。不同激素组合对荻的愈伤组织的诱导率明显不同,愈伤组织诱导率最高的培养基为MS +30.0 g·L-1蔗糖 + 0.72 g·L-1脯氨酸+ 3.0 g·L-1植物凝胶+ 3.0 mg·L-12,4-D + 0.1 mg·L-16-BA,其愈伤组织诱导率可达到99.67%(表1)。
通过对最佳愈伤组织诱导培养基上诱导出的愈伤组织观察发现,所诱导出的愈伤组织大致可分为4类:Ⅰ类愈伤组织呈黄色、颗粒明显、结构致密。该类愈伤组织诱导率最低,仅有7.01%(图A1、表2);Ⅱ类愈伤组织呈白色、颗粒明显、质地较硬,愈伤组织诱导率为61.92%(图A2、表2),是所诱导出的愈伤组织类型中诱导率最高的;Ⅲ类愈伤组织呈紫红色、质地较为松软、不明显颗粒状,愈伤平均诱导率为21.02%(图A3、表2);Ⅳ类愈伤组织呈透明、质地极为松软、不具颗粒结构,该类愈伤平均诱导率为9.72%(图A4、表2)。
2.2 愈伤组织继代
一般情况下,继代培养基与愈伤诱导培养基基本一致,而本研究继代培养基参考Christian 等[25]的方法,在愈伤诱导培养基的基础上将脯氨酸的用量调整至1.44 g·L-1。通过对最佳愈伤诱导培养基所诱导的不同类型的愈伤组织进行继代后发现,不同类型的愈伤组织增殖系数存在较大的差异(表3),其中紫红色愈伤组织的增殖系数是所有类型愈伤组织中最高的,平均可达到299.96%,与白色愈伤组织差异不显著(P> 0.05),但显著高于其他两类愈伤组织(P< 0.05)。白色愈伤组织增殖系数略低于紫红色愈伤组织,平均为270.82%,但显著高于其他两类愈伤组织。无色透明愈伤组织和黄色愈伤组织的增殖系数显著低于上述两类愈伤组织,分别为199.76%和187.10%。
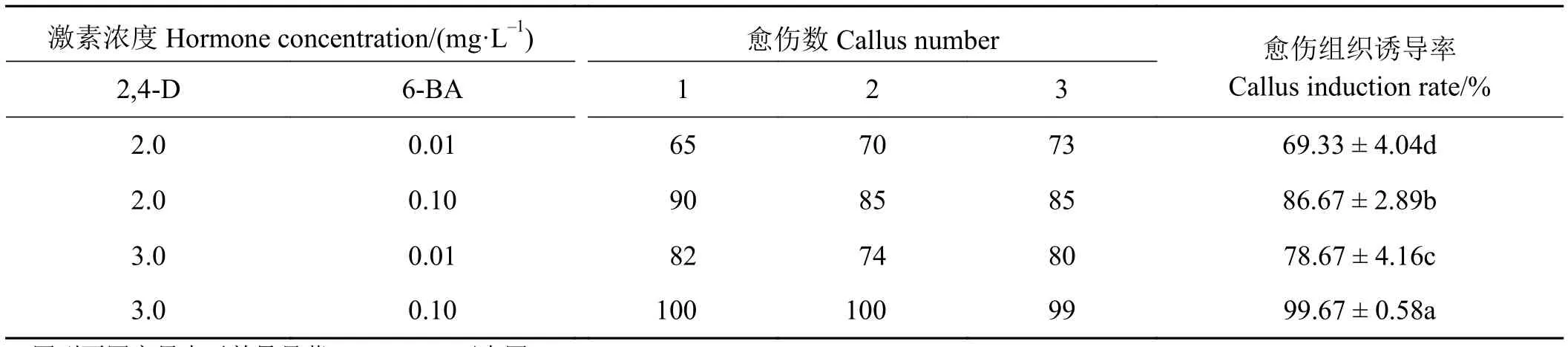
表1 不同激素组合对愈伤诱导率的影响Table 1 Effects of different hormone combinations on callus induction rate
2.3 愈伤组织分化

图1 荻幼穗诱导出的不同愈伤组织再生过程Figure 1 Photographs of the tissue culture regeneration process in different types of callus induced from immature inflorescences of Miscanthus sacchariflorus
植物愈伤组织的分化率很大程度上取决于生长调节剂的配比[26]。本研究以MS + 30.0 g·L-1蔗糖+7.0 g·L-1琼脂为基础培养基,通过添加不同浓度的6-BA和NAA(表4),将不同类型愈伤组织分别接种于不同的愈伤组织分化培养基上并分析其愈伤组织分化情况,以明确不同类型愈伤组织的分化能力及最适宜的分化培养基。第Ⅰ类愈伤组织在不同愈伤组织分化培养基上均有一定的分化率,最适于该类愈伤组织分化的激素组合为2.0 mg·L-16-BA +0.5 mg·L-1NAA,其分化率高达93.16%,而其他激素组合下的愈伤组织分化率均低于85.00%,当激素组合为 4.0 mg·L-16-BA + 1.0 mg·L-1NAA 时,愈伤组织分化率最低,仅有40.17%。第Ⅱ类愈伤组织在不同激素组合的愈伤分化培养基上的分化情况与第Ⅰ类愈伤组织的分化情况类似,在不同的愈伤组织分化培养基上均有一定的分化率,其最佳分化培养基的激素组合同样为2.0 mg·L-16-BA +0.5 mg·L-1NAA,达到 90.60%,而在 4.0 mg·L-16-BA + 1.0 mg·L-1NAA的激素组合时分化率最低,为43.59%,该类愈伤组织最高分化率略低于第Ⅰ类愈伤组织。第Ⅲ类愈伤组织在各个愈伤组织分化培养基上也都具有一定的分化能力,但均明显低于第Ⅰ类和第Ⅱ类愈伤组织,其愈伤组织的最高分化率仅有29.91%,同时在分化过程中发现该类愈伤组织产生了大量的不定根,说明此类愈伤具有一定的分化能力,但是其愈伤组织状态并不理想。第Ⅳ类愈伤组织在所有的愈伤分化培养基上的分化率均为0,说明此类愈伤组织没有分化能力。
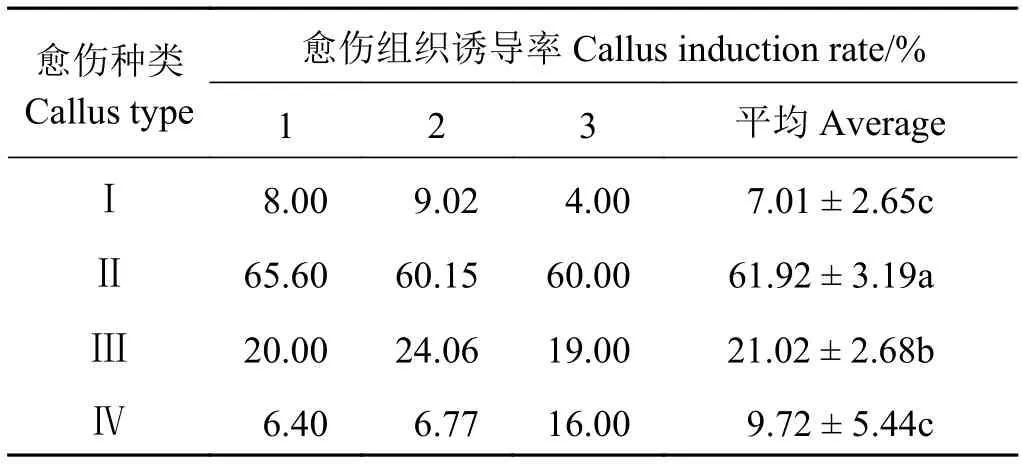
表2 最佳愈伤诱导培养基上不同类型愈伤组织的诱导率Table 2 Callus induction rate on optimum callus induction medium
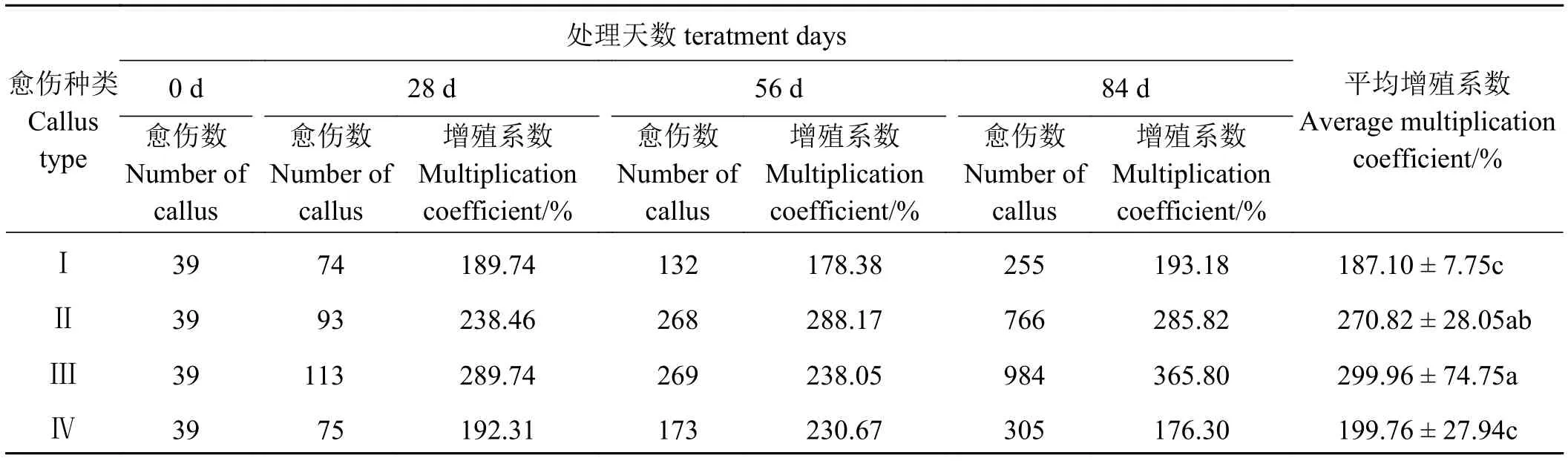
表3 不同类型愈伤组织的增殖系数Table 3 The multiplication coefficient of different type of callus
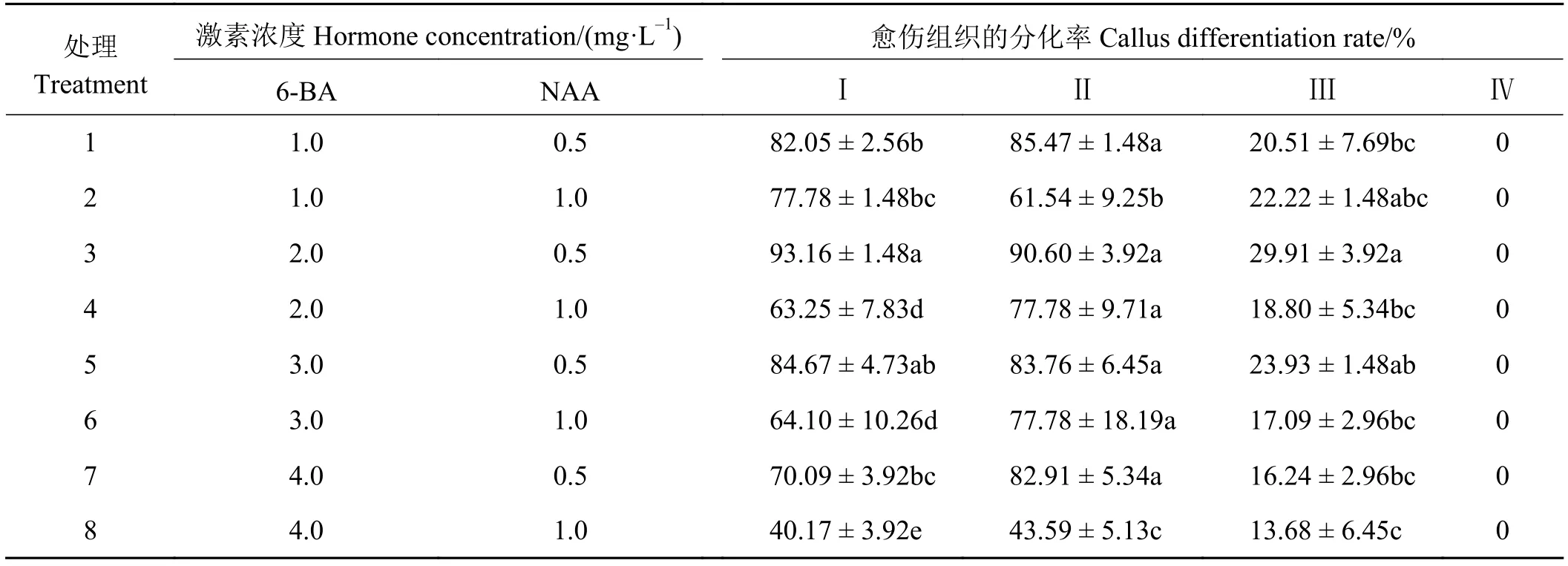
表4 激素类型和浓度对不同类型愈伤组织分化率的影响Table 4 Effect of hormone and concentration on callus differentiation rate
上述结果表明,4类愈伤组织中除了第Ⅳ类愈伤组织外,其他3类愈伤组织均具有一定的分化能力,也就是说除了第Ⅳ类愈伤组织外,其他3类愈伤组织均为具有分化能力的愈伤组织,而这3类胚性愈伤组织虽然在分化能力上有一定的差异,但是其分化率最高的激素组合均为2.0 mg·L-16-BA +0.5 mg·L-1NAA,表明此激素组合为荻愈伤组织的最佳分化培养基。
2.4 生根与移栽
将生长至2~3 cm高的丛生芽用镊子小心分成单株后,接入生根培养基中进行生根培养,由3种类型愈伤组织诱导出的丛生芽在培养7 d后均开始长出健壮的不定根,20 d后生根率均为100%,且在生根速度和数量方面无明显差异。而后将经过3 d炼苗后的无菌苗小心取出并洗去培养基,移栽于花盆中后放置于25 °C 恒温光照培养箱中培养20 d,移栽成活率达到100%。
3 讨论与结论
本研究选用采自滨海盐碱地的荻种质资源的幼穗为外植体,通过对诱导出的4种不同类型愈伤组织在愈伤组织诱导、分化、生根和移栽等方面进行比较分析,探究所诱导出不同类型愈伤组织之间的差异,从而充分挖掘所诱导出的不同类型愈伤组织的用途,最大限度的提高荻再生效率,不仅成功构建了一套高效的荻植株再生体系,也为荻优良种质的繁育和遗传改良奠定了基础。
选择最佳的基本培养基是进行愈伤组织培养的一个重要方面,研究表明,MS是进行荻愈伤组织诱导的最佳基本培养基之一[27-29]。因此,本研究也采用了MS培养基作为愈伤组织诱导、继代、分化的基本培养基。而不同激素组合对荻愈伤组织的诱导率影响不同,在禾本科植物的愈伤组织诱导中,2,4-D通常是起决定作用的植物生长调节剂,2,4-D与6-BA配合使用不仅能够提高愈伤组织的诱导率,而且对胚性愈伤组织的形成具有明显的促进作用[27-28,30]。现有的报道表明,2,4-D和6-BA也是进行荻愈伤组织诱导中最常用的两种激素[21,31]。在使用荻幼穗作为外植体诱导愈伤组织时添加适量的脯氨酸,可以显著降低外植体的褐变,减轻培养基的褐化,大大降低褐化对愈伤组织诱导的影响[32]。0.1 mg·L-16-BA是荻诱导愈伤组织时的最佳浓度[30],因此6-BA含量为0.1 mg·L-1时,本研究通过添加3.0 mg·L-12,4-D获得了99.67%愈伤组织诱导率,其胚性愈伤组织诱导率也明显提升,虽然有报道认为,2,4-D浓度的差异对愈伤组织诱导、胚性愈伤组织形成和植株再生无显著影响[11],但该结果明显异于大多数相关报道[17,19-20,33]。
在进行愈伤组织诱导的过程中,一般情况下都会发现所诱导出的愈伤组织的状态会有所差异,最典型的就是诱导出黄色胚性愈伤组织和透明非胚性愈伤组织。大量的报道发现,在芦竹(Arundo donax)[34]、金荞麦(Fagopyrum dibotrys)[35]、毛竹(Phyllostachys edulis)[36]、甘蔗 (Saccharum officinarum)[37]等植物愈伤组织诱导过程中,不仅仅只有上述两类愈伤组织,还会出现白色、紫红色、紫褐色、绿色等不同类型的愈伤组织,而这些愈伤组织很多也是具有分化能力的。芒属植物中同样存在诱导出不同类型愈伤组织的现象[20,32,38-39]。而本研究中也发现,以荻幼穗为外植体所诱导出的愈伤组织形态各异,大致可以将愈伤组织分为4类:Ⅰ类愈伤组织呈黄色,该类愈伤组织的几诱导率仅有7.01%;Ⅱ类愈伤组织呈白色,愈伤平均组织诱导率为61.92%,是所诱导出的愈伤组织类型中诱导率最高的。Ⅲ类愈伤组织呈紫红色,愈伤平均诱导率为21.02%;Ⅳ类愈伤组织,该类愈伤平均诱导率为9.72%。
大量的研究主要集中于不同的激素组合、基本培养基和愈伤组织继代培养条件对于愈伤组织增殖系数的影响[40-42],而对荻不同类型愈伤组织增殖系数方面的研究目前还未见报道。而本研究则针对愈伤组织诱导情况,对诱导出的不同类型愈伤组织的继代增殖情况进行了研究,发现其存在显著差异,紫红色愈伤组织和白色愈伤组织的增殖系数极高,分别达299.96%和270.82%,浅紫色愈伤组织增殖能力强已经在现有报道中得到了认同[22,39]。也就是说,在相同基数的情况下,紫红色愈伤组织和白色愈伤组织更有利于建立荻高效再生体系。
植物生长调节剂对愈伤组织的分化起着决定性的作用[18]。在参考大量芒属植物再生体系构建的基础上,本研究中设置了8种不同浓度梯度2,4-D和6-BA的分化培养基组合,结果表明,当6-BA浓度高于3.0 mg·L-1时,对愈伤组织的分化率抑制明显,这与先前报道高水平的6-BA将会引起愈伤组织褐化[24]的结果基本一致。在结合使用NAA和6-BA诱导愈伤组织分化时,当NAA的浓度高于1.0 mg·L-1时,愈伤组织会迅速长出大量不定根,抑制芽的分化[43-44],最适合芒属植物分化的NAA浓度为0.5 mg·L-1[16]。本研究发现,从荻幼穗中诱导出具有分化能力的3类愈伤组织,在不同的激素组合诱导分化时,分化率存在一定差异,但均在激素组合为2.0 mg·L-16-BA和0.5 mg·L-1NAA时,愈伤组织分化率最高。王子岚等[32]和王青云等[24]报道的选择亮黄色、生长良好且质地紧密的愈伤组织转接到继代培养基上分化率和生根率均最高。而何立珍等[20]也认为,选用明黄色、颗粒明显、结构紧密的愈伤组织的愈伤分化率较好,但是其主要通过对诱导率最高的紫色愈伤组织进行调整,促使紫色愈伤组织逐渐转变为淡黄色更具分化潜力的致密愈伤组织,筛选新形成的淡黄色愈伤组织诱导分化,从而获得再生植株。本研究也发现,所有愈伤组织中黄色愈伤组织的分化率最高且状态稳定,虽然该类愈伤组织的增殖系数最低,但在时间允许的情况下进行大量扩繁,可用于进行荻遗传转化和种质改良工作。顾振惠等[19]则直接使用紫色、紫褐色愈伤组织构建再生体系,更侧重于紫色、紫褐色愈伤组织形成早、分化快的特点,而本研究同样发现,紫红色愈伤组织增殖系数最快,可以在短期内获得大量愈伤组织,虽然其分化率相对较低,但是仍可达到缩短荻再生的周期并快速获得再生植株的目的。而本研究中得到数目最多的白色愈伤组织则尚未有人进行深入研究,本研究认为,白色愈伤组织也是胚性愈伤组织,在继代和分化后,虽然分化率略低于黄色愈伤组织,但是其分化率仍大于90.00%,该类愈伤组织状态稳定,诱导率高,增殖系数明显高于现有报道最多的黄色愈伤组织,采用该类愈伤组织所构建的再生体系,不仅可以作为优良种质大量繁育的首选愈伤组织类型,而且也是进行荻遗传转化和种质改良工作的最佳愈伤类型。
本研究以荻幼穗为外植体,最佳愈伤组织诱导培养基为 MS + 30.0 g·L-1蔗糖+ 0.72 g·L-1脯氨酸+3.0 mg·L-12,4-D + 0.1 mg·L-16-BA + 3.0 g·L-1植物凝胶,可诱导出4种类型的愈伤,分别为黄色愈伤、白色愈伤、紫红色愈伤、透明水渍状愈伤,4种愈伤的诱导率分别为7.01%、61.92%、21.02%和9.72%,愈伤总诱导率为99.67%;最佳分化培养基为MS +30.0 g·L-1蔗糖+2.0 mg·L-16-BA + 0.5 mg·L-1NAA +7.0 g·L-1琼脂,其中黄色愈伤、白色愈伤和紫红色愈伤均为胚性愈伤组织,其分化率分别为93.16%、90.60%和29.9 1%;采用1/2 MS + 0.5 mg·L-1NAA +7.0 g·L-1琼脂作为生根培养基时,3种胚性愈伤组织所分化的再生植株的生根率均达到100%;将再生植株经过炼苗后,移栽于以消毒蛭石为基质的小花盆中,20 d后所有移栽苗全部成活。
不同类型的愈伤组织的诱导率、增殖系数、分化率等方面均差异明显。黄色愈伤组织的分化率最高且状态稳定,虽然该类愈伤组织的增殖系数最低,但在时间允许的情况下进行大量扩繁,可用于进行荻遗传转化和种质改良工作;紫红色愈伤组织形成早、分化快、增殖系数最快,可以在短期内获得大量愈伤组织,缩短荻再生的周期并快速得到再生植株;白色愈伤组织诱导率高,增殖系数明显高于黄色愈伤,不仅可以作为优良种质大量繁育的首选愈伤组织类型,而且也是进行荻遗传转化和种质改良工作的最佳愈伤类型。
