CLIA法、PA法与IFA法测定肺炎支原体的对比分析
2019-09-02余朝晖钮博金强吴江
余朝晖 钮博 金强 吴江
肺炎支原体(mycoplasma pneumoniae,MP)是最小的原核生物,它介于细菌和病毒之间,形态较为多样,但基本为圆球形,也可呈杆状或丝状[1]。在临床检验的工作中由于肺炎支原体不具备较大的特异性,进行检验时要与其他多种病原微生物进行检验甄别较为困难,在临床上肺炎支原体检验的诊断依据性又非常高[2]。由于MP 感染的治疗方案与其他细菌感染和病毒感染不同,区分是否为支原体感染对临床治疗有指导作用,支原体肺炎并无典型的临床体征[3]。在发病初期,甚至有些患者和健康人的体征并无差异,部分患者有咽痛、发热、头痛等症状,与有些患者的呼吸道症状基本没有差别,但是肺炎支原体感染病程较长且有反复发作的特点。本研究选取本院自2018 年5 月引进深圳亚辉龙化学发光免疫分析仪和以往使用的安图IFA 法和日本富士瑞必欧株式公社的被动凝集法检测肺炎支原体抗体。
1 资料与方法
1.1 一般资料
选取2018 年5—8 月到本市四家医院共同采集疑似肺炎支原体肺炎标本,其中男性48 例,女性48 例,年龄分布在1月~80 岁之间,平均年龄(46.5±6.5)岁。早晨空腹抽静脉血3 mL,置于3 500 r/min 转离心力,离心10 min,取上层血清作为标本。
1.2 检测试剂
采用深圳亚辉龙生物科技有限公司提供MP-IgG 和MP-IgM 试剂(批号:C88004M,C88003G),富士瑞必欧株式会社的被动凝集试剂盒(批号:wp80316),西班牙vircell 公司生产的试剂盒(安图),应用IFA 对MP-IgM 进行测定(批号:18M215)。
1.3 检测设备
深圳亚辉龙化学发光免疫分析仪YHLO iFlash 3000,Olympas-BX43F 荧光显微镜。
1.4 结果判断
校准,校准范围0.01au/mL~300.0au/mL,每一盒IFLash M.pneumoniaIgG、IgM 都有一个二维码标签,内含该批次试剂所需要的校准信息。在执行IFlash M.PneumoniaIgG 校准时,重复CLIA1、CLIA2 和CLIA3 预置的主校曲线,将根据测试结果,对测定进行校准。而IgM 校准时只重复CLIA1 和CLIA2 两个点,来进行校准,在校准时超过28 天,试用新批号试剂盒,质控值超过规定范围,需要重新校准。化学发光免疫法测定IgM(≤0.09au/mL)、IgG(≤24au/mL)为阴性,大于各数值为阳性。被动凝集发的效价≥40 判断为阳性,否则判断为阴性。IFA 法以40%以上mccoy 细胞出现典型膜齿荧光的为阳性。
1.5 统计学方法
本研究数据采用SPSS 19.0 软件统计,方法学一致性采用χ2检验,以P<0.05 表示差异有统计学意义。计算Kappa 系数(Kappa>0.7 为一致性良好,0.4 <Kappa ≤0.7 为中等程度一致性,Kappa ≤0.4 为一致性较差)。
2 结果
2.1 CLIA 法与PA 法比较
CLIA 法与PA 法不区别抗体分型检测96,实验结果见表1,经配对χ2=101.2,P<0.05,差异有统计学意义。并以四方表格法,以公式[N(A+D)-(R1C1+C2R2)]/ [N2-(R1C1+C2R2)],求得kappa 值等于0.563。
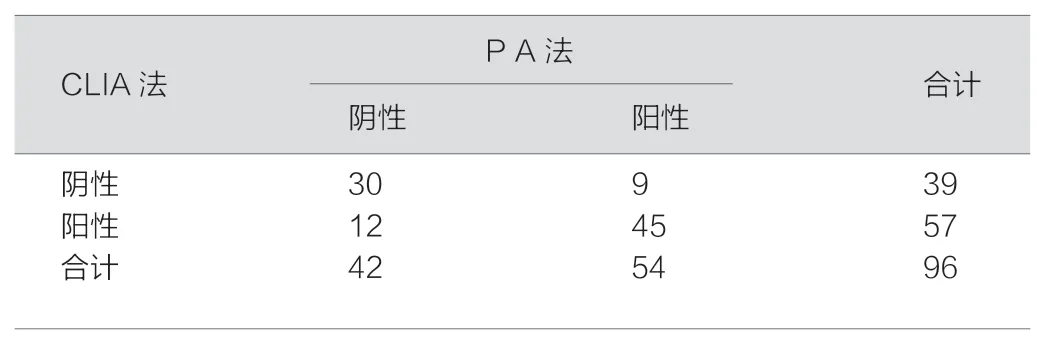
表1 CLIA 法与P A 法检测MP 抗体的结果(例)
2.2 CLIA 法和IFA 法比较
CLIA 法和IFA 法分别对96 例样本进行MP-IgM 抗体检测,经过SPSS 19.0 配对χ2=63.025,P<0.05,差异有统计学意义,并以四方表格法,以公式[N(A+D)-(R1C1+C2R2)]/ [N2-(R1C1+C2R2)],求得kappa 值等于0.81,其结果见表2。

表2 CLIA 法和IFA 法检测IFA-IgM 抗体的结果(例)
2.3 CLIA 法检测分型抗体和PA 法比较
CLIA 法测得IgM 和IgG 同时为阳性时,测得共有27 例样本,再经PA 法测得,均为阳性,符合率100%。CLIA 法测得IgG 阳性的标本51 例,经PA 法测得阳性为39 例,阴性12 例,计算公式为a/ a+c,阳性符合率76.5%。CLIA 法测得IgM 抗体阳性的标本36 例,再同时用PA 法检测的阳性为30 例,阴性为6 例,阳性符合率为83.3%。
3 讨论
PA 法和IFA 法是目前临床检测MP 抗体的主要方法[4]在检测方法方面,PA 法无法检测分型抗体;IFA 法需要配备专用荧光显微镜和受主观判断[5],CLIA 法与PA 法及IFA 法检测MP,通过Kappa 系数来判断方法学的一致性,Kappa >0.7 为一致性良好,0.4 <kappa ≤0.7 为中等一致性,kappa ≤0.4 为一致性差,通过上述结果可以判断CLIA 和PA 法的Kappa 值为0.563,中等一致性,但在IgG 和IgM 都为阳性时,和PA 法的阳性一致性为100%,CLIA 法分型测定MP-IgM 和IFA 测得MP-IgM 抗体,两者方法的一致性Kappa 值为0.81,说明两者的一致性较好。CLIA 法与PA 法结果不一致的原因很多,PA 法测的是总抗体,不但包括IgG 和IgM,可能还包括IgA[6]。因机体内IgG 占所有免疫球蛋白的75%,是免疫球蛋白的主要成分,其存在时间较长,免疫应答时间更加持久(更显著促进巨噬细胞吞噬能力),而IgA 抗体占血清含量仅次于IgG,其分泌型IgA 广泛存在于口腔及呼吸道分泌液[7]。PA 法受主观判断的因素影响,日本瑞必欧的被动凝集法在方法学上和化学发光法存在一定的差异,不具备分型的特异性,而且需要人工加样、稀释和孵育,操作步骤繁杂,实验时间较长。IgM 阳性是早期感染的标志,IgG 阳性是既往感染的标志,IgM 和IgG 同时阳性是急性感染的标志[8]。特异IgM 在感染后1 周即可出现,在感染后3 周达到高峰,对早期诊断更有价值,发生肺炎支原体感染的成年患者,特异性IgM 可持续阴性,因此,即使肺炎支原体特异性IgM 多次阴性,也不能排除肺炎支原体急性感染,单次MP-IgM 抗体滴度I >1 ∶160,对MP 近期感染或急性感染有诊断价值,恢复期和急性期双份血清MP-IgM 或IgG 抗体滴度呈4 倍或4 倍以上时,同样可确诊为MP 感染[9]。另有两例样本CLIA 法检测MP-IgG 大于200 au/mL,显著增高,MP-IgM 阴性,PA 法测得为阴性,主要是从两个方面分析,如果是成人有临床症状,IgM 阴性、IgG 高时需评估是否为IgM 阴性的患者,血清中的IgM 是由5 个单体通过一个J 链和二硫键连接成的五具体,分子量为970 KD。而血清中的IgG、IgM 抗体均为受到外源物质(细菌、病毒)感染后由B 细胞识别后产生,随着年龄增长及免疫系统的完善,记忆B 细胞减少,使相关的免疫球蛋白M 逐渐消失,被IgG、IgA 等取代。婴幼儿由于免疫功能不完善、产生抗体的能力较低,可能出现假阴性或低滴度的抗体,因此评价结果时需要结合患儿的病程及年龄综合考虑[10]。抗体产生时间及在体内的持续时间是检出的关键[11]。例如在链球菌感染的过程中抗体产生也会出现IgM 不出现的情况,整个免疫应答过程和肺炎支原体感染类似[12]。另一方面,如果无临床症状,IgM 阴性、IgG 高时需要考虑是否处于免疫恢复期,而IgG 一但感染后会在人体内长期存在,即使恢复,不同人免疫应答强弱不同,在体内长期存在的浓度水平也是有差异的,在被动凝集法的说明书上也是没有标注分型,所以在检测过程中是包含了IgG、IgM、IgA 等抗体亚型,因总抗体检测中含量和分型不完全相同,可能导致日本富士凝集法整体结果阴性而分抗阳性的情况。另外就是实用的化学发光设备本身在工艺上加入了亲和素等提高敏感性的工艺,所以对于抗体的检测比较敏感。
综上所述,可见分型抗体的检测在肺炎支原体感染时期的重要性,结合PA 法更能有效确诊疑似肺炎支原体的感染。而化学免疫发光法操作简单,具有高特异性,试剂和方法都比较稳定,并且能够测出MP 的分型抗体,为早期急性肺炎支原体患者提供更好的诊断依据,从而为临床阶段性治疗提供更好的实验室数据,在临床中进行肺炎支原体检验时要积极根据需要在保证检验质量的基础上采取操作简便且周期较短的检验技术[13],为肺炎支原体患者科学合理治疗赢得时间。
