蒲公英皂苷体外抗炎作用及对NF-κB信号通路的调控
2019-09-02权伍荣管晓辉沈明浩
权伍荣, 夏 炎, 管晓辉, 董 然, 沈明浩*
(1.延边大学农学院,吉林 延吉 133002;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
蒲公英(TaraxacummongolicumHand.Mazz.)别名婆婆丁、黄花地丁、黄花苗等,为菊科蒲公英属多年生草本植物[1]。我国蒲公英种类有70多种,东北占有11种,在各地区分布广泛,其中内蒙、东3省、甘肃等地生长居多,主要生长在山坡草地、路旁及田野处[2]。蒲公英在药物、食品、饲料等方面的应用普遍,并具有一定的观赏价值[3],因其具有利胆、利尿和抗炎等药用价值而长期被用于民间医药治疗肝脏疾病和一些妇科疾病,如乳腺癌和子宫癌等[4-5]。
炎症是由白细胞、细胞和肥大细胞产生的各种不同信号分子介导的复杂的病理生理过程[6],表现为对组织损伤的一种防御反应,其表现为血流量增加导致组织温度升高、发红、肿胀和疼痛[7-8]。可通过各种不同的刺激引发,包括物理损伤,化学品,微生物的入侵和免疫反应[9-11]。在炎症性疾病中有许多发炎症介质参与并发挥重要作用,如一氧化氮(NO)、前列腺素(PG)E2和促炎细胞因子,肿瘤坏死因子TNF-α及白细胞介素IL-6等,用来消除有害刺激,以及愈合和修复受损组织的过程。越来越多的证据表明,炎症介质失调与多种疾病的发病有关,包括充血性心力衰竭(CHF)、冠状动脉粥样硬化(AS)和阿尔茨海默病(AD)等[12-15]。
现今,西药仍是常用的抗炎药物,即甾体类抗炎药如地塞米松、氢可的松等和非甾体类抗炎药如阿司匹林、保泰松等,虽然西药抗炎效果明显,但副作用也极大,长期服用会造成肝肾、胃肠损伤等副作用。因此,寻找副作用低且效果明显的抗炎抗免疫的中药已成为热门的研究方向。
该试验以长白山野生蒲公英为原料,提取蒲公英皂苷并纯化,以LPS刺激小鼠RAW264.7细胞建立体外炎症模型,对蒲公英皂苷的抗炎效果及其相关作用机制进行研究,为今后有关蒲公英皂苷的抗炎及其机理的研究提供参考依据。
1 材料与方法
1.1 材料与试剂
RAW264.7小鼠巨噬细胞为军事医学科学院军事兽医研究所刘文森研究员惠赠。
LPS、MTT(美国Sigama公司);DMSO(北京化工厂);RPMI1640培养液、胎牛血清、胰酶(美国Gibco公司);TNF-α、IL-6细胞因子ELISA试剂盒(美国BioLegend公司);RNA提取试剂盒、反转录试剂盒、鼠二抗、兔二抗[生工生物工程(上海)股份有限公司];细胞蛋白抽提试剂盒、BCA蛋白定量试剂盒(长春鼎国生物科技公司);β-肌动蛋白(ab8226)、IκB-α、P-IκB单克隆抗体(英国Abcam公司);鲁米诺化学发光试剂盒(美国CE公司)。其余试剂均为国产分析纯试剂。
1.2 仪器与设备
HVE-50型高压蒸汽灭菌锅(日本Hirayama公司);BB150型CO2培养箱(美国Thermo公司);Sorvall Legend Micro 21型高速冷冻离心机(德国Thermo公司);DW-86L386型超低温冰箱、HR40-ⅡA2型生物安全柜(青岛海尔有限公司);G1000基因扩增仪(杭州博日科技有限公司);Infinite F500型多功能高端酶标仪(奥地利Tecan公司);Trans-Blot SD型转印槽(美国Bio-Rad公司);AlphaImager HP高端凝胶成像系统(美国Alpha Lnnotech公司);CKX31倒置显微镜(日本Olympus公司)。
1.3 方法
1.3.1 蒲公英粗皂苷的提取
取200 g蒲公英全草放入50 ℃干燥箱内烘干,用超微粉碎机将烘干后的蒲公英进行粉碎,再制成约35 g的蒲公英粉末滤纸包,添加8倍量的95%乙醇溶液浸泡处理1 h,加热回流提取1 h,过滤;重复3次后合并滤液,再将滤液通过旋转蒸发使其浓缩,回收乙醇。将得到的浓缩液通过石油醚萃取脱脂,再用正丁醇萃取得到的水相部分,最后用旋转蒸发仪浓缩合并的提取液至500 mL,备用。
1.3.2 蒲公英皂苷的纯化
试验采用D101型大孔吸附树脂对蒲公英皂苷进行纯化,先用95%的乙醇将D101型大孔吸附树脂浸泡24 h,采用湿法装柱,将树脂用95%的乙醇冲洗直至不产生白色混浊并且流出液与水混合比例为1∶2,最后用大量水冲洗,直至没有乙醇味为止。树脂用量为8倍的皂苷上样量。先用蒸馏水洗脱,然后用70%的乙醇洗脱,洗脱流速2 mL/min,收集洗脱液并浓缩。
1.3.3 皂苷含量测定中标准曲线的绘制
分别移取0.2 mg/mL的人参皂苷Rb1标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL置于7支试管中,加水至2.0 mL。在535 nm处测吸光值,以人参皂苷标准品浓度为横坐标,以吸光值为纵坐标,绘制标准曲线,计算得出回归方程为:
y = 24.82x-0.000 24,R2=0.998 0。
1.4 细胞培养
将RAW264.7 细胞用含8% 胎牛血清的1640培养基,在37 ℃、5%的CO2恒温培养箱中进行常规培养。
1.5 MTT
将RAW264.7细胞,加入细胞浓度为7×104个/mL于96孔板中,每孔100 μL,放入CO2培养箱中培养过夜。吸去原培养液,根据实验设计加入不同浓度的蒲公英皂苷溶液,每孔100 μL,设4个复孔,放入CO2培养箱中培养20 h,取出加入10 μL浓度为5 μg/μL的MTT试剂,继续培养4 h。吸去原培养液,加入100 μL/mL DMSO,摇床摇晃5~10 min,于490 nm处测定各孔吸光值(OD 值)。
1.6 Griess reagent法测定NO的含量
试验将蒲公英皂苷浓度设置为5个组别,分别为空白对照组、LPS(100 ng/mL)、低剂量组(125 μg/mL)、中剂量组(250 μg/mL)和高剂量组(500 μg/mL),且将处于对数生长期的RAW264.7细胞接种于6孔板(5×105个细胞/mL)中并培养过夜。对照组分别向每孔中加入1 mL不同终浓度蒲公英皂苷(125、250、500 μg/mL)和 LPS(100 ng/mL)的混合液,并设 LPS组(LPS终浓度为100 ng/mL)和空白对照组(只加培养液)对照孔,每组3个复孔。各药物组加入药物1 h后再加入LPS共同培养24 h。
1.7 RT-PCR
将处于对数生长期的RAW264.7细胞接种于6孔板(5×105个细胞/mL)中并进行过夜培养。分别向每孔中加入1 mL不同终浓度蒲公英皂苷(125、250、500 μg/mL)和 LPS(100 ng/mL)的混合液,并设LPS组(LPS终浓度为100 ng/mL)和空白对照组(只加培养液)对照孔,每组3个复孔。处理24 h后收集细胞,利用UNIQ-10柱式Trizol法提取总RNA。采用Primer Premier 5软件进行引物设计,并由上海生工生物有限公司合成引物,如表1所示。按反转录试剂盒进行逆转录,然后进行PCR,产物经电压为110 V,时间为 25 min,琼脂糖凝胶的浓度为1%的琼脂糖凝胶电泳后,对电泳结果进行分析,测定TNF-α、IL-6、INOS mRNA的表达含量。退火温度分别为:INOS 58 ℃;TNF-α58 ℃;IL-6 59 ℃;β-actin 55 ℃。

表1 TNF-α,IL-6、INOS,β -actin引物序列
1.8 Western blot检测p-IκB和IκB-α的表达
将处于对数生长期的RAW264.7细胞接种于60 mm的单孔板(1×107个细胞/mL)中进行过夜培养。分组与给药同方法1.6,培养4 h后收集细胞,提取总蛋白,根据Western blot测定蛋白含量。根据所提取蛋白的大小进行制胶,点样,跑胶,对所需蛋白胶切取后进行转膜、封闭、洗膜,将清洗后的膜放入含有一抗的密封袋中,放置在摇床上,4 ℃孵育过夜。一抗孵育完取出膜放入含有1×PBST的平皿中洗脱5次,每次5 min,取出PVDF膜后加入HRP标记的二抗,在室温中孵育1 h后取出膜再用1×PBST每15 min洗涤1次,共洗涤5次。洗完后取出PVDF膜,用ECL化学发光试剂盒进行发光,放入仪器中扫描。
1.9 ELISA测定TNF-α和IL-6分泌量
取对数生长期的RAW264.7细胞接种于24孔板(5×105个细胞/mL),培养过夜。分组与给药方法方法同1.6,培养24 h后收集细胞上清液,通过TNF-α、IL-6酶联免疫吸附试剂盒(BioLegend)说明书对上清液中的TNF-α、IL-6的浓度进行检测。
1.10 统计学处理
数据均采用means±SD表示,数据间差异显著性采用SPSS17.0软件中的t-test检验完成,*P<0.05代表组间差异显著,**P<0.01代表组间差异极显著。
2 结果与分析
2.1 MTT检测蒲公英皂苷的细胞活性
设定8个蒲公英皂苷浓度(0,31.25,62.5,125,250,500,1 000 μg/mL)作用于 RAW264.7细胞,结果见图1。蒲公英皂苷浓度在0~1 000 μg/mL,对 RAW264.7细胞活性没有影响,故选择浓度125、250、500 μg/mL为蒲公英皂苷的低、中、高剂量。
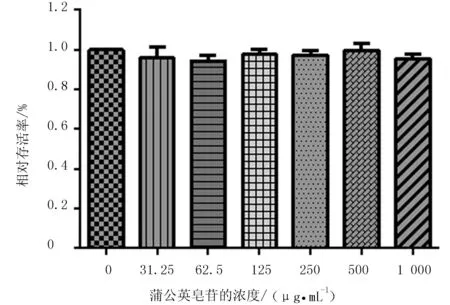
图1 蒲公英皂苷对RAW264.7细胞活性的影响
2.2 蒲公英皂苷对LPS刺激的小鼠RAW264.7 细胞分泌NO的影响
由图2可以看出,与空白对照组相比,100 ng/mL的LPS单独作用RAW264.7细胞24 h后,能极显著提高NO的分泌量(P<0.01)。蒲公英皂苷预处理细胞1 h后,与LPS对照组相比,蒲公英皂苷中、高剂量组均能极显著的降低NO的分泌量(P<0.01),而蒲公英皂苷的低剂量组与LPS对照组相比差异不显著(P>0.05)。

注:与空白对照组相比,##表示P<0.01;与LPS对照组相比,**表示P<0.01。

Fig.2 Effect oftaraxacumsaponin on LPS-induced the secretion of NO in RAW264.7 cells
2.3 蒲公英皂苷对LPS刺激的小鼠RAW264.7 细胞TNF-α、IL-6和INOS mRNA表达的影响
根据RT-PCR结果(图3)可知,在LPS刺激RAW264.7细胞24 h后,与空白组相比,其IL-6、TNF-α、INOS mRNA表达水平有显著提高(P<0.01),蒲公英皂苷呈剂量依赖关系抑制IL-6、TNF-α、INOS mRNA的表达。与模型组相比较,中、高剂量组对IL-6 mRNA的表达有极显著的抑制作用(P<0.01),而低剂量组有显著抑制作用(P<0.05)。低、中剂量组对TNF-α mRNA的表达抑制作用显著(P<0.05),而高剂量组的抑制作用极显著(P<0.01)。低、中、高剂量组对INOS mRNA的表达均有一定的抑制作用,高、中剂量组的作用极显著(P<0.01),低剂量组有显著抑制作用(P<0.05)。
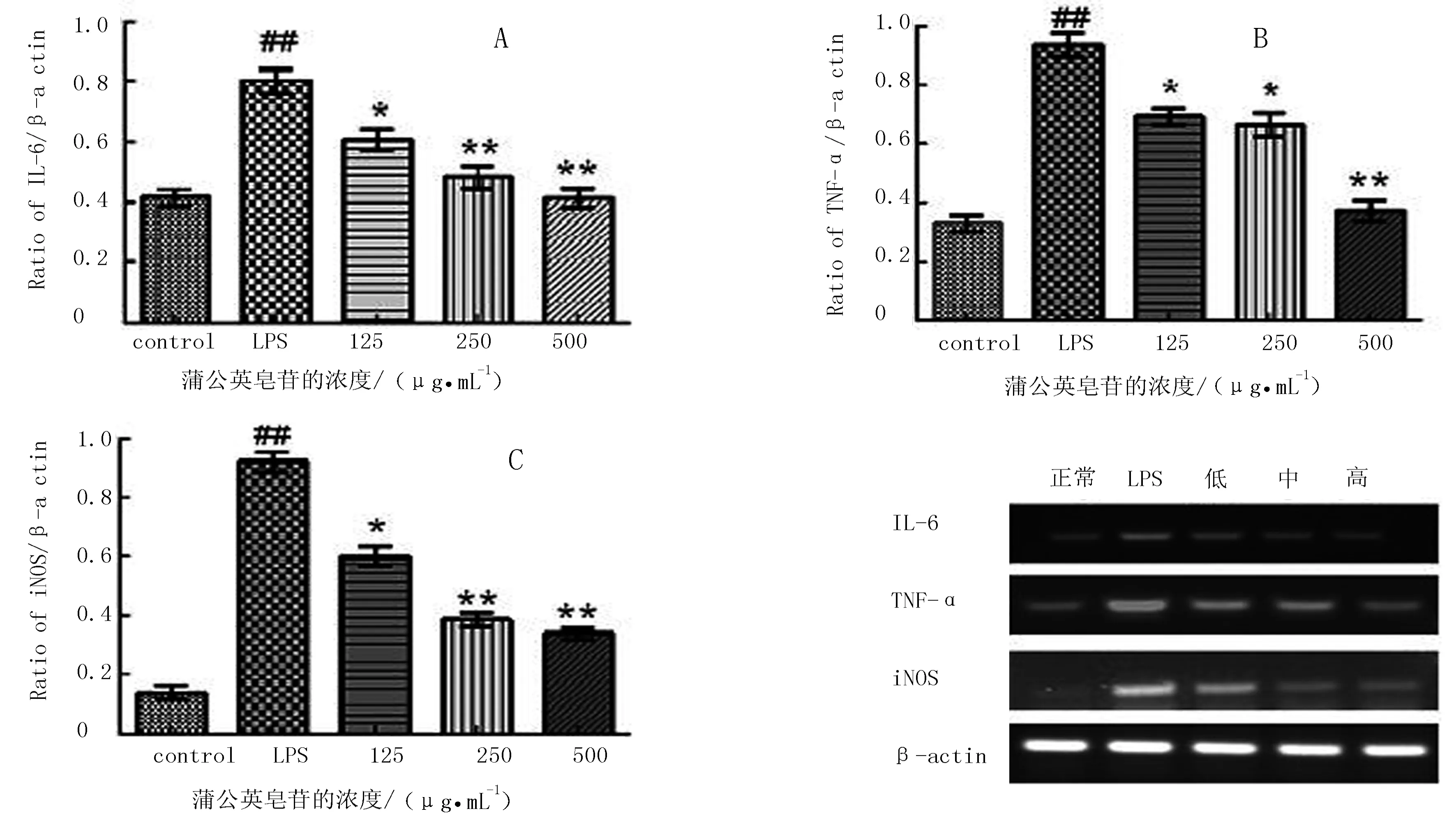
注:与空白对照组相比,##表示P<0.01;与LPS对照组相比,*表示P<0.05, **表示P<0.01。
2.4 蒲公英皂苷对LPS刺激的小鼠RAW264.7细胞P-IκB和IκB-α蛋白表达的影响
根据Western blot结果可知(图4),小鼠RAW264.7细胞经LPS刺激4 h后,与空白组相比较,IκB-α蛋白的表达量明显降低,并且在加入蒲公英皂苷后,中、高剂量组的IκB-α表达量显著增加(P<0.001);LPS组p-IκB-α的表达显著增高,蒲公英皂苷呈剂量依赖关系抑制p-IκB-α蛋白的表达。与LPS组相比,蒲公英皂苷低剂量组中p-IκB-α蛋白表达显著降低(P<0.05),中、高剂量组的抑制作用极显著(P<0.01)。提示蒲公英皂苷可以有效抑制IκB-α的磷酸化。
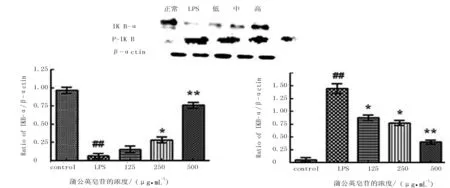
注:与空白对照组相比,##表示P<0.01;与LPS对照组相比,**表示P<0.01,*表示P<0.05,下同。
2.5 蒲公英皂苷对LPS刺激的小鼠RAW264.7细胞TNF-α和IL-6分泌的影响
根据ELISA结果(图5)可知,单独使用脂多糖刺激小鼠RAW264.7细胞24 h后,与空白对照组相比,TNF-α水平显著升高。但加入不同剂量蒲公英皂苷后,TNF-α浓度水平均极显著降低,且呈剂量依赖关系(P<0.01)。根据ELISA结果可知(图6),单独用脂多糖刺激小鼠RAW264.7细胞24 h后,与空白组相比较,IL-6水平显著升高。但是,加入不同剂量蒲公英皂苷后,IL-6浓度水平均又显著降低,且呈剂量依赖关系(P<0.05或P<0.01),在中、高剂量组中,下降极显著(P<0.01),在低剂量组中下降显著(P<0.05)。
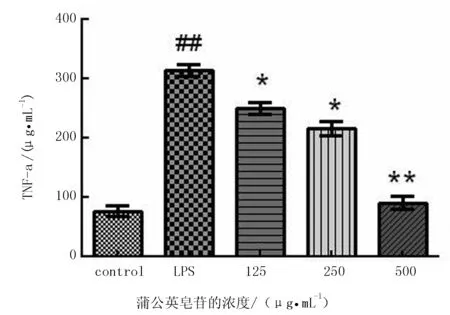
图5 蒲公英皂苷对LPS刺激的RAW264.7细胞TNF-α分泌的影响
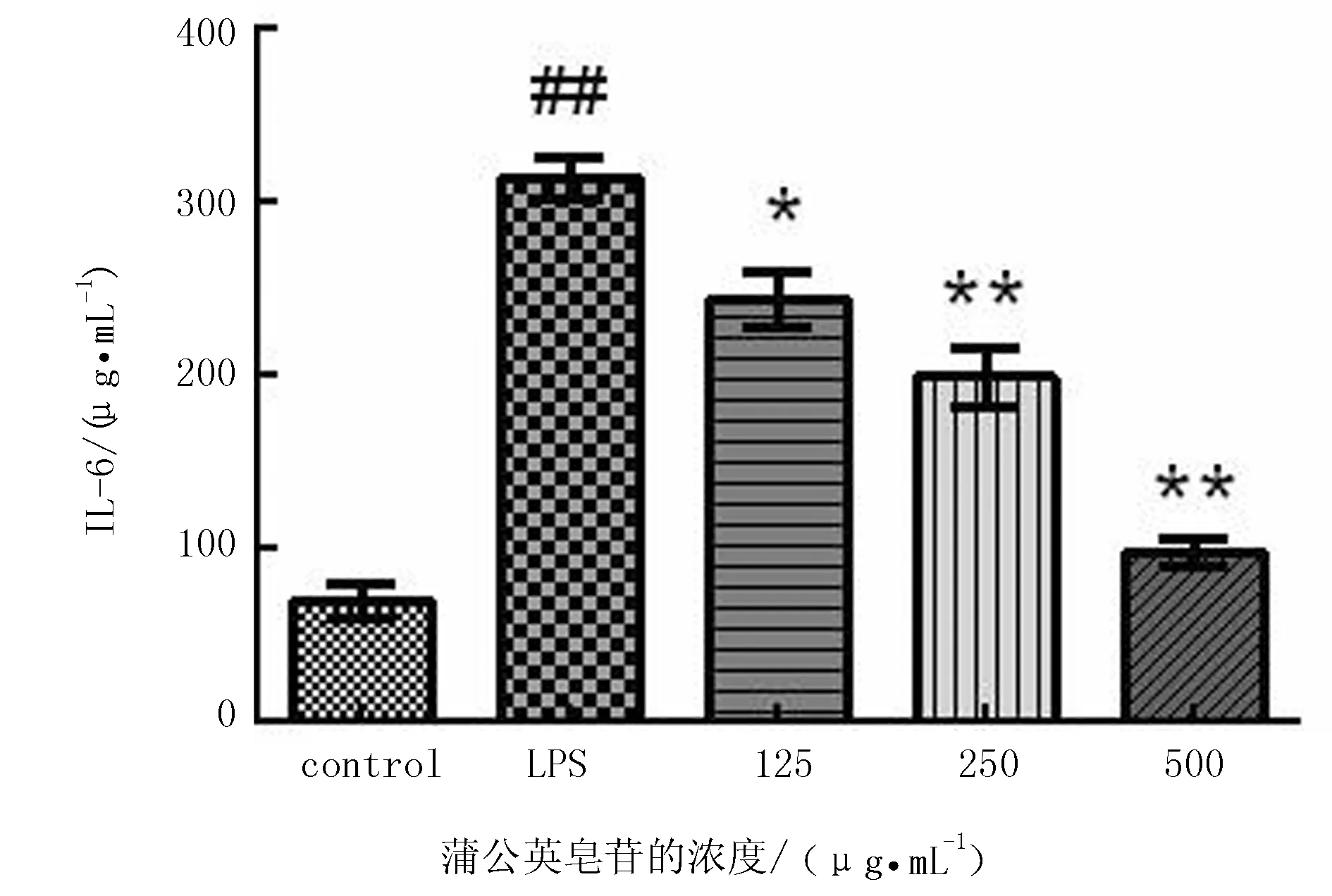
图6 蒲公英皂苷对LPS刺激的RAW264.7细胞IL-6分泌的影响
3 讨论与结论
LPS是由革兰氏阴性菌释放的一种内毒素,是单核细胞和细胞的有效诱导剂,是天然免疫应答的关键介质,由脂质A、核心寡糖和1个O侧链组成,其中,脂质A是内毒素的主要成分。由LPS刺激的RAW264.7细胞会发生细胞内信号传递,最终导致细胞因子和其他炎症介质的构成,进而有助于促炎性反应的产生和分泌。脂多糖在发病机制中被公认为是革兰阴性脓毒症与感染性休克。 LPS激活单核吞噬细胞(单核细胞和细胞)和其他类型的细胞分泌TNF-α,IL-6和其他细胞因子,介导各种炎症性疾病的发展[16-19]。
RAW264.7细胞作为一种先天免疫细胞,当细胞保护身体免受外来入侵时,它会引发炎症和免疫反应。当被LPS刺激的同时,细胞被激活并释放多种促炎和细胞因子,过度的释放将导致广泛的组织损伤和病理变化。在这个过程中,细胞会产生许多炎症介质,例如IL-6、TNF-α、NO和前列腺素。但过量介质的产生将会导致各种生理障碍,包括肿瘤的形成,自身免疫反应与炎症类疾病[20-23]。
NO是炎症发病机理中常见的一类促炎症介质。哺乳动物细胞必须通过特定的诱导因子如炎症引发细胞因子和细菌脂多糖来表达诱导型一氧化氮合酶(INOS)。INOS参与了炎症[21],而NO是由INOS释放的重要细胞信号分子和炎性介质,在异常条件下因过度释放引发的炎症发病机制中起重要作用[22],因此,INOS的抑制与抗炎作用有着密切的联系。当LPS刺激RAW264.7细胞时,TNF-α、IL-6、INOS的表达会有所增加,并且细胞释放的NO浓度也会相应升高[23]。活化的细胞所释放出来的IL-6、 TNF-α和INOS等促炎因子和细胞因子,可用于评估LPS诱导的细胞活化的潜在抗炎特性[24]。本研究表明,蒲公英皂苷可抑制LPS诱导的RAW264.7细胞合成NO,并且还可以抑制INOS mRNA的表达,结果显示了蒲公英皂苷可通过抑制NO的合成而发挥抗炎作用[24-26]。
IL-6是一种多效性细胞因子,通常在组织部位中产生并释放到循环系统中而造成稳态扰动,进而引起内毒素肺损伤、急性感染等。它除了主要参与产生免疫应对慢性细胞内感染,并且将IL-6连同其他细胞因子如TNF-α、IL-1一起循环,进而造成一些急性期反应,包括发热,皮质酮释放,肝生产的急性期蛋白,其中许多是蛋白酶抑制剂。总体来说,通过对这些急性反应诱导释放的IL-6被认为是保持体内稳态的一部分。本文通过RT-PCR以及ELISA方法对LPS诱导RAW24.7细胞的TNF-α和IL-6 mRNA的表达极其分泌情况进行了研究。由RT-PCR结果可以看出,不同浓度的蒲公英皂苷与RAW264.7细胞共同孵育24 h后,LPS诱导的TNF-α和IL-6基因的表达明显下降,且呈剂量依赖关系。ELISA试验结果表明,不同浓度的蒲公英皂苷与RAW264.7细胞共同孵育24 h后,细胞上清液中的TNF-α和IL-6的分泌量呈剂量依赖性下降。这些结果均可证明,蒲公英皂苷可通过降低TNF-α和IL-6的表达来抑制炎症[27-29]。
细胞被LPS刺激引起炎症反应后,2种主要的下游信号通路核转录因子κB (Nuclear Factor-kappaB,NF-κB)信号转导通路和丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPKs)以及Janus激酶-信号转导转录激活因子(Janus kinase-signal transduction andtranscription activation,JAK-STAT)信号转通路会参与到调控LPS的炎症反应中。NF-κB在调节免疫及炎症过程中起着至关重要的作用,进而成为发展为炎症性疾病的新的治疗目标[25-31]。所以,可以通过抑制NF-κB信号转导通路来作为抗炎药物的靶点。因此,本文通过研究蒲公英皂苷影响IκB的磷酸化,以确定其是否抑制NF-κB信号通路的活化,进而减少促炎细胞因子和炎症介质的生成[30-31]。经过前面的试验已经可以证明,蒲公英皂苷能够使LPS诱导的RAW264.7细胞分泌TNF-α和IL-6的数量下降,并抑制TNF-α、IL-6和INOS 的mRNA表达,但是否也是通过调节NF-κB信号转导通路得以实现还需要进一步证明。因为检测IκB-α即可间接检测蒲公英皂苷对NF-κB的抑制作用,因此,本研究对蒲公英皂苷影响 NF-κB的表达进行了研究。通过试验可以发现,在LPS的诱导下,细胞蛋白中的IκB-α的数量明显减少,但随着蒲公英皂苷的浓度的增加,IκB-α的量呈剂量依赖性增加;P-IκB则恰好相反,单独LPS刺激下使得P-IκB的量显著增加,但加入蒲公英皂苷后,随着蒲公英皂苷浓度的增加,p-IκB的量却呈剂量依赖性降低。这就说明IκB-α受到LPS的刺激后发生磷酸化转变成活性状态的p-IκB,这也进一步的表明蒲公英皂苷至少部分通过抑制IκB-α的磷酸化而阻断NF-κB通路从而发挥抗炎作用。但是关于蒲公英皂苷是否也通过抑制MAPKs和JAK-STAT信号转导通路而发挥抗炎作用还有待于进一步研究。
综上所述,蒲公英皂苷能够通过阻断NF-κB的信号通路,抑制LPS诱导的RAW264.7细胞NO的合成和INOS基因的表达,以及抑制TNF-α、IL-6 mRNA的表达和TNF-α、IL-6的分泌量,从而发挥体外抗炎的有效作用,这为进一步深入研究蒲公英皂苷对细胞的体外抗炎活性而奠定基础。
