脱氢表雄酮抑制血管内膜增生的体内研究
2019-09-02张曼莉张曼娜陈慧赵昆刘芳刘志宽佟飞
张曼莉,张曼娜,陈慧,赵昆,刘芳,刘志宽,佟飞
动脉粥样硬化(atherosclerosis,AS)时,在炎症、氧化应激等因素作用下,引起内皮损伤、单核细胞黏附、脂质颗粒聚集、泡沫细胞形成和血管平滑肌细胞(vascular smooth muscle cell,VSMC)增殖、迁移,最终导致血管内膜增生和粥样斑块的形成[1]。血管内膜增生、炎症与AS、支架术后再狭窄等血管重构性疾病密切相关。有研究报道,Krüppel样因子5(Krüppel-like factors 5,KLF5)在血管重构性疾病尤其AS中与细胞增殖和炎症密切相关[2-3]。脱氢表雄酮(dehydroepiandrosterone,DHEA)是人体血液循环中最丰富的一种类固醇激素。有研究显示,DHEA可抑制VSMC增殖,在AS过程中发挥保护作用[4]。那么,在小鼠内皮层完整的血管损伤模型中(如颈动脉结扎或不完全结扎),DHEA是否具有抑制内膜增生和炎症的作用目前鲜有报道。本文应用小鼠颈动脉结扎法诱导内膜增生模型,观察DHEA在结扎诱导的内膜增生和局部炎症应答中的抑制作用。
1 材料与方法
材料及仪器:DHEA(Abcam公司,英国);鼠抗增殖细胞核抗原(PCNA)单克隆抗体(Abcam公司,英国);鼠抗肿瘤坏死因子-α(TNF-α)单克隆抗体(Abcam公司,英国);鼠抗白细胞介素(IL)-6单克隆抗体(Abcam公司,英国);兔抗KLF5多克隆抗体(GeneTex公司,美国);鼠抗β肌动蛋白(β-actin)多克隆抗体(Santa Cruz公司,美国);总RNA提取试剂盒(OMEGA公司,美国);M-MLV逆转录试剂盒(Invitrogen公司,美国);SYBR Green定量PCR(qPCR)kit(Invitrogen公司,美国);核酸定量仪(Eppendorf公司,德国);PCR扩增仪(Eppendorf公司,德国);ABI 7500 Fast实时荧光定量PCR(qRT-PCR)扩增仪(ABI公司,美国);电泳仪(Bio-rad公司,美国);ECL化学发光仪(Vilber Lourmat 公司,法国)。
动物分组:30只健康雄性18~20周龄C57BL/6小鼠购买于北京维通利华实验动物技术有限公司(合格证编号11400700128532)。所有实验动物均受到人道对待,实验方案获得实验动物伦理委员会批准。30只小鼠随机分为对照组、结扎组和DHEA治疗组,每组10只。
动物模型的建立:按照Kumar等[5]报道的方法建立小鼠颈动脉结扎模型: C57BL/6小鼠用2 %异氟烷进行吸入性麻醉;固定小鼠于无菌手术台上,颈部伸直呈仰卧位,手术部位皮肤去毛,碘伏局部消毒;用无菌剪沿颈正中线剪开皮肤约0.5 cm,显微弯镊钝性分离甲状腺和肌肉,从近心端向远心端钝性分离并暴露左侧颈总动脉;结扎组和DHEA治疗组在颈外动脉和颈内动脉分叉点用无菌手术线结扎左侧颈总动脉;对照组仅把无菌手术线置于左侧颈总动脉分叉点下而不结扎。手术伤口用青霉素处理后缝合;术后将小鼠单笼喂养。对照组和结扎组于手术后给予普通饲料。DHEA治疗组于手术后第3天开始每天给予含有DHEA的饲料[0.4% W/W,相当于100 mg/(kg·d)]。术后第21天处死小鼠,快速分离小鼠结扎处颈动脉,冷PBS洗净血液,去除血管外结缔组织。用于苏木素-伊红染色的组织,用4%多聚甲醛固定。用于qRT-PCR、蛋白免疫印迹实验的组织-80℃保存备用。
苏木素-伊红(HE)染色步骤:石蜡切片常规脱蜡至水;苏木素染色;1%盐酸酒精分化;伊红染色;梯度乙醇脱水,二甲苯透明,中性树胶封片;镜下观察、照相,Image-Pro Plus Analyzer version 5.1软件(美国)测量并计算颈动脉内膜面积和内膜/中膜面积(I/M)比值。
RNA提取和qRT-PCR:取出冻存的血管组织,用Trizol法提取总RNA,核酸定量仪检测RNA的纯度和浓度。按照美国Invitrogen公司“用于qRT-PCR的M-MLV第一链合成系统”操作说明,取1~3 μg总RNA建立20 μg逆转录体系合成互补DNA(cDNA)。然后用美国Invitrogen公司的“Platinum SYBR Green qPCR Super Mix-UDG with ROX”试剂盒和ABI 7500 Fast qRT-PCR扩增仪进行荧光扩增。相对定量的方法采用比较Ct法,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用△Ct(Ct目的-Ct内参)法进行相对定量分析,以2-△Ct作为目的RNA的相对表达量。引物序列见表1。
蛋白免疫印迹实验分析:提取各组小鼠组织总蛋白,用改良的Lowry法进行蛋白定量。取等量蛋白样品进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳,之后进行半干转膜。转膜完毕,取出聚偏二氟乙烯(PVDF)膜,放置在含5 %脱脂奶粉的Tween 20/TBS(TBST)封闭液中,于室温封闭2 h后,将封闭后的PVDF膜用TBST适当漂洗,然后放入用一抗稀释液稀释的一抗中,4℃放置过夜。次日,取出PVDF膜用TBST适当漂洗,将PVDF膜置入用适当TBST稀释的化学发光二抗中,室温反应2 h,取出PVDF膜用TBST适当漂洗。最后用化学发光仪检测抗体特异结合条带。信号强度用Image J软件进行相对定量分析。用Graph Pad Prism 5软件作图。
统计学方法:采用SPSS 13.0软件进行统计学处理分析,计量资料均经正态性及方差齐性检验,数据以均数±标准差(±s)表示,两组之间均数的统计学差异采用Student's t检验分析。P<0.05为差异有统计学意义。
2 结果
三组小鼠颈动脉的形态学分析结果(图1、表2):结扎组与对照组相比,颈动脉内膜面积[(4.05±0.26)×104μm2vs (0.47±0.05)×104μm2]显 著 增 大,I/M比 值(2.85±0.19 vs 0.14±0.02)显著升高;DHEA治疗组与结扎组相 比,内 膜 面 积[(1.16±0.17)×104μm2vs(4.05±0.26)×104μm2]减小,I/M比值(0.78±0.15 vs 2.85±0.19)明显降低;上述组间差异均有统计学意义(P均<0.05)。
三组小鼠颈动脉组织中PCNA的mRNA和蛋白表达情况(表3、图2):结扎组与对照组相比,颈动脉组织中PCNA的mRNA(2.96±0.07 vs 1.00±0.01)和蛋白(3.21±0.22 vs 1.00±0.01)表达水平明显升高;DHEA治疗组与结扎组相比,颈动脉组织中PCNA的mRNA(1.42±0.09 vs 2.96±0.07)和蛋白(1.39±0.19 vs 3.21±0.22)表达水平显著降低;上述组间差异均有统计学意义(P均<0.05)。
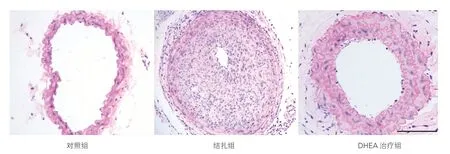
图1 三组小鼠颈动脉的苏木素-伊红染色结果(×10)
表2 三组小鼠颈动脉内膜面积和内膜/中膜面积比值(n=10,

表2 三组小鼠颈动脉内膜面积和内膜/中膜面积比值(n=10,
注:与对照组比较*P<0.05;与结扎组比较△P<0.05
项目 对照组 结扎组 DHEA治疗组内膜面积(×104 μm2) 0.47±0.05 4.05±0.26* 1.16±0.17△内膜/中膜面积比值 0.14±0.02 2.85±0.19* 0.78±0.15△
表3 三组小鼠颈动脉组织中PCNA的mRNA表达水平(n=10,

表3 三组小鼠颈动脉组织中PCNA的mRNA表达水平(n=10,
注:PCNA:增殖细胞核抗原;mRNA:信使RNA;DHEA:脱氢表雄酮。与对照组比较*P<0.05;与结扎组比较△P<0.05
PCNA mRNA表达水平 1.00±0.01 2.96±0.07* 1.42±0.09△
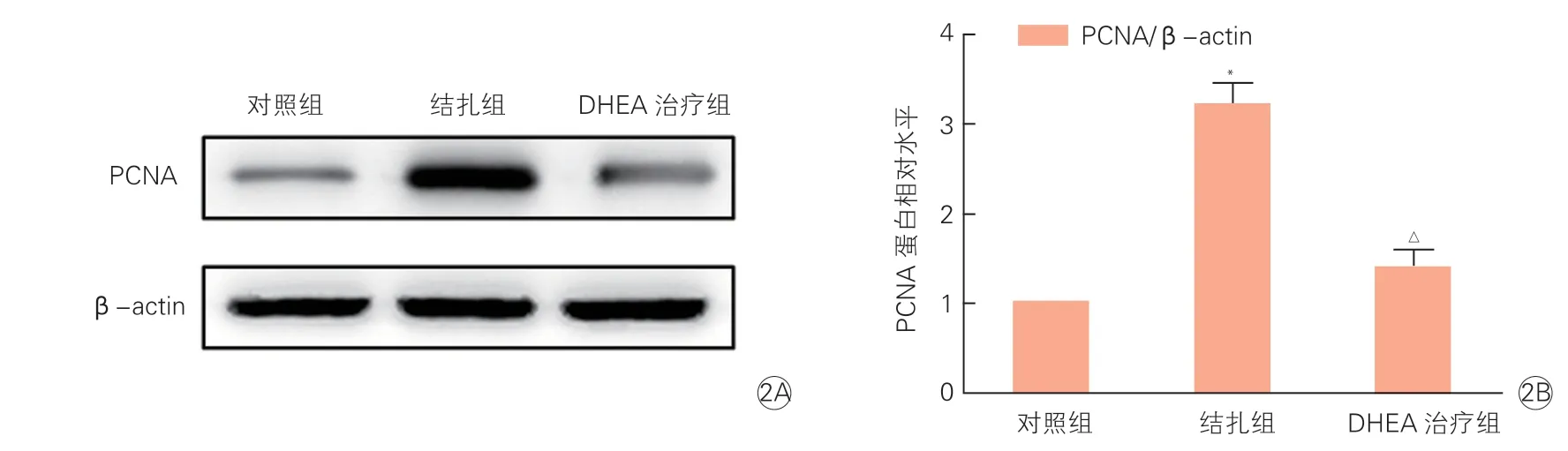
图2 三组小鼠颈动脉组织中PCNA蛋白电泳结果(2A) 和表达水平(2B)
三组小鼠颈动脉组织中TNF-α和IL-6的mRNA和蛋白表达情况(表4、图3):结扎组与对照组相比,颈动脉组织中TNF-α的mRNA(3.05±0.09 vs 1.00±0.01)和蛋白(3.75±0.30 vs 1.00±0.01)表达水平显著升高,IL-6的mRNA(2.79±0.07 vs 1.00±0.01)和蛋白(3.01±0.28 vs 1.00±0.01)表达水平也显著升高,差异均有统计学意义(P均<0.05)。DHEA治疗组与结扎组相比,颈动脉组织中TNF-α的mRNA(1.28±0.08 vs 3.05±0.09)和蛋白(1.49±0.26 vs 3.75±0.30)表达水平明显降低,IL-6的mRNA(1.31±0.09 vs 2.79±0.07)和蛋白(1.24±0.19 vs 3.01±0.28)表达水平也明显降低,差异均有统计学意义(P均<0.05)。
表4 三组小鼠颈动脉组织中TNF-α和IL-6的mRNA表达水平(n=10,

表4 三组小鼠颈动脉组织中TNF-α和IL-6的mRNA表达水平(n=10,
注:TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6;mRNA:信使RNA;DHEA:脱氢表雄酮。与对照组比较*P<0.05;与结扎组比较△P<0.05
TNF-α mRNA表达水平 1.00±0.01 3.05±0.09* 1.28±0.08△IL-6 mRNA表达水平 1.00±0.01 2.79±0.07* 1.31±0.09△
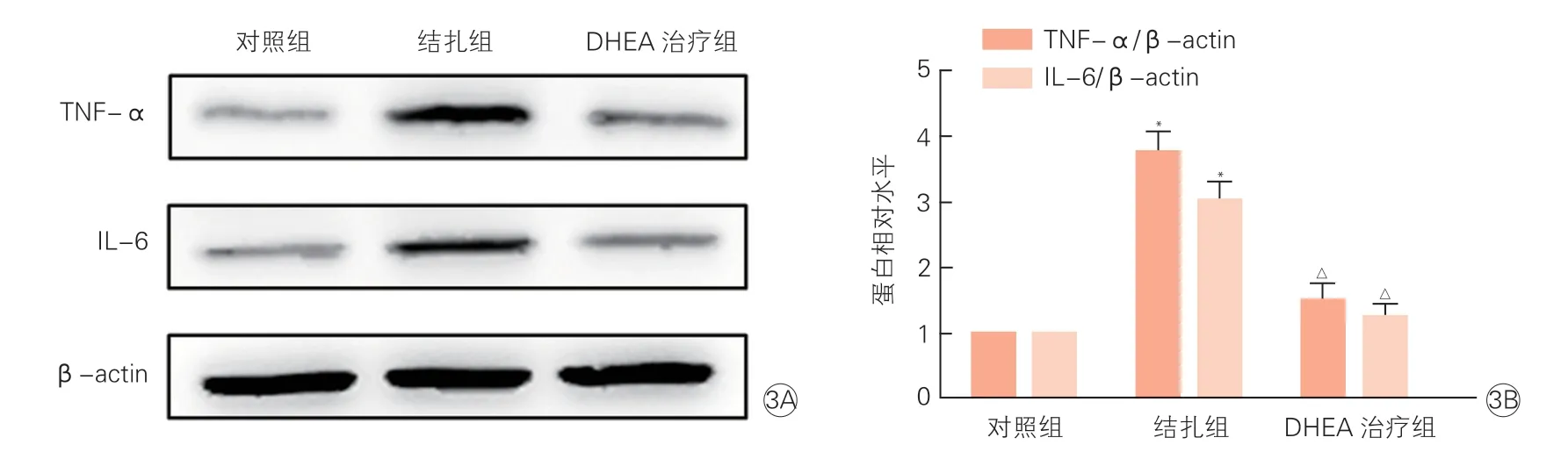
图3 三组小鼠颈动脉组织中TNF-α和IL-6蛋白电泳结果(3A) 和表达水平(3B)
三组小鼠颈动脉组织中KLF5的mRNA和蛋白表达情况(表5、图4):结扎组与对照组相比,颈动脉组织中KLF5的mRNA(2.64±0.07 vs 1.00±0.01)和蛋白(3.89±0.34 vs 1.00±0.01)表达水平显著升高,分别升高约2.6倍和3.9倍,差异均有统计学意义(P均<0.05);DHEA治疗组与结扎组相比,颈动脉组织中KLF5的mRNA(1.38±0.06 vs 2.64±0.07)和蛋白(1.67±0.21 vs 3.89±0.34)表达明显降低,差异均有统计学意义(P均<0.05)。
表5 三组小鼠颈动脉组织中KLF5的mRNA表达水平(n=10

表5 三组小鼠颈动脉组织中KLF5的mRNA表达水平(n=10
注:KLF5:Krüppel样因子5;mRNA:信使RNA;DHEA:脱氢表雄酮。与对照组比较*P<0.05;与结扎组比较△P<0.05
KLF5 mRNA表达水平 1.00±0.01 2.64±0.07* 1.38±0.06△
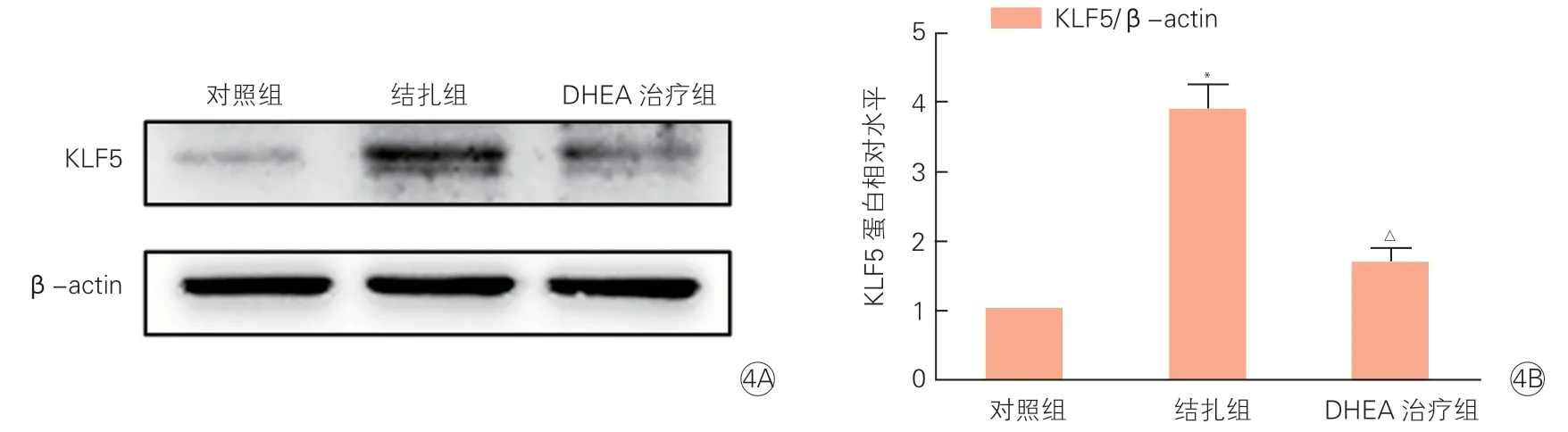
注:DHEA:脱氢表雄酮;KLF5:Krüppel样因子5;β-actin:β肌动蛋白。与对照组比较*P<0.05;与结扎组比较△P<0.05
3 讨论
心脑血管疾病是当今社会威胁人类健康的主要疾病之一,其发病率和死亡率呈逐年升高趋势[6]。病理性血管重构可导致多种血管疾病(包括AS、高血压、动脉瘤等)发生、发展,其中AS是心脑血管疾病的主要病理基础。在AS的发生、发展和并发症发生中,局部和全身的炎症以及细胞增殖起着重要作用。AS形成的最早期表现为脂质条纹形成:内皮细胞导致的特异性黏附分子表达引起白细胞趋化,趋化的单核细胞或巨噬细胞触发产生IL-1、TNF-α和IL-6等炎症因子。炎症细胞迁移到内皮下引起上述细胞因子释放,刺激VSMC增殖,引起斑块进展,导致管腔狭窄、斑块破裂、血栓形成[7-8]。研究表明,抑制反映细胞增殖状态的增殖相关基因(PCNA)和炎症相关基因(IL-1β、IL-6)的表达可阻止AS的发生、发展[8-9]。尽管有诸多关于AS的研究,但迄今为止,AS的发病机制仍不完全清楚。由于内膜增生和炎症在AS发生和发展中起重要作用,因此研究具有抑制血管内膜增生和炎症双重作用的药物就更加让人期待。
KLF家族中的KLF5在不同组织中广泛表达,是一种促细胞增殖的转录因子,在血管重构中发挥重要作用。研究发现,在肿瘤发育和AS形成过程中,KLF5可以促进细胞增殖[10-11]。此外,KLF5与炎症也密不可分。前期体内和体外研究发现,在血管重构过程中,高糖通过上调KLF5的表达,进而促进TNF-α等炎症基因表达[12]。Chen等[13]的研究也证明了KLF5可促进炎症因子的表达。由此可见,无论在肿瘤还是AS的发生、发展过程中,KLF5与细胞增殖和炎症都密切相关。因此,研发一种可以抑制KLF5表达、同时抑制细胞增殖和炎症的药物,将为AS的预防和治疗提供新的思路。
DHEA是成年人体内循环中最丰富的甾体激素,主要以脱氢表雄酮硫酸酯(DHEA-S)的形式进入血液循环中,在外周组织中转化为雄激素或雌激素发挥间接生物学效应。流行病学研究表明,血浆DHEA-S水平与AS发病率、心血管疾病全因死亡风险以及致死性、非致死性心血管事件的发生率呈负相关,在男性中尤为突出[14-15]。有研究发现,DHEA通过抗细胞增殖来治疗肺动脉高压[16]。那么,DHEA在AS形成过程中能否抑制血管重构以及如何发挥抑制作用?DHEA是否具有抑制增殖相关基因(PCNA)和炎症相关基因(TNF-α和IL-6)的表达而发挥抑制血管内膜增生和炎症双重作用?结合本课题组前期研究结果,DHEA能否影响有促细胞增殖、促炎作用的KLF5的表达?为了研究这些问题,本研究采用了雄性小鼠颈动脉结扎的血管内膜增生模型,观察DHEA对增殖相关基因(PCNA)、炎症相关基因(TNF-α和IL-6)和KLF5表达的影响,探讨DHEA对血管内膜增生、血管炎症和KLF5的作用。结果显示,形态学观察到DHEA可明显抑制血管内膜增生,在mRNA和蛋白质水平,DHEA显著抑制增殖相关基因(PCNA)、炎症相关基因(TNF-α和IL-6)和KLF5的表达,证明了DHEA具有抑制血管增生和炎症的双重作用。由此推测,DHEA发挥抑制血管内膜增生和炎症因子的表达可能一定程度上是通过抑制KLF5的表达来实现的,但DHEA是直接还是间接发挥此作用,以及其中具体的分子机制,尚需进一步的研究来证实。
综上所述,我们通过小鼠体内研究发现,DHEA能够抑制血管内膜增生和炎症因子的表达,DHEA还可以抑制转录因子KLF5的表达。因此推测,DHEA发挥抑制AS的作用一定程度上是通过抑制有促细胞增殖和促炎作用的KLF5来实现的。本研究为揭示DHEA抑制AS的发生机制,为防治AS提供了新的思路。
利益冲突:所有作者均声明不存在利益冲突
