利拉鲁肽对急性心肌梗死大鼠左室肌电活动稳定性质的影响*
2019-08-31王阿妮卢慧芳王梁危小良彭湖李志辉金莉子
王阿妮 卢慧芳 王梁 危小良 彭湖 李志辉 金莉子
利拉鲁肽(Liraglutite)是一种新型抗糖尿病药,通过增加葡萄糖依赖性胰岛素分泌、抑制胰高血糖素分泌、延缓胃排空以及抑制食欲来降低血糖。它是一种人工合成的胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R)激动剂的类似物。研究已经证明利拉鲁肽对心肌梗死后以及糖尿病伴心房颤动后的心肌具有保护作用,包括减少梗死面积、改善左室射血分数(LVEF)和抑制心室重塑[1-3]。此外,利拉鲁肽在体外培养的鼠心肌细胞可增加cAMP同时减少细胞凋亡。因此,利拉鲁肽不仅是一种有效的抗糖尿病药物[4],还可延缓病理性的心肌重构。然而,利拉鲁肽对急性心肌梗死(AMI)后心脏电活动稳定性的影响仍不清楚。
在我们前期实验中,已经证实利拉鲁肽可促进AMI大鼠血管新生,并可减少胶原沉积,从而改善左室收缩功能,发挥心肌保护作用[5]。笔者通过制作AMI的大鼠模型,观察Liraglutite对左室电活动稳定性及心肌重构的影响。
1 材料与方法
1.1材料
SPF级雄性SD(Sprague-Dawley)大鼠,体重220~250 g,由南方医科大学实验动物中心提供。将健康成年雄性大鼠24只随机分为三组:正常对照组(NC组,n=8)、安慰剂组(PB组,n=8)、利拉鲁肽组(LIR组,n=8)。NC组不做处理;PB组、LIR组分别给予腹腔皮下注射生理盐水、利拉鲁肽200 μg/(kg·d-1),一天两次,连续注射7天。
1.2AMI模型建立
三组大鼠经3%戊巴比妥钠( 30 mg/kg)腹腔注射麻醉(戊巴比妥钠购自上海西唐科技有限公司)。用剃毛器剃除小鼠胸部及腋下毛发(充分暴露手术区),用碘酒和75%乙醇手术区消毒。气管插管,设置好呼吸机各参数(呼吸频率设定为12次/分),将气管插管沿声门插入气管,连接小动物呼吸机(TKR-200C),观察小鼠呼吸状况,胸廓起伏与呼吸机频率一致表示插管成功。连接心电监护仪。建立上肢静脉通道。进行术中补液、给药。在无菌条件下,经胸骨正中开胸,剪开心包,充分暴露心脏。
外科开胸手术后,剪开心包,NC组只做观察,PB组和LIR组通过结扎左冠状动脉前降支动脉(LAD)制备AMI模型,大鼠采用右侧卧位,充分暴露LAD及所在区域。结扎冠状动脉:找到LAD走向或可能所在位置,利用缝线完全阻断LAD血流。结扎后可见梗死区心外膜变为暗红色或者苍白、搏动减弱,以心电图相应导联ST段抬高作为AMI模型制备成功的标志(图1)。

图1 急性ST抬高型心肌梗死心电监护显示
1.3心脏超声测定
大鼠在戊巴比妥钠麻醉状态下,AMI建模后,缝合胸腔,行超声心动图(飞利浦 IE33,12 MHz探头)检查,以胸骨旁短轴切面,测量左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)和LVEF。心肌收缩力参数根据同一水平短轴切面获取,每个切面记录两个图像,每个参数参量记录连续3个心脏搏动。
1.4电生理检查
超声心动图检查结束后,剪开缝合的胸腔,将起搏电极置于左室心尖部,以S1S2起搏刺激法测定左室有效不应期(LVERP),8个S1刺激(周长150 ms,脉宽2 ms)后,进行额外S2刺激(从145 ms周长开始,以5 ms递减,脉宽2 ms)。 LVERP定义为未能捕获心室的最长S1S2间期。
实验最后所有存活的动物以右室心尖部为起搏部位,采用S1S1程序刺激测定心室颤动阈值(VFT)。刺激周长100 ms,脉宽5 ms,每次刺激持续10 s,间断30 s进行下一次刺激。刺激电压从起搏阈值开始,每次以1 V递增直至诱发心室颤动。VFT定义为能诱发持续性室颤的最小刺激电压。
1.5组织病理检查
1.5.1标本选取及处理 电生理检查结束后,迅速在心脏梗死边缘区取材,4°C生理盐水反复冲洗残余血液,滤纸吸干,除去右室、心房和大血管。在左室长轴中点处垂直于长轴将左室一分为二,心尖侧的一半心肌组织经4%甲醛溶液中固定24 h后,常规脱水、石蜡包埋,制备厚度5 μm的组织切片。苏木精-伊红染色(HE染色)光镜下观察心肌组织形态学变化;Masson染色观察胶原沉积情况,判断纤维化程度。
1.5.2HE染色 将制作好的组织切片经过脱蜡、脱水处理后用苏木精染液,伊红染液进行HE染色,取HE染色切片,在100倍视野下观察心肌细胞形态学改变。
1.5.3Masson染色 将制作好的组织切片经过脱蜡、脱水处理后用Weigiet铁苏木素、丽春红酸性品红、磷钼酸溶液1%冰醋酸进行Masson胶原染色。胶原纤维染呈蓝色,肌肉呈红色,400 倍光镜下在心肌梗死边缘区随机拍取5个视野。Image Pro Plus 6.0 软件测定胶原容积分数(CVF),即 CVF=心肌胶原面积 / 所测同视野组织总面积×100%。
1.6统计学分析
2 结果
2.1三组心功能指标的比较
与NC组相比,PB、LIR组的LVEDD 、LVESD均增加(P<0.05),而LVEF均降低(P<0.05);与PB组相比,LIR组的LVEDD 、LVESD有所减小(P<0.05),LVEF增加(P<0.05)(表1)。

表1 三组超声心动图参数
注:与NC组比较,*P<0.05;与PB组比较,#P<0.05
2.2三组电生理指标的比较
与NC组相比,PB组的LVERP明显缩短(P<0.01),LIR组的LVERP缩短,但无统计学差异(P=0.08);与PB组相比,LIR组的LVERP增加(P<0.01)。与NC组相比,PB、LIR组的VFT均明显降低(P<0.01);与PB组相比,LIR组的VFT有所升高(P<0.01)(表2)。

表2 三组电生理检查参数
注:与NC组比较,*P<0.01;与PB组比较,#P<0.01
2.3三组心肌组织病理比较
2.3.1HE染色 NC组心肌排列规整,染色均匀;PB组染色深浅不均一,大量炎症细胞浸润,肌纤维交叉错构,间隙增宽,部分肌溶灶; 与PB组相比,LIR着色深浅略不均匀,较少炎症细胞浸润,肌纤维排列尚规则,极少肌溶灶(图2)。
2.3.2Masson染色 与NC组相比,PB左室CVF均明显增加(29.77%±3.86% vs 43.75%±2.89%,P<0.05),LIR组左室CVF有所增加(29.77%±3.86% vs 36.73%±3.59%,P<0.05);然而与PB组相比,LIR组的左室CVF明显减小(43.75%±2.89% vs 36.73%±3.59%,P<0.05)(图2)。
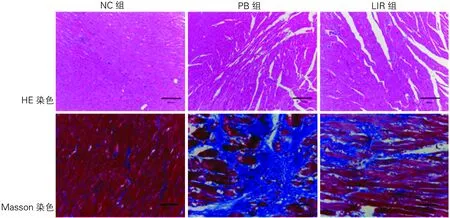
图2 三组大鼠的左室组织HE染色(×100)和 Masson染色(×400)
3 讨论
Liraglutite可显著改善心肌梗死后心脏结构重塑,然而其对电重构的影响尚不明确。本研究发现,Liraglutite通过减少AMI后心脏梗死区域炎症细胞浸润及心肌纤维化,改善了AMI后的心脏舒缩功能、抑制心脏结构重塑;通过延长AMI后LVERP,提高了心室电活动的稳定性,进而改善了心脏的电重构。
Liraglutite不仅是一种有效的抗糖尿病药物,还可诱导心肌细胞中cAMP水平升高,进而激活蛋白激酶A,发挥抗细胞凋亡作用[6-7]。同时促进心肌葡萄糖能量代谢,降低心肌耗氧量,减少AMI时心肌细胞内的乳酸堆积,抑制心肌细胞酸中毒,改善了梗死心肌周围区域的炎症反应[4, 8]。AMI后梗死区及边缘区的心肌细胞内线粒体缺氧性损伤,导致线粒体代谢速率下降,进而增加内源性活性氧,从而出现持续性损伤效应,促进了心肌纤维化,进一步加重了心功能的损害。而Liraglutite可减少内源性活性氧产生,并促进心肌细胞中线粒体ATP的代谢,提高了线粒体代谢速率,减少乳酸脱氢酶,降低了心肌细胞的缺氧性损伤,减少了心肌纤维化,进而减少了AMI心脏中的心肌梗死的面积,从而达到抑制心肌结构重构的作用[9-11]。本研究发现,在AMI后,Liraglutite可减少心脏梗死区域炎症细胞浸润,改善心肌纤维化,提高了AMI后的心脏舒缩功能,从而抑制心脏结构重构。
AMI后不仅可导致心脏结构重构,还会导致心脏电重构,主要表现为瘢痕区形成,导致电传播受阻,在心脏局部形成涡流、转子等,出现波碎裂、电震荡,降低了心脏电活动的稳定性,而这些因素已证实是导致恶性心律失常发生的主要因素[12]。一些研究发现,AMI后心脏的有效不应期缩短,VFT下降,而且神经纤维紊乱增生,这些因素促进了心脏电活动的不稳定性的增加。进而促进了恶性心律失常的发生[13]。本研究结果表明,Liraglutite能够延长AMI后LVERP,提高VFT,增加了左室电活动稳定性。然而Liraglutite对心脏神经纤维的影响机制还需要进一步阐明。
