心脏再同步化治疗起搏器左室电极的拔除与再植入:中国单中心经验
2019-08-31郑文成李鼎李学斌昃峰王龙段江波苑翠珍
郑文成 李鼎 李学斌 昃峰 王龙 段江波 苑翠珍
心脏再同步化治疗(cardiac resynchronization therapy, CRT/CRTD)起搏系统因为其植入操作复杂以及患者原有疾病较重,所以其植入后感染和/或电极功能异常发生率均较普通起搏器高,而左室电极植入于冠状窦血管壁较薄而除颤电极与上腔静脉的粘连较重,以及患者本身存在的心功能不全和其他合并症都使CRT/CRTD电极拔除术较普通起搏器拔除的操作难度和风险更大。CRT/CRTD起搏装置通常是植入在左侧锁骨下,而感染装置拔除后,只能选择右侧锁骨下静脉植入新的CRT/CRTD,但是左室电极拔除后冠状静脉狭窄或者原有分支闭塞以及右侧本身植入的复杂性,也使得左室电极拔除后再植入的难度加大。因左室电极拔除成功率、相关拔除方法、手术并发症以及右侧再植入冠状静脉左室电极的成功率在国内尚未有报道,笔者对于2012年1月至2018年5月因(CRT/CRTD)装置感染或左室电极功能异常而就诊于本院并接受拔除手术患者的上述问题进行回顾性分析。
1 资料与方法
1.1一般资料
回顾性分析2012年1月至2018年5月就诊于北京大学人民医院的CRT/CRTD患者共50例,(起搏器装置感染患者48例/左室电极故障2例,CRT、CRT-D分别为33、17例),所有入选患者均符合I类起搏器装置拔除指征[1]。
1.2研究方法
所有入选患者术前均完善血生化、血常规、血型、血培养、心电图、胸部X线、经胸超声心动图以及起搏器程控等检查,可疑赘生物者则完善经食管超声检查。术前常规备血。
1.2.1电极拔除 电极导线拔除均在杂交手术室进行,术前行拔除风险及麻醉评估,高风险患者均在全麻下拔除电极导线,并于全麻术中行经食管超声监测。其余患者行局麻下电极导线拔除。高风险患者包括:被动固定电极导线植入>10年,埋藏式心脏转复除颤器(ICD)电极导线植入>3年,电极穿孔>1个月,电极数量>5根。拔除术中均经桡动脉行动脉血压监测。起搏依赖的患者经左侧股静脉置入右心室临时起搏电极。术中先行双侧肘静脉造影后分离导线与皮下组织,游离电极导线至静脉入口处,植入时间较短(小于12个月)的电极,可先尝试徒手或使用锁定钢丝拔除,植入时间大于12个月的患者根据具体情况单独或者联合使用下腔辅助装置抓捕器Snare、Evolution机械鞘和/或激光鞘拔除。起搏器依赖患者在电极拔除术后植入心内膜主动固定心室电极作为其后植入永久起搏器的过渡。
1.2.2经右侧锁骨下静脉再植入左室电极 再植入适应证:电极拔除后符合CRT/CRTD适应证以及CRT/CRTD反应良好及超反应患者均建议再次植入CRT/CRTD。
再植入时间:CRT/CRTD囊袋感染而血培养阴性的患者,感染装置拔出后72 h;菌血症的患者电极拔出后抗生素至少应用2周、血培养阴性后72 h;感染性心内膜炎患者,抗生素至少应用4周并血培养阴性72 h后,其中抗生素的选择根据血培养和组织细菌培养的结果。左室电极功能异常患者在电极拔除后同台再植入。
再植入部位:感染患者在原植入部位对侧(均为右锁骨下静脉途径)再植入新的起搏器。左室电极功能异常患者在原部位植入。
植入术中行冠状静脉系统造影,选择左室侧静脉作为目标血管植入左室电极,如靶静脉有明显的狭窄可尝试应用球囊扩张。左室电极植入失败者行右室双部位或希氏束起搏。
1.2.3手术成功及并发症定义 根据美国心律学会2009年《经静脉电极导线拔除专家共识》的描述[1]手术完全成功的定义为拔除所有的电极导线,无手术相关的永久性并发症及死亡;临床成功的定义为拔除所有的电极导线或残留部分电极导线但不影响预后,比如遗留电极头端但不会引起穿孔、血栓形成及持续性感染事件;失败的定义为不能达到完全成功或临床成功或造成永久性的并发症或存在手术相关的死亡;主要并发症定义为致命性并发症或死亡,次要并发症包括手术相关的事件需要药物或者介入干预。
1.3统计学分析
采用SPSS20.0统计软件对数据进行统计学分析,计量资料用均数±标准差表示,用n(%)对计数资料进行描述,用四分位间距法对统计资料进行描述。
2 结果
2.1病例特点
50名患者年龄(66.89±8.58)岁,男性(43例, 86%),CRT、CRTD患者33、17例。植入原因缺血性心肌病(11例,22%),其余均为扩张型心肌病患者。其中5例患者合并心房颤动(简称房颤)(10%),入院后查全血白细胞计数(8.76±3.01)×109/L,血红蛋白含量(125.92±14.23)g/L,血清肌酐水平(88.33±31.76)μmol/L,高血压病20例(40%),高脂血症8例(16%),有脑梗死或短暂性脑缺血发作病史11例(22%),冠状动脉搭桥史3例(6%),糖尿病史7例(14%),心脏超声左室射血分数(0.34±0.10),左室舒张末期内径(67.26±9.74)mm,左室收缩末期内径(46.87±11.47)mm。
入选的50例患者的拔除原因分别为囊袋感染38例(76%),菌血症7例(14%),感染性心内膜炎3例(6%),其中赘生物大小分别为1.3 cm×1.5 cm、1.5 cm×2.1 cm、1.6 cm×1.7 cm,感染后于当地医院清创失败者29例(58%)。50例共拔除电极导线146根,平均每例患者拔除电极导线2.92根,电极导线平均植入时间为55.3个月,其中有3例为美敦力公司4195 Starfix左室主动电极导线。另外非感染的2例分别为因左室电极起搏阈值升高和严重的膈肌刺激行电极拔除和再植入(图1)。

A:水平位下右房、右室及左室主动电极位置。B:拔除后的心腔内电极展示,其中左室主动电极外绝缘层呈蓝色。C:Snare抓捕器正在抓捕右房电极
图11例非感染的患者因左室电极故障拔除的X线影像和拔除实物图
2.2电极导线拔除方法及相关并发症
左室电极完全成功拔除成功率为94%,临床拔除成功率为6%;拔除方法参照《心律植入装置的感染与处理》[2],其中5例(10%)未使用工具徒手拔除,22例(44%)使用锁定钢丝拔除,1例(2%)应用锁定钢丝联合Evolution机械扩张鞘拔除,21例(42%)应用下腔辅助装置抓捕器(Snare)拔除,1例(2%)为内外科杂交手术完成电极拔除(图1C)。右房及右室电极完全拔除的成功率95.8%,临床拔除的成功率为4.2%,其中右房电极共拔除48根,右室除颤电极共拔除15例,共拔除33例右室普通电极,3例患者(6.3%)应用激光鞘拔除,29例患者(60.4%)应用下腔辅助装置抓捕器Snare拔除;住院期间围手术期死亡1例,死亡率为2%,电极拔除手术主要并发症发生率为2%(1例患者术后出现急性呼吸衰竭),无次要并发症。
2.3左室电极与CRT/CRTD的再植入
34例左室电极再植入患者于术中冠状静脉造影显示,左室电极拔除后原侧静脉狭窄>50%的患者有15例(44.1%),原侧静脉闭塞3例(8.8%)。左室电极拔除后21例(61.8%)再植入原侧静脉,侧静脉狭窄或闭塞再植入选择其他侧静脉10例(29.4%),1例再植入时行冠状静脉造影显示原植入的后侧静脉近端重度狭窄,应用2.0 mm×20 mm球囊以6、8 atm扩张两次后植入左室电极(图2)。
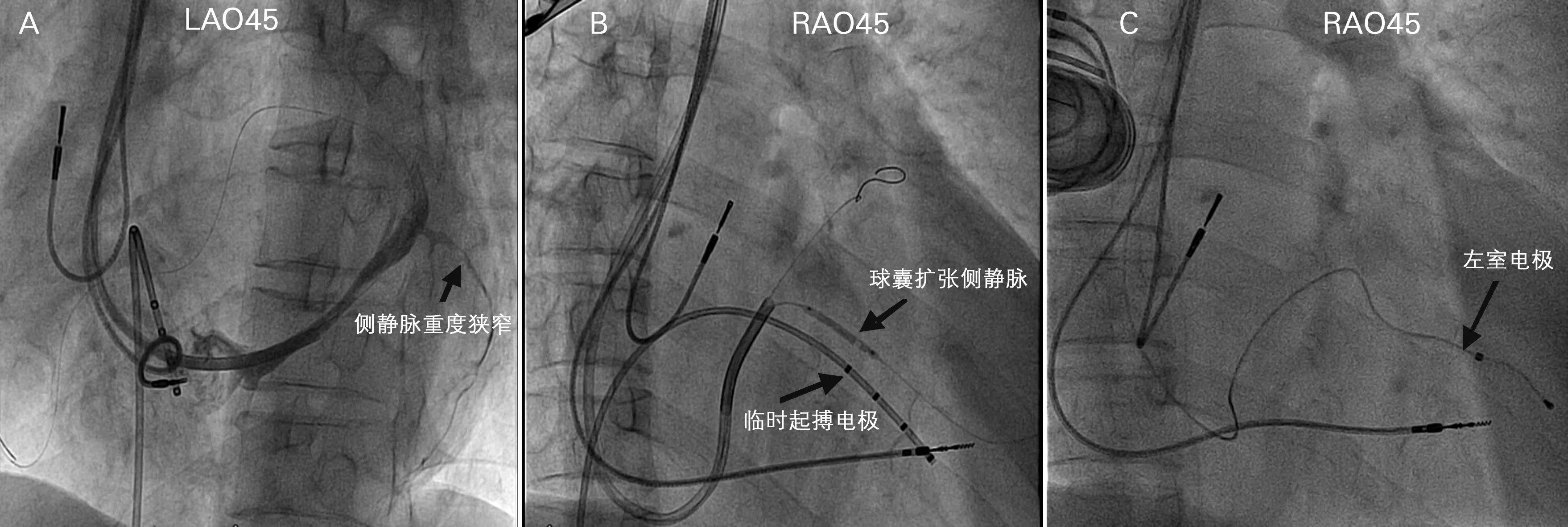
A: 左前斜位(LAO)45度箭头显示CRT起搏器左室电极拔除后原电极植入的侧静脉重度狭窄。B: 右前斜位(RAO)45度下应用2.0 mm×20 mm球囊以6-8 atm扩张侧静脉。C:RAO45度下侧静脉球囊扩张后左室电极成功植入侧静脉
图21例患者左室电极拔除后再植入X线影像
冠状静脉左室电极右侧再植入共32例,左侧再植入2例,其中28人右侧再植入成功,2例左侧成功再植入,左室电极再植入总的成功率为88.2%,其中经右侧再植入成功率为87.5%(图3)。4例未成功的原因均为冠状静脉分支的靶血管严重狭窄或闭塞球囊无法扩张或扩张效果差,而冠状静脉又无其他可植入血管,1例为严重的膈神经刺激和高起搏阈值而放弃。这4例患者中2例采用了右室双部位起搏(图4),另2例行希氏束起搏。2例左室电极功能异常的非感染患者左室电极拔除后同台在左侧锁骨下行左室电极再植入成功;7例患者拔除电极后拒绝再次植入(1例为心功能恢复正常);另有3例患者电极拔除后经评估无双室起搏适应证(2例为房颤伴心电图QRS时限<120 ms,1例为持续房颤伴射血分数正常患者); 4例患者为再植入高危人群(严重的感染、心功能差伴严重低血压状态、冠状动脉搭桥术后伤口溃疡不愈合、下肢静脉血栓形成需抗凝治疗)未再行CRT植入术;2例患者因双侧锁骨下静脉途径无法使用而选择心外膜和经髂静脉植入双腔起搏器。

A:起搏器囊袋感染。B:CRT拔除前LAO45度下X线影像。C:CRT右侧再植入后LAO45度下X线影像
有6例原CRTD患者左侧拔除后于右侧植入CRTD,7例原左侧CRTD的患者因为在首次植入后无室性心律失常发作,再植入时于右侧植入CRT。1例患者原左侧CRT拔除后,行动态心电图检查提示短阵室性心动过速,右侧再植入CRTD。
3 讨论
与普通起搏器患者拔除导线相比,CRT/CRTD电极拔除的困难和风险主要来自于拔除左室电极冠状静脉窦破裂,以及除颤电极尤其是双线圈除颤电极与锁骨下静脉和上腔静脉粘连后破裂以及三尖瓣撕裂。本组病例显示左室电极拔除使用锁定钢丝或snare均可顺利拔除,无并发症出现,可能与左室电极直径较细而且电极与冠状窦之间并无特殊固定装置有关。3例主动固定左室电极的植入时间均较短粘连并不严重,使用snare也顺利拔除,但在拔除时明显感觉阻力较大。本组患者中左室电极拔除主要并发症的发生率为2.0%。国外有2位作者报道次要并发症的发生率为分别5.6%、3.1%[3-4]。本组次要并发症的发生率低于国外文献的报道。

A:正位下X线各电极位置。B:左室电极拔除后冠状静脉造影显示原电极植入的侧静脉中远段闭塞。C:由于原侧静脉闭塞选择右室双部位起搏
图41例患者左室电极拔除后行右室双部位起搏
从右锁骨下静脉途径行左室电极再植入,由于存在锁骨下静脉进入上腔静脉和从右房进入冠状窦两个弯度,给冠状窦鞘管的导入以及鞘管在冠状窦的支撑和稳定性都带来了困难。本中心右侧再植入时的冠状窦鞘管多选用直鞘。多选择可调弯导管指引冠状窦鞘管的导入,避免导管反复顶在间隔部引起冠状窦夹层的风险。右房左右径增大不是特别明显时也选择Amplatz L1鞘加泥鳅导丝导入冠状窦鞘管。
Burke等[5]报道了冠状静脉左室电极拔除后原有冠状静脉闭塞率可达50% ,在我们的研究中左室电极拔除后原侧静脉严重狭窄甚至闭塞的概率为52.9%。拔除术后的血管狭窄常常是由于纤维组织增生和/或血栓形成所致,所以在此血管行球囊扩张的效果常常不佳,本组患者中仅1例在狭窄血管上行球囊扩张后成功植入了左室电极。
本研究中冠状静脉左室电极再植入的成功率为88.2%,均植入于左室侧/后侧静脉,Zucchelli等[6]的左室电极再植入成功率达到了95.6% ,这可能与本组患者中经右锁骨下静脉再植入比例高达94.5%有关,而Zucchelli组只有64.4%的患者经原植入的对侧右锁骨下静脉再植入。
本组患者中有6例为拔除后于右侧植入CRTD,目前多项研究认为右侧ICD与左侧ICD相比,虽然可能存在除颤阈值升高的可能,但在临床应用中仍是安全有效的。
