治疗EB病毒相关噬血细胞综合征致药物性肝损伤1例
2019-08-30马丽霞邹怀宾周莉郑素军陈煜
马丽霞 邹怀宾 周莉 郑素军 陈煜
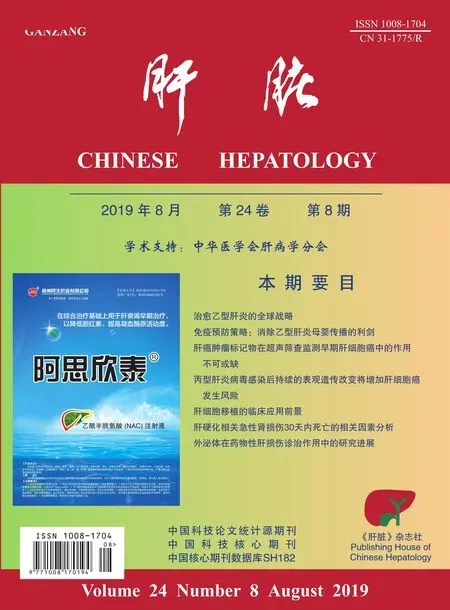
患者,男性,27岁,主因“间断发热3月余,眼黄、尿黄20余d”于2018年8月9日入我院。患者3月余前劳累后出现发热,体温高峰39~40℃,以午后及晚间为著,无畏寒、寒战,伴双侧颈部肿物,有触痛,偶有干咳。就诊当地医院,化验WBC 3.12×109/L,GR 78.6%,LY 18%,Hb 149 g/L,PLT 190×109/L ,CRP 28 mg/L ,ALT 53 U /L,GGT 119 U/L,LDH 468 U/L,铁蛋白(Ferritin)895 ng/mL,甲、乙流感病毒抗原阴性,胸片未见明显异常,腹部超声示脂肪肝(轻度)。浅表淋巴结超声示双侧颈部淋巴结肿大(左3 cm×1.5 cm,右3.6 cm×1.4 cm),结构正常。考虑“病毒性感染、白细胞减少”,给予静点阿昔洛韦抗病毒、口服利可君、补液等治疗。每日体温高峰仍未见下降,遂于2018年5月16日转入上级医院。查体:双侧颈前区、腹股沟可触及数个肿大淋巴结,质中,活动度可,全身皮肤、巩膜无黄染,心肺(-),腹软,无压痛、反跳痛,肝脾肋下未及。既往史:脂肪肝病史2年,半年前体检转氨酶正常。入院化验:WBC 1.19×109/L,GR 79%,LY 16.5%,Hb 141 g/L,PLT 84×109/L , ALT 91 U/L,AST 81.5 U/L,TBil 16 μmol/L,DBil 7.84 μmol/L,GGT 127 U/L,ALP 62 U/L,LDH 823 U/L,PTA 76%,CRP 53 mg/L,LDL-C 3.2 mmol/L,TG 2.19 mmol/L,EBV-CA IgM(+),EBV-CA IgG(-),EBV-DNA 2.4×103copy/mL,NK细胞活性10.22%(参考值>15.11%),sCD25 4003 pg/mL(参考值< 6400 pg/mL),Ferritin 3518 ng/mL,TG 2.19 mmol/L,支原体抗体IgM 1∶160阳性,军团菌抗体IgM、衣原体抗体IgM、乙肝表面抗原、丙肝抗体、布氏杆菌虎红试验、CMV-DNA、TB-SPOT、RF、ANA均阴性。 腹部超声提示脂肪肝,脾大(脾厚4.5 cm),胸部CT:双肺慢性炎症,纵膈、腋窝多发轻度肿大淋巴结。颈部淋巴结活检示:(右侧颈部肿大淋巴结)在炎症及坏死背景中,见多量T细胞感染EB病毒,并易见嗜血现象,结合临床符合EB病毒感染相关嗜血细胞综合征改变。骨髓细胞学检查示红系增生活跃,巨核细胞产板可,少部分淋巴细胞形态不典型,可见嗜血现象(嗜血细胞吞噬中性粒细胞、血小板和成熟红细胞)。综上诊断“EB病毒相关嗜血细胞综合征、支原体感染、脂肪肝”。给予拉氧头孢联合米诺环素抗感染,保肝降酶、补液等支持治疗,地塞米松5 mg 静点1次/d共3 d抑制炎症反应。患者体温降至正常,7 d后复查WBC 5.8×109/L,Hb 142 g/L,PLT 138×109/L,ALT 143 U/L,AST 82.5 U/L TBil 13 μmol/L,DBil 3.9 μmol/L,Alb 32 g/L,GGT 138 U/L,ALP 71 U/L,LDH 823 U/L,PTA 75%。2018年5月28日开始给予L-DEP方案化疗,具体为多柔比星脂质体 40 mg d1、依托泊苷100 mg d1、甲强龙40 mg 1次/12 h d1-d3,培门冬酶 3 375 IU d3,辅以水化、碱化尿液、保护胃黏膜、保肝支持治疗,此后于2018年6月19日、2018年7月10日两疗程培门冬酶3 375 IU d1化疗2次。患者未再发热,颈部肿大淋巴结逐渐消退。化疗结束后复查WBC 7×109/L,Hb 140 g/L,PLT 140×109/L,ALT 40 U/L,AST 36 U/L,TBil 15 μmol/L,Alb 22 g/L,GGT 110 U/L,ALP 79 U/L。Ferritin 1 500 ng/mL,TG 1.8 mmol/L,病情稳定出院。于2018年7月14日患者突发腹痛,呈持续性钝痛,阵发绞痛,伴恶心、呕吐,伴低热,每日体温最高38℃,再次就诊外院。查体:双下肺呼吸音略低,心脏(-),全腹部压痛,无明显反跳痛,莫菲征阴性,肝脾肋下未及。化验:WBC 12×109/L,GR87%,Hb 130 g/L,PLT 335×109/L,ALT 180 U/L,AST 62 U/L,TBil 15 μmol/L,Alb 22 g/L,GGT 265 U/L,ALP 94 U/L,血AMY 254 U/L,尿AMY 1 200 U/L,肝抗原谱、抗核抗体谱、自身抗体系列均阴性。腹部CT:胰腺炎,脂肪肝,双侧胸腔积液。诊断考虑“急性胰腺炎(轻症),药物性肝损伤”。给予禁食水、胃肠减压、抑制胃酸、胰酶分泌、拉氧头孢抗感染、保肝降酶、补液等治疗,患者腹痛逐渐缓解,体温正常,逐渐过渡为流质饮食。但患者逐渐出现巩膜黄染、尿黄,呈进行性加重,伴乏力、食欲差,无恶心、呕吐,无皮疹,无陶土色大便,患者为进一步诊治于2018年8月9日转入我院。查体:全身浅表淋巴结无肿大,皮肤巩膜中度黄染,无肝掌,心肺(-),全腹部无压痛及反跳痛,莫菲征阴性,肝脾肋下未及。化验:WBC 5.86×109/L,GR 76%,Hb 110 g/L,PLT 217×109/L,ALT 326 U/L,AST 223 U/L,TBil 175 μmol/L,D/T 0.75,Alb 32 g/L,GGT 741 U/L,ALP 278 U/L,TBA 16.6 μmol/L,PTA 65%。EBV-CA IgM 阴性,EBV-DNA < 500 copy/mL。腹部增强CT示脂肪肝,胰腺周围多发假性囊肿可能。肝穿活检病理示(见图1):汇管区扩大,间质水肿,边缘细胆管增生明显伴细胆管内胆栓,肝细胞大泡性脂变(40%),肝细胞肿胀含胆汁颗粒,可见毛细胆管胆栓,较多吞噬胆色素的蜡质样细胞沉积。免疫组化HBsAg(-),HBcAg(-),CK7(胆管及少量肝细胞+),CK19(胆管+),Mum(浆细胞+)。入院诊断“药物性肝损伤,混合型,急性,RUCAM 9分(极可能),严重程度3级;脂肪肝;胰腺假性囊肿”。治疗上给予清淡饮食,积极保肝、退黄、改善肝内胆汁淤积治疗,患者巩膜黄染、尿黄较前好转,食欲恢复。1月后复查肝功能:ALT 17 U/L,AST 18 U/L ,TBil 19.6 μmol/L,D/T 0.68,Alb 35 g/L,GGT 66.9 U/L,ALP 100 U/L,TBA 27.5 μmol/L,PTA 86%,Ferritin 1 131 ng/mL,TG 1.7 mmol/L ,患者病情好转出院。

图1 肝穿刺病理图片
讨论肝脏是人体药物代谢的重要器官,多种药物包括非甾体类抗炎药、抗结核药物、抗肿瘤药物、中枢神经系统用药等均可导致不同程度的药物性肝损伤[1]。我国目前急性药物性肝损伤约占急性肝损伤住院比例的20%,其中化疗药物引起的肝损伤占全部肝损伤的15% 以上[2]。EB病毒相关噬血细胞综合征患者需接受多种化疗药物联合治疗,但化疗药物在杀伤肿瘤细胞的同时,也可通过免疫介导,代谢异常等引起不同程度的肝损害,导致肝细胞坏死、肝细胞脂肪变性、胆汁淤积及肝血管损害等,进而导致药物性肝损伤。迫使化疗强度减低,影响疗效,严重者可能会导致肝功能衰竭甚至死亡[3]。同时研究发现多种化疗药物联合使用时,几种细胞毒性药品叠加,肝损害发生率更高,而连续高强度的化疗使肝脏损伤进一步加重,这值得临床医生高度重视。
本例患者有持续高热、外周血白细胞和血小板减少、NK细胞活性下降、Ferritin及TG升高,骨髓可见嗜血现象等噬血细胞综合征表现,同时有EB病毒感染证据,EB病毒相关噬血细胞综合征诊断成立。继发性噬血细胞综合征临床表现多样,几乎可以累及全身所有系统,其中包括肝损害,早期多表现为持续高热,病情重者可有严重乏力、纳差、甚至肝性脑病症状。实验室检查可见肝功能异常,严重者可致肝衰竭。本例患者起病初期即有转氨酶轻度升高,既往有脂肪肝病史2年,但既往长期肝功能转氨酶正常,故可排除非酒精性脂肪性肝炎引起的急性肝损伤,结合患者EBV-DNA阳性,考虑起病初期转氨酶轻度升高与EB病毒感染、继发性嗜血细胞综合征有关,后经保肝、化疗等治疗后肝功能逐渐恢复正常。根据2018年嗜血细胞综合征诊治专家共识,对于难治性EBV相关嗜血细胞综合征,建议在DEP方案上加用培门冬酶或门冬酰胺酶,培门冬酶推荐剂量为每日1 800 U/m2,本例患者采用L-DEP方案化疗共3疗程,在化疗结束4 d后再次出现急性肝损伤,且与急性胰腺炎起病同步,噬肝病毒学及肝抗原谱、自身抗体系列均阴性,肝穿活检病理提示汇管区扩大,间质水肿,边缘细胆管增生明显伴细胆管内胆栓,肝细胞大泡性脂变(40%),结合RUCAM评分9分,考虑患者药物性肝损伤诊断明确,给予积极内科药物治疗,总体预后较好,可能与及时给予保肝治疗并停止化疗、遏止肝功能进一步恶化等有关。
2009 年在国内上市的左旋门冬酰胺酶的替代药物培门冬酶,因其半衰期长、过敏反应发生率低的特点逐渐在临床推广使用[4]。其机制为水解门冬酰胺,使肿瘤细胞不能合成其生长必需的氨基酸门冬酰胺,抑制肿瘤生长,被广泛应用于急性淋巴细胞白血病和NK/T 细胞淋巴瘤的治疗中,也极大地提高了患者的长期生存率[5],但目前对培门冬酶治疗的安全性研究并不多。培门冬酶是聚乙二醇化学偶联修饰后新的门冬酰胺酶抑制剂,其主要不良反应包括胃肠道反应、过敏、血常规三系下降、可逆性肝功能损害和凝血异常、胰腺炎等,由于培门冬酶多与其他药物联合应用,肝功能损伤在应用培门冬酶后的确切发生率并不清楚。其临床表现具有多样性,以消化道症状、肝肿大、黄疸为主,化验指标表现为转氨酶、碱性磷酸酶、胆红素的增高与低白蛋白血症。丛佳等[6]回顾性分析129 例使用培门冬酶治疗淋巴系统肿瘤的患者,出现3倍以上的转氨酶增高者占19.4%, 胆红素升高超过1.5倍者占11.6%,同时应用保肝药物以及补充白蛋白治疗后,所有患者肝功能指标均恢复到安全范围。最近国外一项治疗成人急性淋巴细胞白血病的结果显示[7],严重高胆红素血症与严重转氨酶增高的发生率分别为31.4%、64.7%,经过保肝治疗后肝损伤恢复,但并不影响再次应用该方案继续治疗。我国一项应用含培门冬酶治疗成人急性淋巴细胞白血病的研究显示[8],肝功能损伤的发生率为20.4%,同其他一些常见化疗药物相比,肝功能损伤尤其是低白蛋白血症的发生率较高。培门冬酶引发肝功能损伤的机制可能有以下几种:①直接损伤肝细胞:化疗药物及其代谢产物引起直接的细胞应激(内源性途径),通过直接的毒性作用损伤肝细胞或干扰肝细胞的代谢,破坏肝细胞的结构;②激活免疫反应(外源性途径):化疗药物作为抗原或半抗原诱发体内细胞免疫及体液免疫的激活导致肝细胞坏死,出现肝功能损伤;③药物代谢因素:化疗联合用药及化疗过程中多种支持治疗药物的使用使药物毒副作用增加,药物之间相互作用还可以抑制肝脏解毒功能导致药物毒性增加,加重肝细胞损伤[9]。
药物性肝损伤是临床常见的化疗药物不良反应之一,约占所有化疗药物所致不良反应的10%~15%[10]。由于化疗相关性肝损伤缺乏典型的临床症状,故诊断起来比较困难,且目前没有统一的诊断标准,诊断主要依靠病史、生化指标检测、影像学检查及肝活检,它的易感因素包括药物自身因素和个体因素,其中使用具有肝毒性的化疗药物是最重要因素,对于化疗药物调查显示,各类抗肿瘤药物均能引起肝损伤,主要以多种药物综合作用引起的肝损伤为主,因此存在联合使用化疗药物时要注意每周动态复查肝功能,观察肝功能指标应以转氨酶为主,同时注意胆红素及碱性磷酸酶的变化,早期发现并及时干预,以免延误病情。