白斑综合症病毒极早期蛋白WSV403相互作用蛋白的筛选
2019-08-30马艳丽
马艳丽,李 钫,杨 丰
(自然资源部第三海洋研究所、海洋生物遗传资源重点实验室,福建 厦门361005)
白斑综合症病毒(WSSV)是DNA病毒,呈双链环状,在分类上属于线性病毒科,白斑病毒属(Whispovirus)[1],是导致对虾白斑综合症的元凶。该病毒具有发病快、传播范围广、致死率高的特征,长期困扰着全球的对虾养殖业[2-6]。目前,虽然可以通过健康的养殖模式与密切的病原监测来预防WSSV的感染,但是该病毒一旦在养殖池暴发我们仍然是无计可施。
了解病毒的感染机制是建立有效防治方法的基础。DNA病毒的极早期(Immediate Early)基因是控制感染的起始以及从潜伏期转换到增殖期的一类重要基因,这类基因可以借助宿主转录因子和RNA聚合酶II进行转录,无需利用新合成的病毒蛋白[7]。其编码的极早期蛋白能够通过错综复杂的策略调控宿主的生理与免疫状态,营造有利于病毒复制的环境[8-9]。因此,针对病毒极早期蛋白功能的研究对认识病毒感染的核心机制是十分重要的。根据病毒的转录时相特征,WSSV基因可以分为极早期、早期和晚期基因3种基因类型[10]。到目前为止,研究人员利用基因芯片以及RT-PCR等实验方法,已从WSSV中鉴定出21个极早期基因[11-13]。
其中极早期基因WSV403编码的蛋白是一个包含Ring-H2结构域的E3泛素连接酶[14]。该蛋白在E1泛素激活酶和E2泛素结合酶存在的情况下,能被聚泛素化[15]。此外,研究者发现WSV403基因能够在无特异致病原的虾中转录[16],它还能与另一个潜伏相关蛋白WSV427的互作因子蛋白磷酸酶结合[16-17],提示了WSV403与WSSV的潜伏之间存在联系[13]。但是,WSV403如何在WSSV的感染过程中发挥作用仍然属未知。
为进一步了解WSV403的作用机制,本研究中我们以293T细胞为表达系统,利用串联亲和纯化技术和蛋白质谱技术筛选WSV403的相互作用蛋白,进一步对部分基因进行了克隆表达,并通过免疫共沉淀和免疫荧光分析验证它们之间的相互作用。
1 材料与方法
1.1 实验材料
1.1.1 抗体 一抗:鼠抗FLAG单克隆抗体、兔抗HA单克隆抗体,购自Sigma公司;Western-blot二抗:山羊抗小鼠偶联AP抗体、驴抗兔偶联AP抗体,购自Sigma公司;免疫荧光二抗:驴抗鼠偶联Alexa Fluor 488抗体、山羊抗兔偶联Alexa Fluor 546抗体,购自Thermo Fisher公司。
1.1.2 质粒 慢病毒包装质粒pMDLg/pRRE、pVSV-G、pRSV-REV由厦门大学韩家淮教授赠予。载体pLL-Strep-FLAG和pCMV-HA由自然资源部第三海洋研究所李增鹏博士提供。载体pcDNA3.1-WSV403-FLAG和pcDNA3.1-WSV403H348T-FLAG由本实验室保存。
1.2 细胞的培养和转染
人胚肾细胞293T(HEK 293T,美国种质保藏中心)培养在体积分数为10%的胎牛血清的DMEM高糖培养基中,培养条件为37°C,5%CO2。转染前12 h,将细胞(约4×106cells)接种在10 cm培养皿中,用聚乙烯亚胺(PEI)进行转染。将10μg质粒DNA和30 mm3浓度为50μmol/dm3PEI溶液分别用0.5 cm3Opti-MEM(Gibco公司)稀释,室温放置10 min。将PEI溶液加入DNA溶液中,涡旋混合,将混合物在室温下孵育20 min,随后滴加到细胞培养液中,6 h后换新的培养基培养。
1.3 慢病毒的包装和稳定细胞系的产生
1.3.1 WSV403慢病毒表达质粒的构建 本研究利用不依赖于连接酶的克隆方法(Ligation Independent Cloning,LIC)进行基因克隆[18]。以实验室保存的含有WSV403基因的质粒为模板,用WSV403-LIC-F以及WSV403-LIC-R引物(表1)进行PCR扩增,在其两端引入与载体插入位点两端同源的序列;将pLL-Strep-FLAG用Bam HI和Xho I酶切。用琼脂糖凝胶电泳检测并纯化回收目的条带与酶切载体之后,利用核酸外切酶III将WSV403基因连接到pLLStrep-FLAG载 体 上[19],获 得pLL-Strep-FLAGWSV403。其中WSV403与Strep以及FLAG标签融合表达。

表1 所用引物序列Tab.1 Primers used in this study
1.3.2 慢病毒的包装 本研究将慢病毒包装质粒(pMDLg/pRRE、pVSV-G、pRSV-REV)与pLL-Strep-FLAG-WSV403或pLL-Strep-FLAG质粒共转染到293T细胞中。转染72 h后收集含有病毒的培养上清液,用0.45μm过滤器过滤。
1.3.3 慢病毒感染目的细胞及其与稳定细胞系的制备 将293T细胞接种在6孔板(2×105cells/孔)中并培养过夜。弃原培养基,加入1.5 cm3完全培养基、0.5 cm3病毒上清液与16μg Polybrene,孵育36 h。用8μg/cm3浓度的嘌呤霉素对阳性细胞进行筛选。在筛选压力下培养7 d,获得稳定表达WSV403的293T细胞。
1.4 串联亲和纯化分离多蛋白复合体以及蛋白的质谱鉴定
用胰蛋白酶消化细胞(2×108cells),于2 300 r/min离心5 min收集细胞,用pH为7.4的裂解液(30 mmol/dm3Tris-HCl、150 mmol/dm3NaCl,体积分数为0.5%的Nonidet-P40,1 mmol/dm3蛋白酶抑制剂)重悬,并置于冰上裂解1 h。离心去除细胞碎片,用0.45μm针头过滤器过滤上清液。将裂解液与0.2 cm3Strep Tactin凝胶(GE Healthcare公司)在4℃下孵育4 h。然后,用pH为7.4的洗涤液(30 mmol/dm3Tris-HCl、150 mmol/dm3NaCl,体积分数为0.1%的Nonidet-P40,1 mmol/dm3蛋白酶抑制剂)洗3次,用体积为0.5 cm3脱硫生物素洗脱液(2 mmol/dm3脱硫生物素、30 mmol/dm3Tris-HCl、150 mmol/dm3NaCl,pH为7.4)洗脱结合的蛋白复合物。随后向洗脱液中加入50 mm3anti-FLAG M2亲和凝胶珠(Sigma公司),并在4℃孵育1 h。介质依次用0.5 cm3洗涤液洗涤1次,用0.5 cm3TBS缓冲液(30 mmol/dm3Tris-HCl,pH为7.4,150 mmol/dm3NaCl)洗涤2次,随后用0.1 mol/dm3,pH为3.0的甘氨酸-盐酸缓冲液洗脱蛋白复合物。所得的产物由上海鹿明生物科技有限公司进行LC-MSMS质谱分析。
1.5 候选蛋白的克隆
从厦门大学韩家淮教授实验室获得包含目标基因的质粒。根据基因序列设计引物(表1),以菌液为模板PCR扩增目的基因,在其两端插入与载体插入位点两侧同源的15 bp序列。将pCMV-HA载体用Eco RI和Xho I双酶切。用琼脂糖凝胶电泳检测并纯化回收目的条带与酶切载体之后,利用核酸外切酶III将目的基因连接到pCMV-HA载体中,并转化大肠杆菌。利用载体引物pCMV-R(表1)与目的基因引物进行菌落PCR筛选阳性克隆,送厦门铂瑞生物公司测序。将验证无误的克隆进行扩大培养,利用Endo-Free Plasmid Maxi Kit(OMEGA公司)纯化重组质粒。
1.6 免疫共沉淀和Western blot分析
细胞转染48 h后,用PBS洗涤1次,用裂解液(体积分数为1%的Nonidet-P40,500 mmol/dm3NaCl,50 mmol/dm3Hepes-KOH,5 mmol/dm3EDTA,pH为7.8,使用前加入2 mmol/dm3PMSF、2.5 mmol/dm3DTT和1 mmol/dm3蛋白酶抑制剂)冰上裂解1 h,于10 200 r/min下离心10 min去除沉淀。保留50 mm3上层清液用于后续分析。剩余上清液与50 mm3的anti-FLAGM2亲和凝胶珠在4℃孵育4 h。收集介质,用预冷的洗涤液(体积分数为0.2%的Nonidet-P40,TBS缓冲液,2 mmol/dm3PMSF,2.5 mmol/dm3DTT,1 mmol/dm3蛋白酶抑制剂)洗涤4次。用1×SDS loading buffer重悬介质,煮沸,并于10 200 r/min离心去除沉淀,获得蛋白样品。用SDS-PAGE电泳分离蛋白样品,并转移到PVDF膜上。转移了蛋白的PVDF膜用质量分数为5%的脱脂牛奶(BD公司)封闭30 min后,用相应的一抗孵育。用TBST缓冲液(TBS缓冲液,含体积分数为0.1%的Tween 20)洗涤3次之后,孵育AP偶联的二抗。最后,用硝基蓝四唑啉/5-溴-4-氯-3-吲哚基磷酸(NBT/BCIP,Roche公司)试剂显色。
1.7 免疫荧光分析
细胞培养在玻璃盖玻片上,转染24 h后,取出盖玻片,细胞依次用质量分数为4%的多聚甲醛固定10 min,用体积分数为0.5%的Triton X-100通透1 min,随后用PBS洗涤1次;细胞样品用质量分数为2%的BSA封闭30 min之后,依次用相应的一抗和二抗杂交;随后用1μg/cm3DAPI(4,6-联脒-2-苯基吲哚)染细胞核2 min;在洗涤封片之后,通过共聚焦显微镜(Leica Tcs SP5,德国徕卡公司)分析蛋白的亚细胞定位。
2 结果与讨论
2.1 串联亲和纯化与质谱筛选WSV403的相互作用蛋白
研究一个蛋白的相互作用因子是了解该蛋白功能的一个重要途径。在本研究中,我们利用串联亲和纯化以及质谱鉴定的技术对WSSV极早期蛋白WSV403相互作用因子进行了筛选。由于缺乏WSSV宿主动物(包括对虾和螯虾)的基因组以及蛋白信息,也没有能够高效重组表达外源基因的细胞系,本研究利用哺乳动物表达系统来进行蛋白表达和亲和纯化实验。首先将WSV403基因克隆到慢病毒表达载体中,与2个Strep以及1个FLAG标签融合表达;利用重组慢病毒对293T细胞进行感染,进一步利用嘌呤霉素对阳性细胞进行筛选,获得了稳定表达WSV403的293T细胞。我们分别将稳定表达WSV403的293T细胞和表达空载体的细胞(阴性对照)裂解,用亲和Strep以及FLAG标签的介质纯化裂解液中的带有两种标签的蛋白及其复合体,并进行蛋白质谱分析,鉴定复合物中的蛋白。将来源于WSV403稳定表达株的产物与阴性对照组比对,剔除在阴性细胞中也存在的非特异性粘附蛋白。获得15个可能与WSV403结合的候选蛋白,其中核转运蛋白(KPNA6)、丝/苏氨酸蛋白磷酸酶2A 65 kDa(PPP2RIA)、striatin(STRN)、纤维原细胞生长因子受体致癌基因伴侣(FGFRIOP)和核孔蛋白50(NUP50)等蛋白分值较高,说明它们与WSV403结合的可能性较大,因此我们将进一步克隆这些蛋白的基因并分析它们与WSV403的相互作用。
2.2 候选相互作用蛋白的克隆
从厦门大学韩家淮教授实验室获得包含KPNA6、PPP2RIA、STRN、FGFRIOP和NUP50基因cDNA的重组大肠杆菌,以菌液为模板,利用相应的引物(表1)进行PCR扩增,获得了上述基因的cDNA。然后利用LIC克隆法,将目的基因插入pCMV-HA载体,得到重组质粒,并转化大肠杆菌。利用菌落PCR鉴定含有插入片段的克隆(图1),并进一步测序分析。结果表明我们成功地获得了FGFRIOP、STRN、PPP2RIA、NUP50和KPNA6基因的重组表达质粒pCMV-FGFRIOP-HA、pCMV-STRN-HA、pCMVPPP2RIA-HA、pCMV-NUP50-HA和pCMV-KPNA6-HA。在这些质粒中,候选相互作用蛋白与HA标签融合表达。

图1 目的基因重组表达质粒的菌落PCR鉴定Fig.1 Identification of recombinant gene expression plasmid by colony PCR
2.3 候选蛋白与WSV403相互作用分析
为了鉴定WSV403与这些候选蛋白的相互作用,我们将候选蛋白的重组表达载体分别和pcDNA3.1-WSV403-FLAG共转染。同时,我们也构建了突变了Ring-H2结构域突变体WSV403H348T,以分析这些互作与Ring-H2结构域的关系。此外,本实验中我们使用单独过表达候选蛋白的细胞作为阴性对照。转染48 h后,用anti-FLAGM2亲和凝胶珠免疫沉淀FLAG-WSV403蛋白复合体,利用anti-HA及anti-FLAG抗体检测免疫沉淀复合物中的蛋白。
结果显示外源蛋白均可以在293T细胞中正常表达(图2)。候选蛋白中,KPNA6(图2a)、PPP2RIA(图2b)和STRN(图2c)可以与WSV403或者WSV403H348T相互作用,而NUP50(图2d)与FGFRIOP(图2e)均不能与WSV403或WSV403H348T相互作用。
2.4 WSV403与候选蛋白的亚细胞定位
为了进一步证实WSV403与上述蛋白之间的相互作用,我们在293T细胞中共表达目标蛋白和WSV403/WSV403H348T(图3),通过免疫荧光实验,分析两者的亚细胞定位。
单独过表达WSV403时,该蛋白在细胞质中呈点状分布(图3a);突变Ring-H2结构域的突变体WSV403H348T,则均匀分布于细胞质(图3b)。
当候选蛋白与WSV403或者WSV403H348T共表达时,蛋白在细胞中定位情况如图4、5所示。当FGFRIOP与WSV403(图4a)共表达,两者共定位于细胞膜和细胞核附近;当FGFRIOP与WSV403H348T共表达时(图5a),则两者均匀分布于细胞质。当WSV403或者WSV403H348T分别与KPNA6(图4b、5b)和NUP50(图4c、5c)共表达时,KPNA6和NUP50均分布于细胞核,与WSV403和WSV403H348T均不存在共定位。当WSV403分别与PPP2RIA(图4d)以及STRN(图4e)共表达时,它们呈点状共定位于细胞质。而当WSV403H348T分别与PPP2RIA(图5d)及STRN(图5e)共表达时,它们都均匀分布于细胞质中。
2.5 讨论
泛素化是一种重要的蛋白翻译后修饰,主要表现在降解细胞内蛋白和调节蛋白功能[20-23]。病毒可借助泛素化过程调控宿主细胞的生理活动,使得细胞内环境利于病毒感染复制。WSSV的E3连接酶WSSV222参与泛素化过程和肿瘤抑制蛋白的降解,从而抑制细胞的凋亡,保障病毒复制的进程[24]。同样,蛋白WSV403也属于E3连接酶。前期的工作已经证明了它具有自泛素化的活性[16],但是对于该蛋白作用的底物以及它在病毒感染中所扮演的角色我们仍然不清楚。
了解一个蛋白的相互作用因子是认识其功能的一个重要手段。本研究利用串联亲和纯化以及质谱鉴定的技术对WSSV极早期蛋白WSV403相互作用因子进行筛选。由于缺乏WSSV宿主动物的基因组以及蛋白信息,也没有能够高效重组表达外源基因的细胞系,本研究利用哺乳动物表达系统来进行蛋白表达和亲和纯化实验,获得了15个候选蛋白。我们进一步通过免疫共沉淀及免疫荧光对其中的5个蛋白KPNA6、PPP2RIA、STRN、FGFRIOP和NUP50与WSV403的相互作用进行了验证。证实KPNA6、STRN和PPP2RIA与WSV403存在相互作用(图2)。当WSV403的Ring-H2结构域被突变之后,虽然蛋白的亚细胞定位发生了改变,但是它们与这3个蛋白的相互作用并没有被破坏,这说明KPNA6、STRN和PPP2RIA与WSV403的结合与该结构域是无关的。

图2 WSV403与重组蛋白关系的Western-blot检测结果Fig.2 Relationship between WSV403 and recombinant protein detected by Western-blot
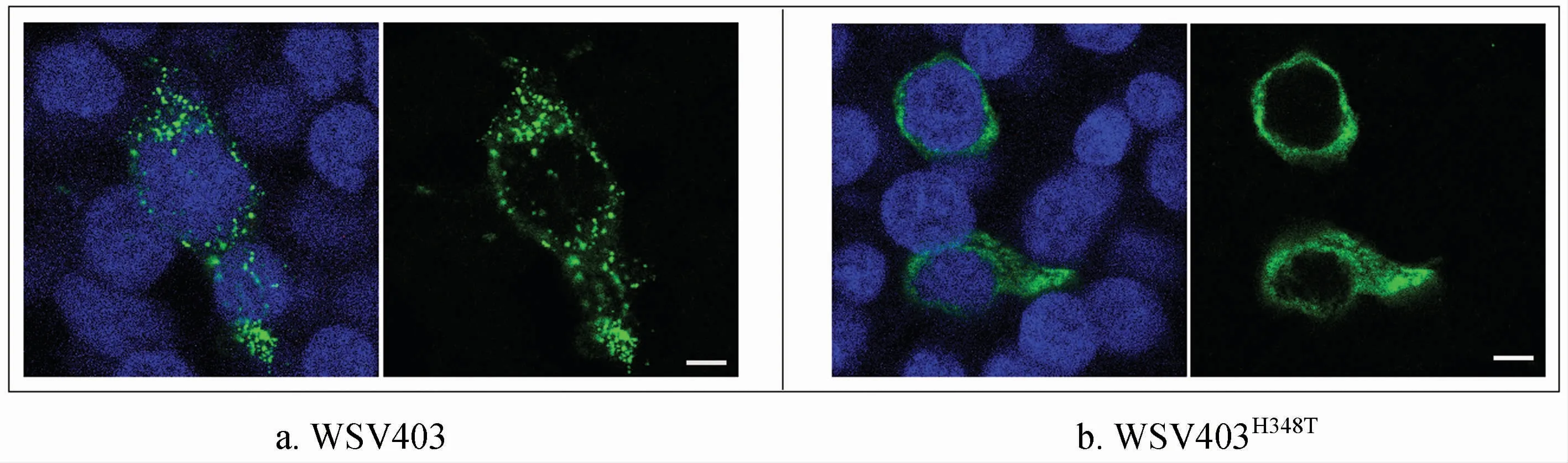
图3 WSV403蛋白及其突变体的亚细胞定位免疫荧光分析结果Fig.3 Immunofluorescence analysis of WSV403 protein and its mutant subcellular localization
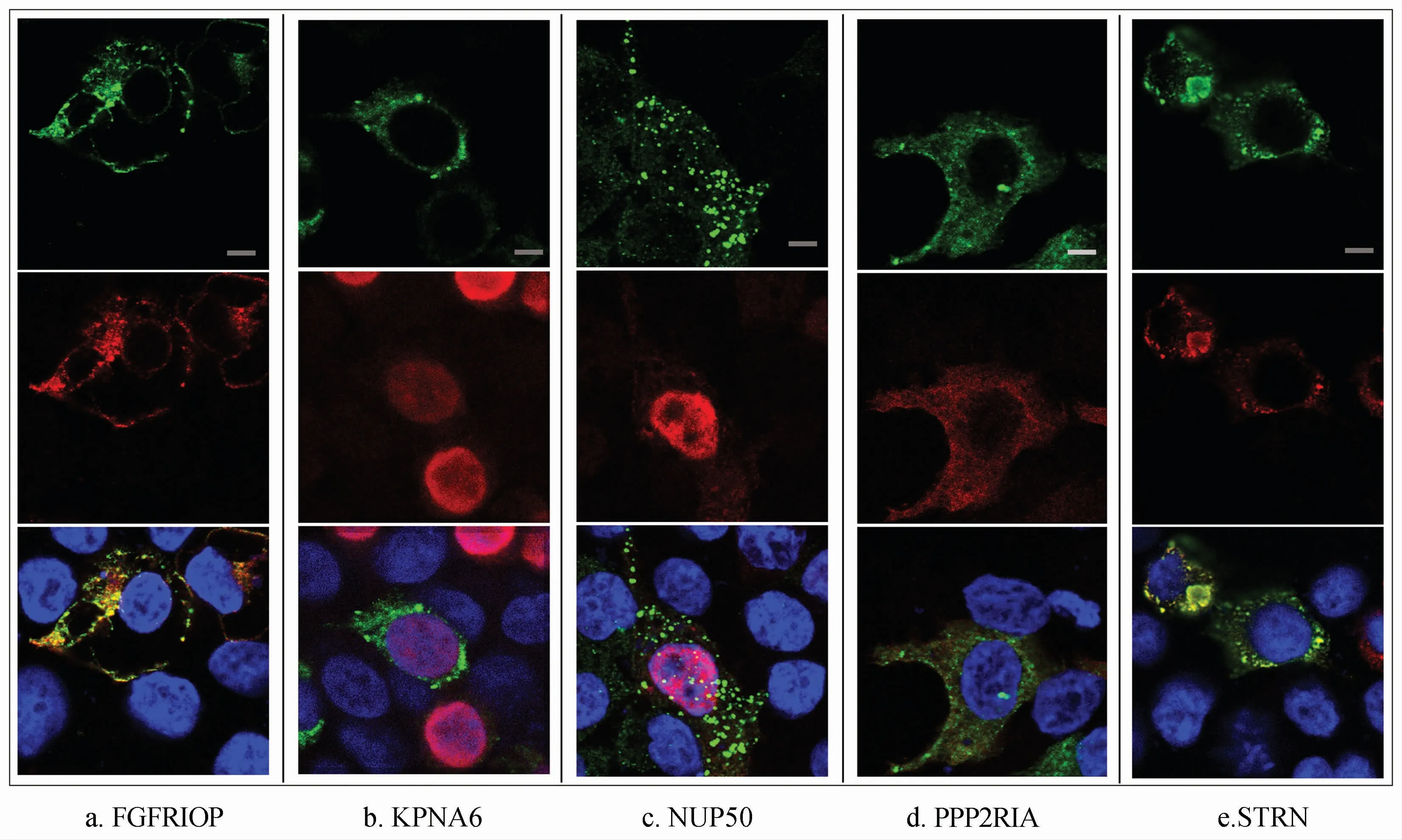
图4 WSV403蛋白和重组蛋白共表达时的亚细胞定位Fig.4 Subcellular localization in the co-expression of WSV403 protein and recombinant protein
对其他动物的研究表明,KPNA6能够结合细胞质中含有核定位信号的蛋白参与蛋白的入核运输[25];此外,该蛋白还可参与埃博拉病毒EBOV包涵体的形成和复制[26]。我们推测WSV403结合KPNA6以后也可能被运输入核内,促进WSSV基因组的入核,或者对宿主基因表达进行调控,帮助WSSV完成基因组复制。研究证实STRN是牛瘟病毒RNA聚合酶L蛋白的互作因子[27],可能参与了该病毒的基因组复制。而且striatin家族蛋白在细胞中参与很多生理活动如细胞运输、内吞、细胞分裂。细胞表达定位分析表明STRN与WSV403在细胞质存在点状共定位(图3e),因此我们推测WSV403结合STRN蛋白参与细胞运输,帮助WSSV进入宿主细胞从而促进病毒感染。另外,丝/苏氨酸磷酸酶PPP2RIA,可以与striatin家族形成STRIPAK多蛋白多功能复合体[28],在囊泡运输、细胞分裂、抑制凋亡等过程中发挥重要作用。这些研究表明WSV403与PPP2RIA相互作用很可能是将其泛素化,通过改变细胞磷酸化水平,调控WSSV的复制周期,以及抑制宿主细胞的凋亡为病毒复制创造条件。
3 结论
本研究利用串联亲和纯化与质谱技术筛选WSSV极早期蛋白WSV403的相互作用因子,通过免疫共沉淀和免疫荧光分析证明了WSV403与KPNA6、STRN和PPP2RIA存在相互作用,为深入研究WSV403的功能及其在病毒感染过程中的作用奠定了基础。在接下来的工作中,我们将克隆虾的同源基因并进一步分析WSV403与它们的相互作用,以及这种相互作用对病毒感染的重要性。
