UV/H2O2工艺降解饮用水中有机微污染物研究进展
2019-08-30杜振齐王永磊田立平亓华刘威
杜振齐王永磊田立平亓华刘威
(1.山东建筑大学市政与环境工程学院,山东济南250101;2.潍坊市市政公用事业管理处,山东潍坊261041;3.新泰市自来水有限公司,山东泰安271200)
0 引言
我国水资源较为短缺,整体水污染形式严峻。根据《2016年中国水资源公报》[1]显示,2016年全国地表水体中Ⅳ~劣Ⅴ类的水占到32.3%,地下水监测点位中水质为较差级和极差级的监测点占60.1%,部分水体还存在着一定有毒有机物污染状况[2]。水中的有机微污染物主要来源为:农药(杀虫剂、除草剂、有机磷农药、拟除虫菊酯类等)、药品及个人护理品(抗生素、消炎药、香料、洗护用品等)、工业原料产品(有机溶剂、石油化学品及其衍生物、合成洗涤剂等)、水体天然有机物 NOM(Natural Organic Matter)(2-甲基异茨醇、2,4,6-三氯苯甲醚和某些植物性、真菌性雌激素等)[3-4],具有浓度低、分布范围广、化学结构稳定、半衰期较长和生物累积现象明显等特点。
目前,常规水处理工艺只能去除大分子量和疏水性有机物,消毒剂本身或其消毒副产物存在毒性,特别是原水中的有机微污染物化学结构稳定、半衰期长,常规水处理工艺难以将其有效去除[5],在原水水质状况日益复杂的情况下,饮用水安全性难以得到保障。UV/H2O2高级氧化工艺借助紫外光的活化作用分解H2O2,产生羟基自由基(·OH),依靠·OH的强氧化性分解乃至矿化天然水体中的有机微污染物。该工艺凭借操作简单、价格低廉等优势在饮用水消毒领域得到了越来越多的关注[6-7]。文章着重从UV/H2O2工艺降解有机物技术原理、反应影响因素及工艺现存问题3个方面对UV/H2O2工艺去除水体有机微污染物的研究进行了综述。
1 UV/H2O2工艺降解饮用水中有机微污染物原理概述
高级氧化技术以水溶性有机污染物为去除重点,其适用性已在饮用水(地表水源、地下水源)和废水处理中得到了证明[8-10],其反应机理是利用自由基供体(如H2O2、O3)与光照、超声波相结合产生·OH,并利用·OH的非选择性和较高的氧化还原电位(E0=2.80 V)分解水体中的有机微污染物[11-12]。·OH能够与大多数生物大分子和有机物通过不同路径发生反应并使之降解为小分子有机物,甚至直接将其矿化为CO2和H2O,且反应速率常数通常>106L/(mol·s)。此外·OH具有极强的亲电子能力,其电子亲和能高达569.3 kJ,所以对电子云密度高的区域具有较强的攻击能力。·OH与有机物质反应主要通过脱氢反应、亲电加成和电子转移3种路径进行[13]。
H2O2具有在低浓度下安全性高、制备成本较低和绿色健康无污染等优势,是一种理想的自由基供体[3],近年来在高级氧化工艺中得到了广泛应用。H2O2在紫外光作用下产生·OH,从而引发了自由基链式反应。典型的链式反应包括链引发、链增长和链终止过程,其具体反应机理由式(1)~(6)[14]表示为
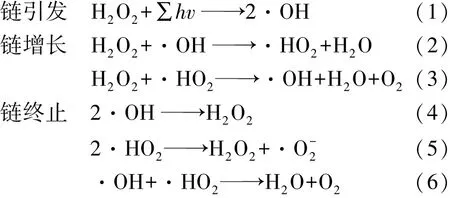
式中:h为普朗克常数;v为光的频率,Hz。
一般认为,UV/H2O2高级氧化作用的实现主要通过3种途径[15-17],即(1)紫外光产生的有效光子带来的光降解作用直接解离有机物内部的分子键;(2)H2O2产生的直接氧化作用;(3)·OH的间接氧化作用,即1分子的H2O2在紫外光的照射下产生2分子的·OH,其与有机物发生氧化还原反应。起主导的一般为·OH的氧化作用,羟基化过程是其氧化有机物的必经途径,根据目标有机物性质的不同可能伴随有脱氢、加成、水解等过程的发生。经羟基化过程形成的中间产物进一步与·OH反应部分,被完全矿化为CO2和H2O。
2 UV/H2O2工艺降解饮用水中有机微污染物效果影响因素评价
UV/H2O2高级氧化技术对目标特性物的去除效果受多种因素的影响和制约。文章着重介绍了UV、水体中 NOM、溶液 pH值、目标物初始浓度、H2O2投加量和溶液中无机阴离子等几个方面对UV/H2O2工艺的影响效果和其作用机理,力求对相关科学研究工作及生产实践活动提供参考。
2.1 UV的影响
UV/H2O2高级氧化技术能够高效率去除有机污染物的核心是UV对H2O2的催化,UV各项指标的改变对反应的作用效果存在显著的差异性。因此,应从光化学的角度分析UV特性对反应的影响效果,探究其存在的规律。
UV是指波长范围为100~400 nm的电磁波,按照波长范围可分为315~400 nm的长波(UV-A)、280~315 nm 的中波(UV-B)、200~280 nm 的短波(UV-C)和100~200 nm的真空紫外线(UV-D)。常见化合键键能及对应能量相近的特定光子波长见表1[18]。原则上这些化合键在吸收了对应波长的光子后会发生裂解。由表1可知与O—H键键能相近的紫外光波长为257 nm,在实际生产实践中综合考虑光能和光子穿透性后采用波长为254 nm的紫外光作为光源[19]。

表1 常见化合键键能及对应能量相近的光子波长表
1905年,Einstein[20]提出了光化学第二定律:在初级光化学反应过程中,被活化的分子(原子)数等于吸收光的量子数,分子对光子的吸收是单光子过程。即若使1 mol的分子(原子)处于激发态,需接收1 mol的光子,其能量用E表示。由此可知,光化学反应的进行程度与单位时间内吸收光的量子数成正比,亦与光强成正比,此定理又称为爱因斯坦光化当量定律,由式(7)表示为
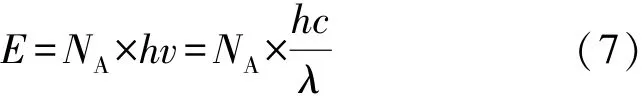
式中:NA为阿伏加德罗常数;c为光速,m/s;λ为光量子波长,nm。
波长越短的UV所含激发态能量E越高,但UV波长<200 nm时会被O2吸收,导致穿透力较差,因此无法得到有效利用。紫外光辐射剂量受紫外光强和照射时间的影响。曾宁[21]在利用UV/H2O2工艺去除典型嗅味物质的研究过程中发现,增大光强可提高土臭素的去除率。Peng等[22]在利用UV/H2O2技术去除水中布洛芬的研究中利用响应面分析发现,增加光强会得到更大的反应速率常数,其中紫外光子是·OH产生的关键因素。Srithep等[23]在对比利用UV/H2O2工艺去除卤代乙腈前体的研究中发现,在H2O2浓度为9 mg/L的初始条件下,随着反应时长由10 min延长至40 min,二氯乙腈的剩余率由80%逐步降低至49%。Rezaee等[24]在研究响应面法优化UV/H2O2高级氧化降解天然有机物的应用中考察了反应时间对总有机碳TOC(Total Organic Carbon)除去率的影响,随着处理时间从10 min增加到30 min,TOC的去除率逐渐增加并且在30 min时达到最大值。
由光化学第二定律可知,在恒定光照时间内增加UV强度或在一定光强下延长光照时间均可增加单位时间内水溶液中分子吸收光的量子数,因此可加快反应的进行程度。又因分子对光子的吸收是单光子过程,当UV强度或光照时长达到一定程度时,即每个目标特性物分子均可吸收一个光子时,继续提高UV强度或延长光照时间对反应进行程度的提高效果不明显,且会降低系统经济性,因此上述2种参数应控制在合适范围内。在实际应用中,常采用综合性指标电能效率EEO代替分项指标(紫外光强和照射时间)对系统经济性进行评价,即在单位体积(1 m3)待处理水中,目标污染物含量每一对数级的降解所消耗的电能[25],其值与紫外灯管功率成正比,与反应速率常数成反比。
2.2 NOM的影响
水溶液中NOM对UV/H2O2反应过程的影响主要归因于NOM对自由基的清除作用和NOM吸收紫外光子降低UV透射率2个方面,其中NOM对自由基的清除作用为主要原因。
·OH具有的非选择性会使其与水中存在的NOM发生反应,且化合物之间存在对·OH的竞争关系,因此产生了清除作用,降低了·OH对目标物的降解速率。Xie等[26]研究发现,与UV/过硫酸盐高级氧化过程相比,UV/H2O2高级氧化所产生的·OH对2种典型嗅味物质的降解效率更低,这归因于水中NOM对·OH的清除作用大于NOM对的。 Zhang 等[27]在对比 UV、UV/H2O2和 UV/过二硫酸盐工艺对水溶液中免疫抑制剂硫唑嘌呤降解效果的研究中发现,随着溶液中NOM浓度由0增至10 mg/L,UV/过二硫酸盐工艺中硫唑嘌呤的降解速率常数由0.677降至0.384,降幅为43%;UV/H2O2工艺中硫唑嘌呤的降解速率常数由0.365降至0.172,降幅为53%。产生此种差异的原因可能归结于NOM与·OH的反应速率常数为NOM与的反应速率常数的37倍,NOM对·OH有着更高的选择性。研究表明,原水中含有的NOM与·OH的反应速率常数约为 2×108~3×108L/(mol·s)[28-30],因此在试验设计中应充分考虑水中NOM的影响,做好配水试验与实际水体试验的对比,以衔接实验室研究与实际生产应用。
2.3 溶液pH值的影响
H2O2作为一种自由基供体,溶液初始pH值对其氧化还原电位及在水溶液中的形态影响较大,进而会影响到UV/H2O2工艺的运行效率。
Srithep等[23]在对比利用UV/H2O2工艺去除卤代乙腈前体的研究中考察了溶液pH值对反应的影响,结果表明:中性偏酸的反应环境有利于UV/H2O2反应的进行,在pH值分别为6、7和8时,UV/H2O2高级氧化技术对二氯乙腈的去除率分别为86%、78%和81%。Rezaee等[24]在利用响应面法优化UV/H2O2高级氧化降解天然有机物的研究中发现,中性偏酸性的溶液体系更有利于TOC的去除,在pH值为3~7的溶液中,TOC去除效率随着pH值的增加而增加。当溶液pH值由7升至11时,TOC去除率明显降低,TOC去除率在中性环境中达到最大。Zuorro等[31]认为中性pH值附近的较宽范围内,UV/H2O2工艺反应速率较为均衡,而在高酸性或高碱性条件下目标物降解率则有较大幅度的下降。Dadkhah等[32]在利用UV/H2O2工艺光氧化去除对硝基苯酚的研究中对溶液初始pH值的影响情况进行了考察,结果表明在pH值为5.5时,对硝基苯酚的除去效果达到最佳,溶液中pH值的降低或升高均会使对硝基苯酚的降解效率降低,其中pH值过高对反应的不利影响更为显著。总而言之,强酸、强碱环境对UV/H2O2工艺的运行均会产生不利影响。在高酸性环境下,H2O2会与溶液中·OH发生反应生成大量·HO2,·OH的生成受到抑制从而降低了反应速率[33],反应过程如式(2)所示。在高碱性环境下,溶液中的H2O2在UV的照射下被直接光解为H2O和O2,并分解生成·HO-2。作为一种自由基抑制剂,会与溶液中的有机物争夺·OH,从而降低了反应速率,相关反应过程由式(8)~(10)[32]表示为
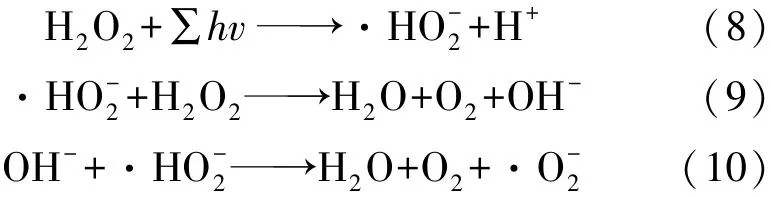
2.4 H2O2初始浓度的影响
H2O2作为自由基供体,其初始浓度对反应的进行有着重要影响。一般而言,H2O2初始浓度的增加会提高溶液中·OH的浓度,从而提高反应速率和目标物去除率。但相关研究表明,H2O2初始浓度和目标物去除率并不呈线性变化关系,H2O2的投加量存在着最适区间。
Rezaee等[24]在利用响应面法优化UV/H2O2高级氧化降解天然有机物的研究中考察了初始H2O2浓度对反应的影响,结果表明:随着 H2O2浓度由100 mg/L增加至180 mg/L,TOC的去除率由约74%提高到82%。Srithep等[24]在对比利用UV/H2O2工艺去除卤代乙腈前体的研究中发现,H2O2的投加量为3.5 mg/L时,二氯乙腈在反应20和40 min时的去除率分别为25%和27%,当H2O2的投加量增至10 mg/L时,二氯乙腈在反应20和40 min时的去除率分别增至31%和35%,而当H2O2的投加量为20 mg/L时,二氯乙腈的去除率与H2O2浓度为10 mg/L时相比无明显增加。Felis等[34]在研究UV/H2O2工艺降解内分泌干扰物壬基酚时考察了H2O2初始浓度的影响,结果表明:当H2O2的初始浓度分别为100、1 000 mg/L时,经过30 min反应后目标物的去除率>90%,而当H2O2的初始浓度增至10 000 mg/L时,经30 min反应后目标物的去除率则降低至约80%。随着H2O2投加量的增加,反应往往会出现最大的降解速率,可归纳为2方面的原因:(1)过量的H2O2会争夺光子,从而减少了UV对目标物的直接光解作用[34];(2)过量的H2O2充当了自由基侵蚀剂捕获溶液中的·OH生成副产物,从而抑制目标物降解效率。H2O2是一种较强的自由基抑制剂,其与·OH的反应速率常数为2.7×107L/(mol·s)[35],相关副反应过程表示由式(11)、(12)[31,34]表示为
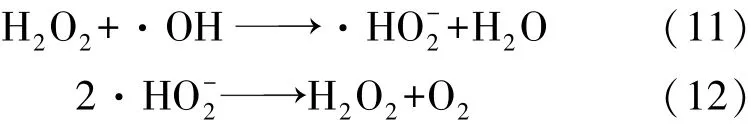
应探究UV/H2O2工艺对目标物去除过程中H2O2投加的最适浓度,以求达到高效性与经济性的统一。
2.5 目标物初始浓度的影响
就普通反应体系而言,增加反应物的初始浓度可以提高反应速率。但对于涉及光学反应的体系,目标物初始浓度变化的影响则更为复杂。在实际生产应用中,原水中有机物的浓度也存在着地域和时间的差异,因此研究目标物初始浓度对UV/H2O2高级氧化过程的运行有着重要意义。
Zuorro等[31]在利用UV/H2O2工艺降解磺化重氮染料的响应面法分析中发现,磺化重氮染料的初始浓度值和反应一级速率常数呈负相关。Acosta-Rangel等[36]在利用UV/H2O2工艺降解磺胺类药物磺胺二甲嘧啶的研究中发现,随着磺胺二甲嘧啶初始浓度由5 mg/L增加至15 mg/L,量子产率和反应动力学常数分别由 3.75×10-5mol/E、9.16×10-4S-1下降至 1.72×10-5mol/E、4.10×10-4S-1。 产生此类现象的原因可能归结于:(1)目标物对UV的屏蔽吸收作用;(2)在同等光强和照射时间的条件下,目标物浓度的增加会成比例地增加其对紫外光子的吸收量,进而提高光吸收系数。水溶液中的光化学反应由式(13)表示为
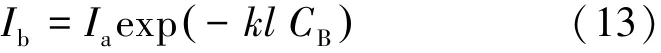
式中:Ia、Ib分别为入射、透射光光强,μW/cm2;k为光吸收系数;l为光透过介质层厚度,cm;CB为光透过介质浓度,mol/L。
结合式(13)可知k值的增加会使透过光强度呈指数级下降。同时某些目标物浓度的增加会提高溶液色度,降低溶液的透光率,使式(1)的反应速率下降,导致单位时间内·OH的产生量减少,最终使整个系统反应速率降低,相关反应过程由式(14)~(16)表示为
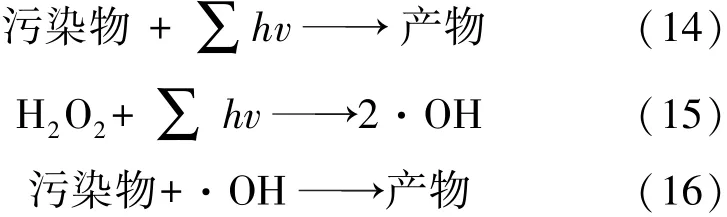
另一种可能的原因是目标有机物降解过程中所形成的中间产物如芳香化合物、醛类、酮类和有机酸等化合物与·OH发生反应,抑制了·OH对目标物的降解[24]。
2.6 无机阴离子的影响
Rezaee等[24]在研究响应面法优化UV/H2O2工艺降解天然有机物的应用中发现,的存在会与NOM竞争溶液中的·OH,从而导致NOM去除率降低。Zhang等[27]在利用UV/H2O2降解免疫抑制剂硫唑嘌呤的研究中也发现,水溶液中典型无机阴离子如对反应的进行均有抑制作用,且影响效果Yang 等[37]考察了 UV、UV/H2O2和 UV/过硫酸盐工艺降解磺胺甲恶唑过程中碳酸氢盐对反应的影响。当投加浓度分别为50和500 mmol/L时,溶液中的·OH浓度分别减少了74%和94%,作为一种自由基侵蚀剂与·OH反应生成,而作为一种氧化还原电位较低且具有高度选择性的自由基,对磺胺甲恶唑的降解有一定的抑制作用,相关反应过程由式(17)、(18)[38]表示为
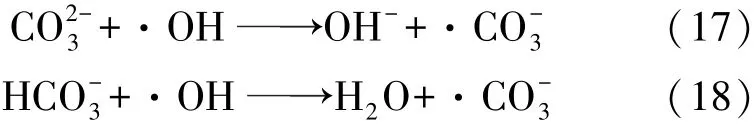
然而,并非在所有反应中无机阴离子均起到自由基清除剂的作用,如Acosta-Rangel等[36]在考察UV/H2O2工艺降解典型磺胺类药物中发现,利用天然水体进行实验可获得较纯水更高的反应速率和目标物去除率,水体中存在的无极阴离子(Cl-、HCO-3、也可对有机物的去除产生协同作用。李文贞[39]在其研究中也发现,在UV高级氧化工艺降解水体中氯贝酸的过程中,阴离子可对降解产生促进作用,且的促进作用大于 Cl-和目前,对UV/H2O2工艺反应过程中无机阴离子影响的考察多集中在影响效果和表观速率方面,深入机理及动力学方面的研究还较少。今后,UV/H2O2工艺相关研究可向此方向延伸。
3 UV/H2O2工艺降解饮用水中有机微污染物现存问题分析
3.1 有毒转化产物问题
虽然UV/H2O2工艺可高效降解水中有机微污染物,但在反应过程中大多数有机污染物并非矿化,而是部分氧化成转换产物,这也导致了高毒性转换产物的形成。研究表明:80%的UV反应中均检测到有毒转换产物的存在,相关原理示意图如图1所示[40]。UV/H2O2工艺在高pH值和Cl-存在的条件下,通过加成反应和取代反应与有机物结合生成可吸收卤化物,其为一类致癌、致突变物质,卤代消毒副产物的主要生成路径为含氧酸/次卤酸与溶解有机物之间的反应,其中反应量按照Cl<I<Br的顺序依次增加[41]。Urbano等[42]在对UV/H2O2工艺降解磺胺喹恶啉、氧氟沙星的中间产物进行定性分析中发现,其中间产物均为高毒性、持久性有机物,溶液的毒性在整个反应过程中一直呈增加态势。Shemer等[43]在其研究中也观察到经过UV/H2O2工艺处理后目标有机物二苯甲酮-4和二苯甲酮-9虽被完全反应,但水溶液的生物毒性呈增加趋势,证明降解过程中的中间产物为致突变类有机物。UV/H2O2工艺中间氧化副产物的形成受多种因素的影响,其中主要为UV剂量、硝酸盐浓度和水体中NOM的浓度。Rozas等[44]研究发现,在UV/H2O2工艺降解天然水体有机微污染物过程中,随着UV剂量由0增至900 mJ/cm2,溶液毒性呈先上升后下降的趋势;其他学者的研究中也观察到低UV剂量时形成的氧化中间产物在高剂量UV条件下被分解[45]。造成此现象的原因可能是氧化中间产物在高剂量UV的照射下进一步转化为低毒性有机物或发生矿化。Wols等[35]研究了各种实验条件对致突变类氧化中间产物形成的影响时发现,致突变有机物的含量随着溶液中硝酸盐浓度的增加而增加,致突变有机物的含量与水体中NOM的浓度呈正相关。这与其他学者的研究结果一致[46-47]。其原因可归为硝酸盐/亚硝酸盐与水中含有的NOM在UV的作用下形成含氮芳香化合物,如硝化苯酚衍生物等。
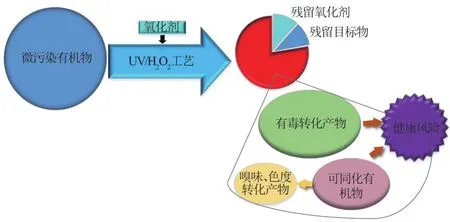
图1 UV/H2O2工艺氧化转换产物生成原理示意图
研究表明可通过控制UV/H2O2工艺的工况实现转化产物含量的有效降低[43]。但UV/H2O2工艺参数的优化往往是基于目标物的降解动力学或降解机理,以达到对目标物的最佳去处效果,而非控制氧化中间产物生成。因此,在UV/H2O2工艺运行过程中,如何优化和控制氧化中间产物的形成还有待进一步研究。
3.2 成本控制问题
虽然UV/H2O2高级氧化技术对水中有机微污染物有着良好的去除效果,但是成本问题限制了其在饮用水消毒领域的大规模应用。研究表明:UV/H2O2工艺中 H2O2利用率<50%[43],不仅造成了自由基供体的浪费,增加了运行成本,还引起了H2O2残留问题。因此UV/H2O2工艺往往与氯消毒或生物活性炭工艺相结合,以控制H2O2余量。
Guo等[48]在模拟饮用水环境中,对比研究了UV/氯和UV/H2O2工艺对28种典型药物及个人护理品的去除效果,并利用EEO参数对比了2种工艺的去除成本。结果表明:在目标物去除率为90%的条件下,UV/氯和UV/H2O2工艺的单位能耗值分别为0.017~2.26和0.17~2.38 kWh/m3。 由此可见,UV/H2O2工艺的EEO值高于UV/氯工艺,若将猝灭残余H2O2的成本也考虑在内的话,2种工艺的EEO值差距将进一步扩大。Acosta-Rangel等[36]在对比研究UV/过硫酸盐工艺和UV/H2O2工艺时也得出了类似结论。
UV/H2O2工艺EEO值受多种因素的影响,总结起来有3个方面:
(1)运行规模的影响
不同试验规模UV/H2O2工艺EEO值情况见表2[49]。可以看出随着试验规模由实验室研究增大至生产性试验,UV/H2O2工艺EEO值由2.2 kWh/m3逐步降低至0.5 kWh/m3,在实验室规模和中试规模的数据之间可以观察到显著差异性。这表明运行规模的增大提高了能源利用效率;也进一步说明实验室规EEO值对比不一定代表实际运行效果,条件允许的情况下EEO值应该根据在中试或生产性试验中确定的相关操作参数(氧化剂投加量、UV剂量)进行估算。

表2 不同试验规模UV/H2O2工艺EEO值对比表
(2)目标物反应速率及水质的影响
UV/H2O2工艺能量利用效率与目标物反应速率相关。研究表明EEO值与目标物的二阶速率常数呈负相关,即具有较高二阶速率常数的物质可在较低的能量时发生有效氧化[49]。但是由于统计结果的相关系数较低,因此目标物反应速率这一因素效果不显著。
原水水质对UV/H2O2工艺的影响主要体现为水的透光性及自由基清除剂含量。有较高清除剂浓度(如无机阴离子)和较高UV吸光度的原水会产生较高的EEO值。此外,地下水比地表水会产生更高的EEO值,可能是因为地下水中含有的和金属离子会与·OH反应降低其含量。
(3)灯管类型的影响
研究表明,低压紫外灯的UV/H2O2工艺的EEO值(0.4 kWh/m3)比中压紫外灯的(1.0 kWh/m3)更低。这是因为H2O2的紫外吸光度在波长<260 nm时增加,而低压紫外灯(所产生的254 nm波长紫外光占比例>35%)能量效率高于中压紫外灯(所产生的254 nm波长紫外光占比例>10%)[49]。
综合来看,UV/H2O2工艺EEO值主要受处理规模、原水水质和灯管类型的影响。在实际应用中,应根据原水水质、目标物性质等因素灵活确定UV/H2O2工艺各项参数,以达到运行效果和成本的最佳平衡。此外,可采取投加高效催化剂、进行工艺组合(如UV/H2O2/活性炭、UV/H2O2/O3)等措施降低UV/H2O2工艺系统运行成本,提高H2O2利用率,相关工艺及理论还需进一步研究。
4 展望
在自然水体有机污染日益严重的状况下,如何保障供水安全已成为一个现实的课题。综合文章论述可知,UV/H2O2高级氧化技术降解水体有机微污染物原理可行,但若想达到一个较为理想的去除效果,须控制好各影响因素,使系统达到最优工况,而且UV/H2O2工艺现存的有毒转化产物及过氧化氢残留、成本控制等问题也应引起足够的重视。
UV/H2O2高级氧化工艺的未来研究重点是:(1)加强实验室研究与生产性试验的衔接,使实验室研究成果尽快应用于实际生产中;(2)根据待处理水体的具体性质,结合UV/H2O2高级氧化工艺的各类影响因素,合理优化系统工况,以提高系统经济性;(3)强化UV/H2O2工艺毒理性研究,探究UV/H2O2工艺存在的潜在风险及应对措施,使UV/H2O2高级氧化工艺真正成为一种绿色健康的饮用水消毒技术;(4)制定UV/H2O2高级氧化工艺工程标准,使UV/H2O2工艺工程化应用做到有章可循。
