α-半乳糖苷酶基因在大肠杆菌中的表达及酶学性质研究
2019-08-30刁文涛向凌云王雪妍陈国参周伏忠
刁文涛,向凌云,宁 萌,王雪妍,马 焕,冯 菲,陈国参,周伏忠*
(1.河南省科学院生物研究所有限责任公司,河南 郑州 450008;2.河南省微生物工程重点实验室,河南 郑州 450008)
α-半乳糖苷酶(EC 3.2.1.12)能够将α-半乳寡糖、半乳甘露聚糖侧链、半乳糖脂和糖蛋白通过α-半乳糖苷键连接的非还原端的半乳糖苷残基逐个水解,释放出半乳糖[1-2]。该酶在食品、饲料等工业中有着广泛的应用[1]。在制糖工业中,α-半乳糖苷酶可以分解甜菜浆中的棉籽糖来提高蔗糖的回收率[3]。在饲料工业中,α-半乳糖苷酶可以分解饲料中的棉籽糖家族寡糖类抗营养物质,减少其在单胃动物饲喂中引起的腹胀和腹泻问题,同时又能提高饲料的利用率[2,4-8]。在造纸工业中,α-半乳糖苷酶还可以用来提高甘露聚糖酶对纸浆的漂白效果[3,9-10]。
α-半乳糖苷酶属于糖苷水解酶(glycosidehydrolase,GH),根据其氨基酸序列的同源性,将其归入GH 4、GH 27、GH 36、GH 57、GH 97和GH 110家族,其中以GH 27和GH 36家族成员最多。α-半乳糖苷酶在动植物和微生物中广泛存在[2,11-16],由于α-半乳糖苷酶的微生物来源最为广泛,易于基因工程操作,且大规模生产成本较低,所以得到了更广泛的关注[2]。细菌来源的α-半乳糖苷酶大部分归属于GH 36家族,能够水解分子质量较小的底物(包括人工合成的对硝基苯基底物和棉籽糖家族寡糖等),最适温度35℃~90℃各不相同,最适pH值一般在5.5~6.5[17-20],而真菌来源的α-半乳糖苷酶的最适温度一般在50~75℃,pH值一般在4.0~5.5[3,21-23]。目前,α-半乳糖苷酶性质研究的主要手段是以其基因为出发点,选择合适的表达系统,进行酶的异源表达,从而高效、明确地了解α-半乳糖苷酶的分子基础及酶学性质,为后续通过基因工程、蛋白质工程等技术手段对其进行修饰改性,开发其工业化应用价值,以及相关酶系的生物信息学等研究提供理论支持。并且通过异源表达的酶易于特异性纯化,避免了从原生菌株中直接分离纯化蛋白的复杂操作。微生物α-半乳糖苷酶异源表达系统一般选用的表达宿主包括大肠埃希菌(Escherichia coli)[22]、巴斯德毕赤酵母(Pichiapastoris)[3]以及丝状真菌如里氏木霉(Trichoderma reesei)等[24],最高酶活可达1 900U/m L[3]。
本实验室保存的一株链球菌(Streptococcus)S1在含有5-溴-4-氯-3-吲哚基-a-D-吡喃半乳糖苷(5-bromo-4-chloro-3-indolyl-a-D-galactopyranoside,X-α-gal)的培养平皿上呈现出明显的蓝色,说明其具有α-半乳糖苷酶活性。以该菌株含有的α-半乳糖苷酶基因为目的基因,在大肠杆菌(Escherichia coli)中进行异源表达与重组酶的纯化,并对其酶学性质进行了研究,为寻找更多不同性质的α-半乳糖苷酶以适应不同的需求奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
链球菌(Streptococcus)S1:本实验室分离保存;E.coli Top10感受态细胞、E.coli BL21(DE3)感受态细胞:全式金生物技术有限公司。
实验室改造质粒pET-M-3C:通过XbaⅠ和BamHⅠ双酶切,并经T4 DNA连接酶连接成新片段的方法去除质粒pET-32a的S-tag和Trx-tag,并将其thrombin(凝血酶)酶切位点替换为3C酶切位点(L-G-V-L-F-G-P)。
1.1.2 化学试剂
蛋白胨、酵母粉(均为生化试剂):北京奥博星生物技术有限责任公司;NaCl(分析纯):天津市恒兴化学制造有限公司;镍-琼脂糖凝胶、Tris饱和酚:北京索莱宝科技有限公司;对硝基苯(p-nitrophenyl,pNP)(分析纯)、对硝基苯-α-D-半乳糖苷(p-nitrophenyl-α-D-galactoside,pNPG)(纯度98%)、水苏糖(纯度98%):上海阿拉丁生化科技股份有限公司;蜜二糖(纯度99%)、棉籽糖(纯度99%):上海麦克林生化科技有限公司;冰醋酸(分析纯)、正丁醇(分析纯):国药集团化学试剂有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)限制性内切酶BamHⅠ和XhoⅠ:美国赛默飞世尔科技公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度定量试剂盒:北京市普利莱基因技术有限公司;氯仿、异戊醇(均为分析纯):天津市瑞金特化学品有限公司;细菌基因组提取试剂盒、质粒提取试剂盒:美国OMEGA BIO-TEK公司;2Es Taq MasterM ix(Dye)试剂:北京康维世纪生物科技有限公司。
1.1.3 培养基
MRS肉汤培养基:北京索莱宝科技有限公司。
LB培养基:蛋白胨10 g/L;酵母粉5 g/L;NaCl5 g/L,调pH值至7.4,用去离子水定容至1 000m L,121℃条件下灭菌20min。降至室温加入氨苄青霉素,质量浓度为100μg/m L。
1.2 仪器与设备
HYG-A恒温摇床:太仓市豪成实验仪器制造公司;MULTIFUGEX1R台式离心机、3001全波长酶标仪:美国赛默飞世尔科技公司;Hema L1低温连接仪:珠海黑马医学仪器有限公司;Biometra TProfessional聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐公司;M ini PROTEAN 3Cell垂直电泳仪、DYCP-31D水平DNA电泳仪:北京六一仪器厂。
1.3 方法
1.3.1 目的基因提取
(1)引物设计
利用细菌基因组提取试剂盒提取链球菌S1的基因组DNA,以提取的基因组DNA为模板,以通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')为引物,用2Es Taq MasterM ix(Dye)试剂进行PCR扩增(95℃预变性5min;95℃变性30s,54℃退火30 s,72℃延伸2m in,共30个循环;72℃再延伸5m in;16℃保温)获得16S rDNA,送测序公司测序,测序结果在https://blast.ncbi.nlm.nih.gov/Blast.cgi网站与数据库中的已有菌株的16S rDNA进行比较,鉴定菌种。根据鉴定结果,在美国国家生物技术信息中心(national centerofbiotechnology information,NCBI)数据库中找亲缘关系较近菌种中的α-半乳糖苷酶基因序列,利用软件Primer Premier5设计引物。
(2)目的基因扩增
以提取的链球菌S1基因组DNA为模板,以Sagal-F(5'-AGGGATCCATGGGA ATTCGCATCGAAGG-3')和Sagal-R(5'-AAACTCGAGTTATTGTTTCACGAAATAG-3')为引物,用2Es Taq MasterM ix(Dye)试剂进行PCR扩增(95℃预变性5min;95℃变性30 s,54℃退火30 s,72℃延伸2m in,共30个循环;72℃再延伸5min;16℃保温),获得目的基因片段。
1.3.2 基因克隆与载体构建
用BamHⅠ和XhoⅠ限制性核酶内切酶分别酶切目的基因片段和载体pET-M-3C,抽提沉淀后用T4DNA连接酶连接,然后转化到E.coli Top10感受态细胞中,涂布在加有100μg/m L氨苄青霉素的LB平板上,37℃培养16 h后,挑取单克隆,以Sagal-F和Sagal-R为引物进行菌落PCR筛选阳性克隆,挑取阳性克隆接种至含有100μg/m L氨苄青霉素的LB液体培养基中37℃振荡培养16 h后用质粒提取试剂盒提取质粒pET-M-C-Sagal,送测序公司测序。
1.3.3 蛋白表达与纯化
按E.coli BL21(DE3)感受态细胞转化操作说明书,将质粒pET-M-3C-Sagal转化到E.coli BL21感受态细胞中,涂布在加有100μg/mL氨苄青霉素的LB平板上,37℃培养16h后,挑取单克隆接种于5m L LB(含100μg/mL氨苄青霉素)液体培养基中,37℃、180 r/min培养6 h后转接入200m L LB(含100μg/m L氨苄青霉素)液体培养基中,37℃、180 r/min培养至OD600nm值达到0.6左右,加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度0.3mmol/L,16℃、180 r/min培养16 h。5000 r/min离心15min,收集细胞,用结合缓冲液(20mmol/L pH 7.9 Tris-HCl;150mmol/LNaCl;10mmol/L咪唑)重悬细胞,超声破碎(200W、15min)后15 000 r/min离心30min,收集上清液,0.2μm滤膜过滤后,将上清液加入到结合缓冲液平衡过的镍柱中(填充物为镍-琼脂糖凝胶)结合10min后,放掉上清,再用结合缓冲液漂洗柱子3次,之后用洗脱缓冲液(20mmol/L pH 7.9 Tris-HCl;150mmol/LNaCl;300mmol/L咪唑)洗脱,收集洗脱液,采用BCA法测定蛋白含量,每一步采集样品用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测。
1.3.4 pNPG法检测α-半乳糖苷酶活性
α-半乳糖苷酶酶活测定方法参照文献[3]进行了部分修改,在相应的反应温度预热2min后,取100μL待测酶液和100μL的pNPG溶液(10mmol/L)混合,相应温度下反应10min,加入800 μL 0.5mol/L的Na2CO3溶液终止反应,混匀后取200μL加入到96孔板中,用酶标仪测波长405 nm处吸光度值,代入预先用对硝基苯(pNP)测定的标准曲线回归方程,得出α-半乳糖苷酶的活力值。α-半乳糖苷酶酶活定义:一定条件下,每分钟水解pNPG产生1μmol的pNP所需的酶量定义为1个α-半乳糖苷酶酶活单位(U)。
1.3.5 α-半乳糖苷酶酶学性质
(1)最适pH值及pH值耐受性的确定
取不同pH的缓冲液(醋酸钠缓冲液(pH 3.5~6.0)、磷酸钠缓冲液(pH 6.5~7.50)、Tris-HCl缓冲液(pH 8.0~9.0)、甘氨酸-NaOH缓冲液(pH 9.5~10.5)),在37℃条件下依照1.3.4的方法测定不同pH条件下(终浓度25mmol/L,pH值分别为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)α-半乳糖苷酶(0.18 μg/m L)催化反应的酶活,确定其最适pH值。用不同的缓冲液(终浓度50mmol/L,pH值分别为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)在冰上预处理α-半乳糖苷酶1h后测定α-半乳糖苷酶的残余酶活,确定其耐受pH范围以最高酶活为100%计算相对酶活。
(2)最适温度及温度耐受性的确定
pH 6.5条件下测定α-半乳糖苷酶在35~60℃温度范围内的酶活,确定其最适反应温度。在0~60℃的温度范围内预处理α-半乳糖苷酶1 h后测定其残余酶活来确定其耐受温度范围以最高酶活为100%计算相对酶活。
(3)α-半乳糖苷酶反应动力学
测定α-半乳糖苷酶催化不同浓度pNPG底物浓度([S]=0.125mmol/L、0.250mmol/L、0.500mmol/L、1.250mmol/L、2.500mmol/L、5.000mmol/L)的水解速率V,以1/[S](X)为横坐标,以1/V(Y)为纵坐标制作林-贝氏方程曲线(Y=Km/Vmax·X+1/Vmax),确定α-半乳糖苷酶的酶动力学数据(包括米氏常数Km和最大催化速率Vmax)。
1.3.6 α-半乳糖苷酶对蜜二糖、棉籽糖和水苏糖的水解活性
分别配制含有蜜二糖、棉籽糖和水苏糖的反应体系,反应体系中含有4mg/m L的糖、10U/m L的重组α-半乳糖苷酶和50mmol/L的pH 6.5的磷酸钠缓冲液,40℃反应,不同时间点(0、5min、15min、30min、1 h)取样,取出样品立即煮沸失活。参照文献中的薄层层析(thin-layer chromatography,TLC)方法[3],用层析液(丙醇∶醋酸∶水=1∶1.5∶0.1,V/V)在硅胶层析板上展开样品(层析两次),喷洒显色液(甲醇∶浓硫酸=95∶5,V/V)后,将层析板置于105 ℃烘箱加热显色,根据迁移条带观察各寡糖水解情况。
1.3.7 数据处理
使用软件MEGA6基于16SrDNA序列构建系统进化树,使用Excel软件分析α-半乳糖苷酶酶活数据并制作图表。
2 结果与分析
2.1 链球菌α-半乳糖苷酶基因Sagal的获取
采用加X-α-gal的MRS肉汤培养基培养链球菌S1,菌落显示蓝色,证明链球菌S1具有α-半乳糖苷酶活性。采用软件Mega7.0构建该菌株的系统发育树,结果见图1。由图1可知,在链球菌范围内基于16SrDNA对菌株S1进行相似性比对,菌株S1与巴黎链球菌(Streptococcus lutetiensis)相似性为100%。因此,链球菌S1被鉴定为巴黎链球菌(Streptococcus lutetiensis)。

图1 菌株S1基于16S rDNA序列构建的系统进化树Fig.1 Phylogenetic tree of strain S1 based on 16S rDNA sequences
以与链球菌S1菌株亲缘关系较近的Streptococcusequinus的α-半乳糖苷酶基因(GenBank:LPVR01000005.1)为模板设计引物Sagal-F(5'-AGGGATCCATGGGA ATTCGCATC-GAAGG-3')和Sagal-R(5'-AAACTCGAGTTATTGTTTCACGAAATAG-3'),对链球菌菌株S1的基因组进行PCR扩增,获得了2 200 bp左右大小的DNA片段,如图2A所示,成功将其构建到载体pET-M-3C中。经酶切验证结果如图2B所示,经测序获得了该基因片段的DNA序列,如图3A所示,命名该基因为Sagal。将此链球菌S1基因序列与Streptococcus equinus的α-半乳糖苷酶基因(GenBank:LPVR01000005.1)进行相似性比对,显示有96%的同源性,氨基酸序列比对结果如图3B所示,鉴定此序列为一段来自链球菌S1的α-半乳糖苷酶基因(分子质量:80.4 kDa,等电点:pH 5.25)。

图2 α-半乳糖苷酶基因PCR扩增产物(A)和质粒酶切产物(B)琼脂糖凝胶电泳检测结果Fig.2 Agarose gelelectrophoresis determ ination results of PCR product ofα-galactosidase(A)and plasm id enzyme cutting products(B)

图3 Sagal基因序列(A)及其蛋白与马链球菌的α-半乳糖苷酶氨基酸序列比对图(B)Fig.3 Sagal DNA sequence(A)and am ino acid sequence comparison of its protein withα-galactosidase from Streptococcus equinus(B)
2.2 链球菌S1α-半乳糖苷酶的表达纯化
携带质粒pET-M-3C-Sagal的重组大肠杆菌BL21(DE3)经0.3mmol/L的IPTG诱导表达,经镍柱纯化的重组链球菌S1α-半乳糖苷酶的SDS-PAGE电泳结果如图4所示,可以看到Sagal在大肠杆菌中能够可溶性大量表达,重组蛋白能够结合镍柱,一步纯化后能够得到纯度较高的重组α-半乳糖苷酶,重组α-半乳糖苷酶含量>100mg/L菌液。
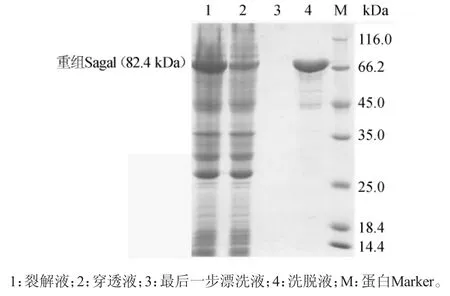
图4 α-半乳糖苷酶纯化结果Fig.4 Results of purification ofα-galactosidase
2.3 链球菌S1α-半乳糖苷酶最适pH值及pH稳定性
重组链球菌S1α-半乳糖苷酶在不同pH值条件下测定酶活,结果见图5。由图5A可知,37℃条件下,Sagal在pH 5.0~7.0范围内具有80%以上的活性,pH为8.0时酶活迅速显著降低至20%以下;在pH 6.5显示最大酶活,因此该重组酶最适pH值为6.5,是一种酸性α-半乳糖苷酶。由图5B可知,重组链球菌S1α-半乳糖苷酶在pH 7.5~10.5的条件下均比较稳定,1 h内仍能保留89%以上的活性。

图5 α-半乳糖苷酶的最适pH值(A)及pH稳定性(B)Fig.5 OptimalpH value(A)and pH stability(B)ofα-galactosidase
2.4 链球菌S1α-半乳糖苷酶最适温度及温度稳定性
重组链球菌S1α-半乳糖苷酶在35~60℃反应测定酶活,结果见图6。由图6A可知,在40~55℃的温度范围内具有80%以上的活性,并且温度为50℃时,α-半乳糖苷酶活性最高。因此,最适反应温度为50℃。由图6B可知,α-半乳糖苷酶活性在≤40℃条件下处理1h比较稳定(酶活均能保持在95%以上),在45℃处理1 h后其酶活仅保留20%以下,说明该α-半乳糖苷酶在45℃以上的高温环境中稳定性较差,适宜保存在40℃以下的环境中。
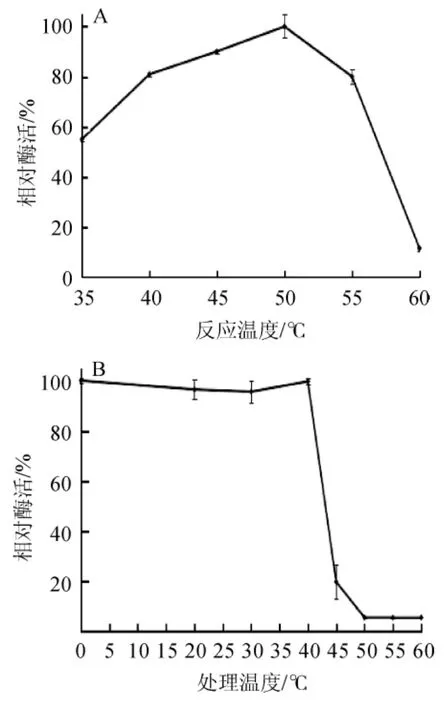
图6 α-半乳糖苷酶的最适温度(A)及温度稳定性(B)Fig.6 Optimal temperature(A)and temperature stability(B)of α-galactosidase
2.5 链球菌S1α-半乳糖苷酶对几种天然底物降解能力检测
由于链球菌S1α-半乳糖苷酶在40℃以上温度条件下不稳定,所以为了兼顾酶的稳定性与较高的活性,选取在40℃条件下分别以蜜二糖、棉籽糖和水苏糖作为α-半乳糖苷酶的底物进行反应,反应过程中不同时间点取样,样品立即在100℃加热失活,薄层层析法检测α-半乳糖苷酶对以上3种含有α-半乳糖苷键的寡糖的水解活性,结果见图7。
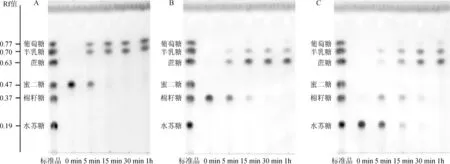
图7 薄层色谱检测α-半乳糖苷酶水解蜜二糖(A)、棉籽糖(B)和水苏糖(C)的效果Fig.7 Determ ination of hydrolysis effect ofα-galactosidase on melibiose(A),raffinose(B)and stachyose(C)by thin layer chromatography
由图7可知,随着水解时间的增加α-半乳糖酶可逐渐水解蜜二糖(图7A,水解为葡萄糖和半乳糖)、棉籽糖(图7B,水解为蔗糖和半乳糖)和水苏糖(图7C,先水解为棉籽糖和半乳糖,后棉籽糖被进一步水解为蔗糖和半乳糖),1 h内所有底物中的α-半乳糖苷键基本全部水解,说明该酶可以有效地水解这些α-半乳寡糖,具有应用于食品和饲料等工业中来避免这些α-半乳寡糖所带来的干扰的价值。
2.6 链球菌S1α-半乳糖苷酶酶学性质比较
本文研究了链球菌来源的α-半乳糖苷酶的酶活性质,其最适pH值为6.5,最适温度为50℃,且具有较高比酶活,Km也较低,kcat/Km可达567.77 L/(mmol·s)。表1列出了一些来源于真菌和细菌的α-半乳糖苷酶的酶活性质,由表1可以看出,这些α-半乳糖苷酶各有特点,链球菌S1α-半乳糖苷酶也具有一些自身的特性,在细菌来源的α-半乳糖苷酶中,其催化效率相对较高,而相对于真菌α-半乳糖苷酶,其最适温度较低,最适pH接近于中性,这些α-半乳糖苷酶相互补充可以适用于不同的需求,结合开发使用这些α-半乳糖苷酶可以更加有效地服务于生产实际需要。
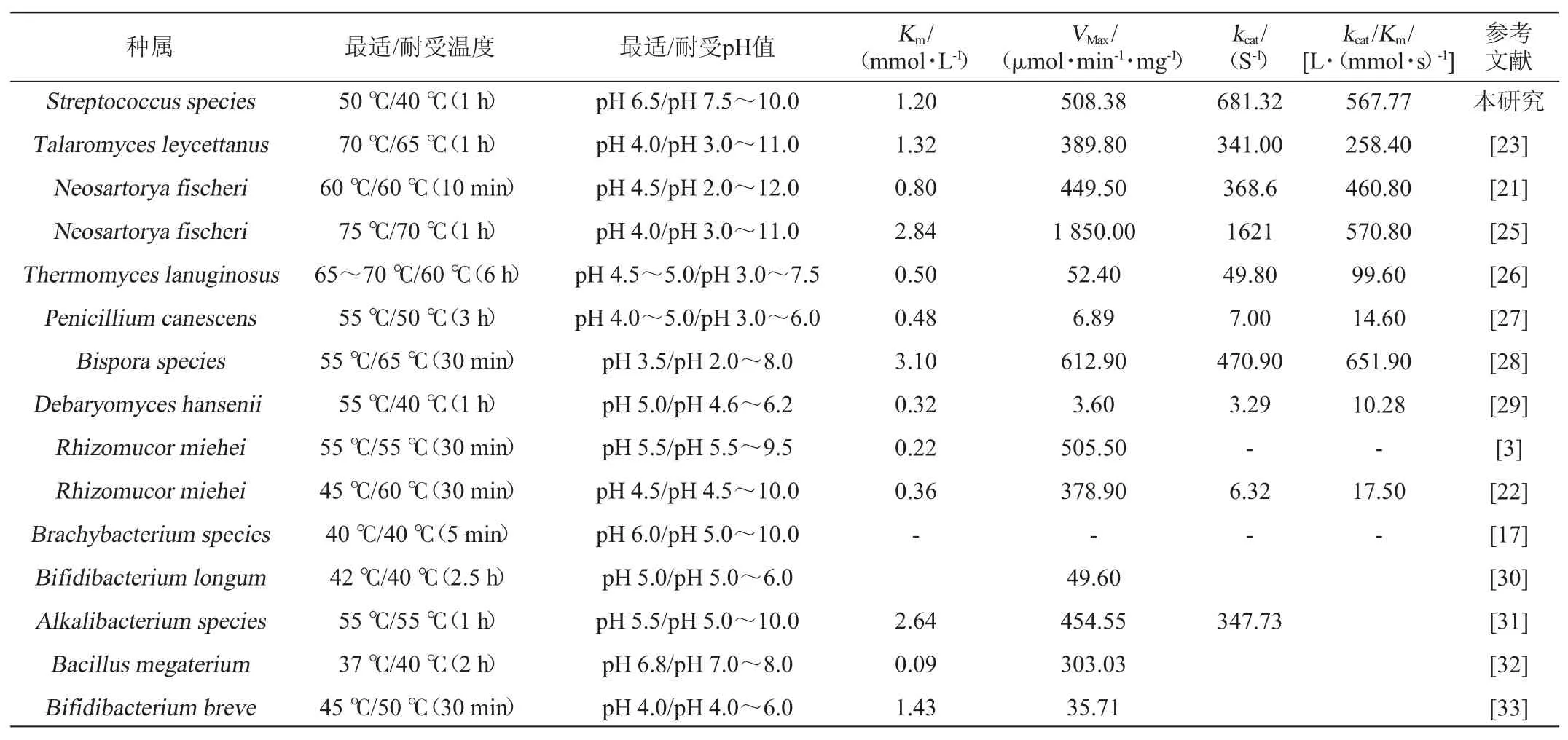
表1 Sagal与一些其他的α-半乳糖苷酶酶学性质比较Table 1 Comparison of enzymatic property of Sagalwith otherα-galactosidases
2.7 链球菌S1α-半乳糖苷酶反应动力学
重组链球菌S1α-半乳糖苷酶林-贝氏方程曲线如图8所示。由图8可知,测得米氏常数Km为1.20mmol/L,最大反应速率Vmax为508.38μmol/(min·mg),催化常数kcat为681.32S-1。
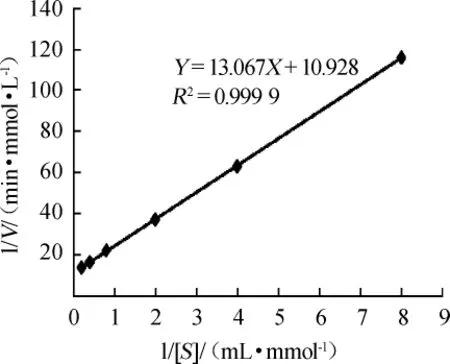
图8 α-半乳糖苷酶的林-贝氏方程曲线Fig.8 Lineweaver-Burk equation curve ofα-galactosidase
3 结论
以本实验室从牛胃溶物中分离保存的一株链球菌S1为研究对象,基于16SrDNA的遗传信息获得了该菌株α-半乳糖苷酶基因序列,并在大肠杆菌中成功异源表达。通过镍枉纯化了该α-半乳糖苷酶,每升菌液可获得100mg以上的重组α-半乳糖苷酶,其酶活显著高于原始菌株。重组α-半乳糖苷酶的最适反应pH值为6.5,最适反应温度为50℃,在碱性环境中(pH 7.5~10.5)及在40℃以下温度条件下较为稳定,该酶可以有效地水解pNPG,Km为1.20mmol/L,最大反应速率Vmax可达到508.38μmol/(min·mg),催化常数kcat为681.32 S-1,还可以有效地水解天然底物蜜二糖、棉籽糖和水苏糖中的α-半乳糖苷键,是酶学性质优良的α-半乳糖苷酶。
