抽取小鼠脑脊液简便易行的新方法*
2019-08-28陈碧玉刘翰琛黄念来陈贞磊林炤华周常文
桂 青 陈碧玉 刘翰琛 黄念来 陈贞磊 林炤华 周常文
(福建医科大学基础医学院,福州 350122)
脑脊液(cerebrospinal fluid,CSF)是充满在各脑室、蛛网膜下腔和脊髓中央管内的无色透明的液体,其性质与血浆和淋巴液相似,略带黏性。它供应脑细胞一定的营养,运走脑组织的代谢产物,调节中枢神经系统的酸碱平衡,并缓冲脑和脊髓的压力,对脑和脊髓具有保护和支持作用[1]。由于血脑屏障的存在,中枢系统疾病或损伤,常常以脑脊液为观察对象,检测脑脊液中目的物含量变化。若中枢神经系统发生病变,神经细胞代谢紊乱,将使脑脊液的性状和成分发生改变。因此,小鼠脑脊液常被用于脑损伤机制、生物标记物、药物治疗等研究领域中[2],如对脑脊液炎症因子敏感性的研究[3],对脑脊液中蛋白含量的影响研究[4],对脑脊液中去甲肾上腺素、五羟色胺的动态变化[5]及脑脊液中脑源性神经营养因子的研究[6]。课题组为了利用蛋白组学技术鉴定α分泌酶ADAM10的新底物,需利用已建立好的动物模型,抽取纯合子及野生型小鼠的脑脊液进行质谱分析[7]。文献记载中,尚未发现简单易行的小鼠脑脊液抽取方法。由于大鼠与小鼠大脑具有相似的解剖结构,通过参考抽取大鼠脑脊液的方法建立了一种抽取小鼠脑脊液的新方法[2]。
1 材料
1.1 实验动物
清洁级20~30 g健康C57BL/6小鼠,由福建医科大学动物实验中心提供,生产许可证号为:2015000519041。
1.2 实验材料
手术弯剪,弯镊,止血钳,体视显微镜,20 μL微量采血管,无菌棉球与棉签,75%酒精,4%水合氯醛(福州科诺生物技术有限公司),注射器,铁架台,烧瓶夹,手电筒或头灯,酒精灯,生理盐水,7号缝合针线,PCR管,封口膜。
2 实验方法与结果
2.1 微量吸管的制作
打开酒精灯,用手捏住微量采血管两端,将微量采血管中间部位对准酒精灯外焰,中间部位一旦融化即向两端平直外拉,这时可见两根管的头部为丝状,用剪刀稍作修剪,将其在体视显微镜下检查,内部通畅即可。两根微量吸管即制作成功。
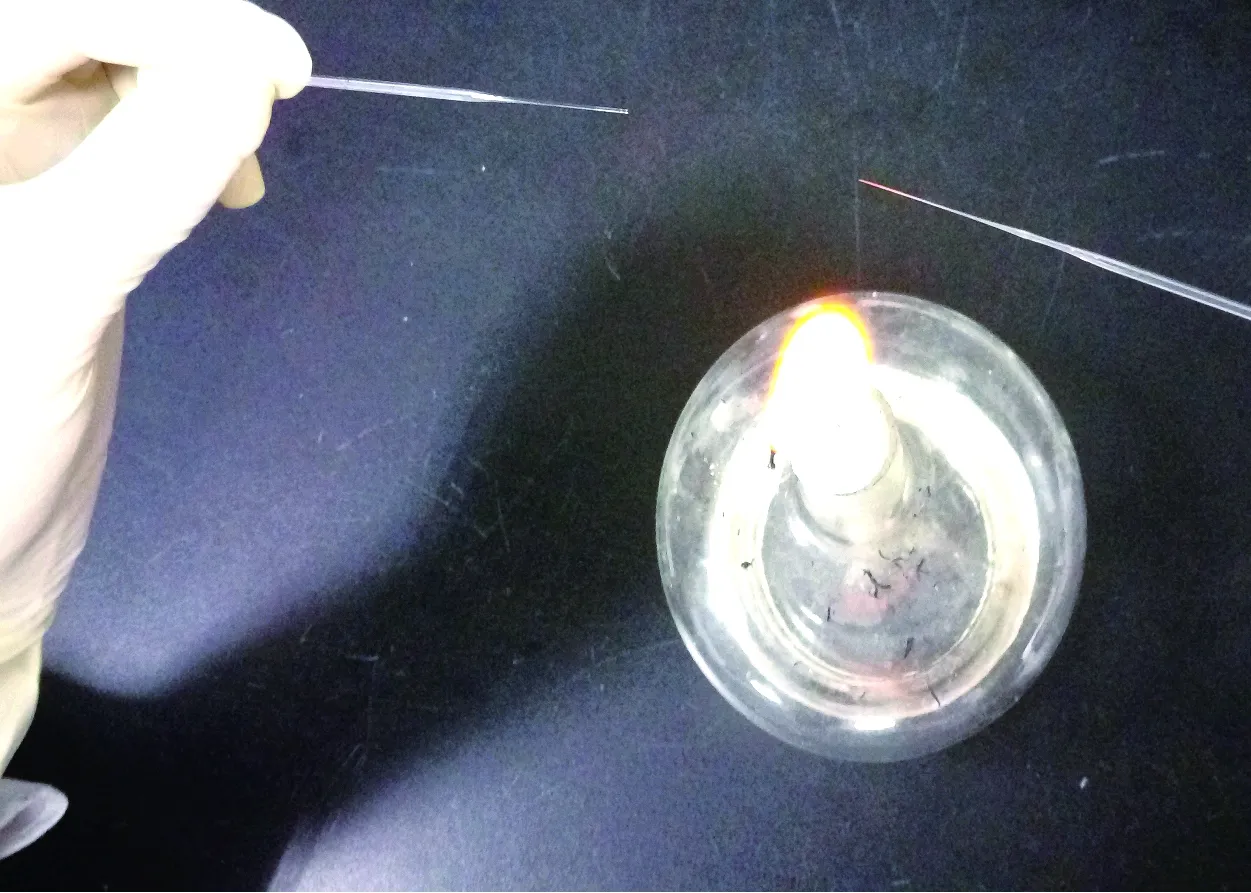
图1 微量吸管的制作Fig.1 Micropipets production
2.2 麻醉及固定
腹腔注射4%水合氯醛麻醉小鼠。利用铁架台与烧瓶夹固定小鼠前肢,调整烧瓶夹到合适的高度,可将头部垫到一定高度使小鼠头部与身体大约成120°角。可在固定小鼠前肢的烧瓶夹的上方加一个烧瓶夹固定手电筒,使整个视野更加明亮,有助于观察小鼠硬脊膜的位置(也可直接佩戴头灯)。
2.3 钝性分离
对小鼠头部皮肤进行消毒去毛处理,沿后正中线切一纵行切口(约1 cm)。用止血钳将皮肤夹住分开。用弯镊沿正中白线撕离表层肌肉,再用止血钳夹住分开。最深层附着在枕骨大孔的肌肉继续用镊子沿正中线的方向纵向分开,方法为用力夹紧镊子,将镊子头部插入中线中间部,然后放松镊子以纵向撑开肌肉,如此反复操作几次(不易触破血管),可见只剩残留的少量肌肉。最后用镊子或棉签的末端刮开附着在硬脊膜的残留肌肉(以避免出血),直到完全暴露白色硬脊膜。
2.4 抽取
暴露白色硬脊膜后,将其用无菌棉签擦净。将事先准备好的微量吸管,轻轻旋入硬脊膜,一旦见到清亮的脑脊液沿吸管缓慢上升(颅内压的作用)应立刻稳住,直到管内脑脊液的液面高度停止上升,轻轻将吸管退出。可得到不带血的2~5 μL脑脊液。
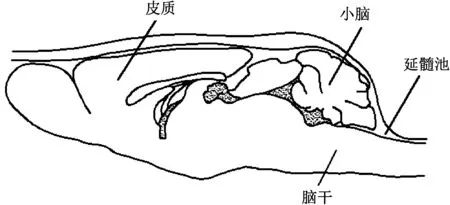
图2 从延髓池抽取脑脊液Fig.2 CSF samples are taken from the cisterna magna

图3 抽取脑脊液操作次序Fig.3 The operation sequence of CSF extraction
2.5 获取与保存
取经高压灭菌过的PCR管,将微量吸管尖部对着管口。将已充满空气的注射器对准微量吸管的另一头,一次性快速用力将注射器推到底,可将吸管内的脑脊液成功打入PCR管。封口膜密封好后,放入-80 ℃冰箱保存。
2.6 缝合及饲养
抽到脑脊液后,缝合外层皮肤,缝合完毕后向缝合缺口注入约1 mL生理盐水,放回笼中并继续饲养,密切观察。可见小鼠逐渐恢复正常,待缝合线脱落后可再次抽取。
3 讨论
本文采用的改进方法,其新颖之处在于:①目前,大多文献记载的是大鼠脑脊液抽取方法[2,8],尚未发现简单易行的小鼠脑脊液抽取方法。而小鼠脑脊液常被用于脑损伤机制、生物标记物、药物治疗等研究领域中,更为简单易行的方法亟待被发现。②建立的方法简单易行,仪器低廉,成功率高。在许多实验室,脑脊液抽取多需昂贵的仪器和特定的小鼠固定装置[9],而本方法则仅在普通的实验条件下用常见的实验材料即可达到高的成功率。例如,用铁架台及烧瓶夹代替小鼠固定装置,用酒精灯与微量采血管代替拉针仪与玻璃管。
另外,本文详细地介绍了如何抽取脑脊液不带血的同时也不易导致小鼠死亡的过程,如严格按照操作方法进行,能在短时间内十分顺利地抽取到脑脊液。如果不慎有微量血液进入,可将脑脊液在4 ℃、10 000 r/min离心2 min。取白色透明的上清液体即可[2]。③不易感染,生存率高。此方法只造成轻微脑组织损伤,不易出血,缝合后,小鼠的生存率极高。本实验对100只小鼠抽取脑脊液,麻醉死亡3只,直接伤及延髓死亡2只,缝合后感染死亡2只,存活率高达93%。
在操作过程中应注意以下事项:
1) 钝性分离,切勿触及血管是成功的关键因素之一,由于小鼠脑部血管隐藏较深且细小,肉眼无法避及,故一定要采用钝性分离;
2) 旋针速度一定要缓慢,当有脑脊液涌出,此时应稳住,手尽量不要颤抖。如果抽取失败导致硬脊膜损伤,不应继续抽取.如继续抽取,血液易进入吸管。
综上所述,本文所建立的小鼠脑脊液抽取方法简单易行、结果稳定、重复性好,是一种有效、新颖,可以达到反复抽取实验对象目的的方法,为利用小鼠脑脊液的相关研究提供了良好的实验基础。
