DHEA对小鼠超排卵和卵母细胞质量的影响*
2019-08-28董婉维周生来郑志红
何 岩 于 洋 董婉维 周生来 王 惟 杨 葳 郑志红
(中国医科大学实验动物部,沈阳 110000)
脱氢表雄酮(DHEA)及其硫酸盐(DHEAS)是一种C19类固醇激素,由肾上腺与性腺(睾丸和卵巢)分泌,是外周血睾酮和雌二醇的前体[1]。DHEA在体内大部分以硫酸盐的形式存在,并对生殖系统有重要的作用。已有研究证明,DHEA可以显著改善临床妊娠率[2],出生率,子宫内膜的厚度和恢复卵巢功能[3]。对于卵巢功能减退(diminished ovarian reserve,DOR)的患者,体外补充DHEA可以改善体外受精的效果。有研究人员比较DOR患者使用DHEA治疗前后,试管婴儿的胚胎数和分级显著升高[4]。因此,DHEA可以提高怀孕率,降低流产率[3]。此外,对于生理性或者病理性卵巢功能减弱的女性,体外补充DHEA可以恢复卵巢功能[4]。用4-乙烯基环己烯二氧化二甲苯诱导大鼠的DOR模型中,经过DHEA处理后,卵巢组织中闭锁卵泡的数量明显减少[5]。在绵羊的DOR模型中,DHEA可能通过调节AMH的表达促进卵泡的发育[6]。但是DHEA作用机制仍不清楚,基于DHEA可以减少闭锁卵泡的数量,恢复卵巢功能,那么它是否可以作为一种辅助用药提升超排卵的效果,目前尚无报道。由于使用激素进行超排卵本身对于卵母细胞的质量有不良影响[7],本研究旨在以C57BL/6J雌鼠为研究对象,探索DHEA是否能够提高C57BL/6J雌鼠的超排卵效果以及卵母细胞的质量,以进一步探讨DHEA改善超排卵的机制。
卵母细胞的质量直接影响后续的实验效率以及实验结果,过去对于卵母细胞的质量评价多通过形态学的方法,现在越来越多的研究认为,卵丘细胞可以作为一项指标来评价卵母细胞甚至是胚胎的质量。卵丘细胞是颗粒细胞包围卵母细胞形成的,累积卵母细胞周围形成卵丘复合体(COC),其在卵泡发育中起到促进卵母细胞发育和成熟的作用。卵丘复合物与卵母细胞通过特殊的连接间隙,进行双向的传递信号。若除去卵丘复合物与卵母细胞之间的连接,会导致卵母细胞质量降低,胚胎发育不良,妊娠失败[8]。因此,可以通过鉴定卵丘细胞中某些基因的表达来评价卵母细胞的质量和体外受精的结果。许多相关研究报道,卵丘细胞中Grem1、Has2、Ptgs1、Ptgs2和Vcan等基因的表达标志着卵母细胞的成熟能力[9]、胚胎质量及发育、妊娠的结果和活产率的高低[10]。本研究试图用DHEA处理C57BL/6J雌鼠,然后诱导超排卵,检测DHEA作用后超排卵效果以及卵丘细胞中标志卵母细胞质量的基因表达水平,从而鉴定卵母细胞质量,并初步探索DHEA的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物:近交系3周龄C57BL/6J雌鼠30只,雄鼠5只,所有SPF级小鼠均购自北京维通利华实验动物技术有限公司,合格证号 SCXK (京)2016-0006。所有实验小鼠均饲养于中国医科大学实验动物部SPF级动物房,饲养条件:温度控制在(22±3)℃,自动光控(12 h/12 h)。
1.1.2试剂:孕马血清促性腺激素(PMSG,C151214,宁波市激素制品有限公司),绒毛膜促性腺激素(HCG,S160113,宁波市激素制品有限公司),M16培养液、HTF培养液、KMSO培养液、矿物油和透明质酸酶(Sigma 美国),单细胞RNA提取试剂盒(sigma 美国)。
1.1.3仪器设备:体视显微镜(OLYMPUS 日本),胚胎移植管(自制),热台(OLYMPUS 日本),常规手术器械(瑞沃德 中国),电子天平(梅特勒 美国),发光仪Roche LightCycler®96(Roche 瑞士),电热恒温培养箱(Eppendorf 德国)。
1.2 方法
1.2.1超排与取卵:C57BL/6J雌鼠30只,腹腔注射PMSG 5 IU /只,间隔48 h后再次腹腔注射相同剂量的HCG,于腹腔注射HCG 15 h后取卵,动物经颈椎脱位法处死,取出壶腹膨大部显微镜下取卵。将每组的10只随机选取5只进行体外受精,另5只进行卵丘细胞的分离收集。
1.2.2体外受精:按Nakagata[11]的方法,取3月龄的C57BL/6J雄鼠2只,颈椎脱位法处死,分别取其附睾尾,沿与曲细精管垂直方向剪口,用灭菌的解剖针从附睾尾部挑取一滴浓密的精液,放入已预培养的HTF培养液中,于CO2培养箱37 ℃条件下进行培养获能1.5 h,并以血球计数板计数该精子悬浊液的浓度。将适量获能后的精子分别放入含未受精卵的培养液中,使其精子终浓度为200个/μL,然后放入CO2培养箱中受精6 h。 体外受精6 h 后在实体显微镜下观察受精情况,将有二极体和双原核的卵判定为受精卵。计算受精率,次日纪录2细胞胚胎数、未受精卵数、异常卵数和卵总数,统计受精率和异常卵比例。
1.2.3Real-time PCR:检测卵丘细胞中基因转录水平:通过1.2.1中的方法超排卵,经过透明质酸酶消化分离卵丘细胞和卵母细胞,收集卵丘细胞,按单细胞RNA提取试剂盒说明书步骤提取卵丘细胞总RNA,采用TAKARA反转录试剂盒进行反转录,应用Roche LightCycler®96进行Real-time PCR(SYBR Green荧光染料购自TAKARA公司)。表1为qRT- PCR 引物序列。目的基因和内参基因β-actin分别在同一批次的96孔板上、不同的PCR管中扩增。PCR总反应体系为20 μL,上、下游引物各1 μL,1∶100稀释后的cDNA模版1 μL,ddH2O 7 μL,SYBR 10 μL。95 ℃预变性30 s后,再进行如下40个循环:95 ℃ 5 s,60 ℃ 30 s。每一份标本进行复管检测。得到各管标本的扩增曲线和目的序列的Ct值,以及检测该管标本内参基因β-actin的Ct值,计算各管标本的待测序列的ΔΔCt值[ΔΔCt=(待测目的基因Ct值-待测组内基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值)],则该基因的mRNA相对表达为2—ΔΔCt。
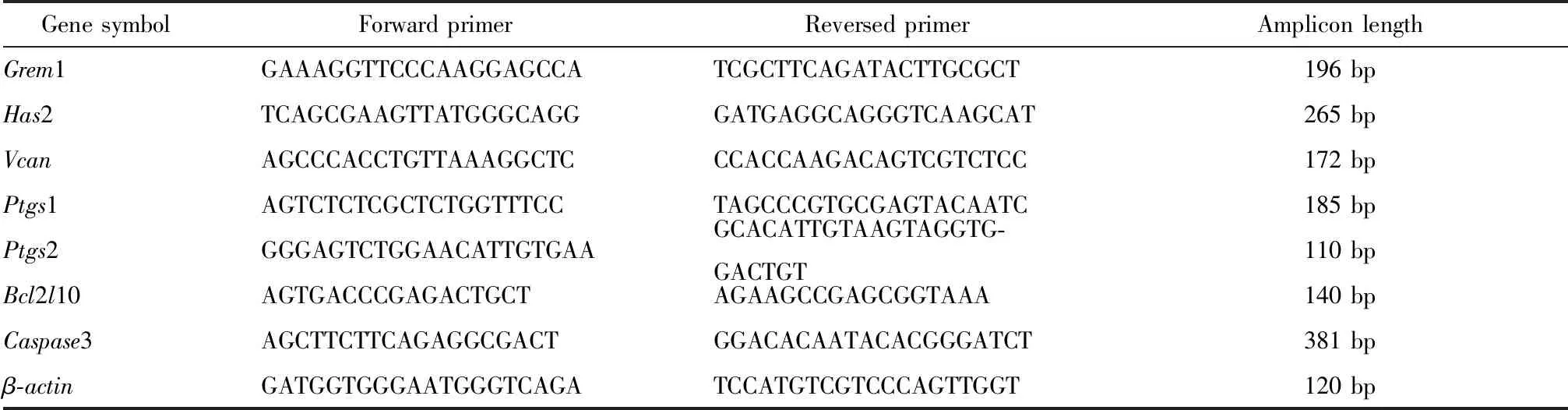
表1 qRT-PCR引物序列5′-3′Table 1 qRT-PCR primer sequence 5′-3′
1.3 统计方法
采用SPSS 19.0统计软件包进行统计分析,采用独立样本t检验和卡方χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 超排卵和受精情况
3周龄C57BL/6J雌鼠经过低剂量(2 mg/kg·d-1)和高剂量(5 mg/kg·d-1)DHEA灌胃一周,经激素超排卵后,表2统计结果显示,总卵数:低剂量处理组与高剂量处理组排卵数量与对照组比较略升高。异形卵数及比率:实验组与对照组相比明显降低,差异有统计学意义,P<0.05。受精率:实验组与对照组比较没有明显差异。说明DHEA可以显著降低经过激素超排卵后异形卵比例,但对于超排卵总数量和受精率影响不大。

表2 超排卵后卵母细胞形态以及受精率的变化Table 2 Changes of oocyte morphology and fertilization rate after superovulation
注:受精率=2-cell数/总卵数,异常卵比率=异常卵数/总卵数.*P<0.05
Note:Fertilization rate=No. of 2-cell embryos / total number of oocytes, abnormal oocytes rate=No. of abnormal oocytes / Total number of oocytes.*P<0.05
2.2 卵丘细胞中胚胎质量相关基因转录水平
图1中卵丘细胞中mRNA表达水平显示,DHEA处理组Grem1表达水平与对照组相比降低,且高剂量组比低剂量组降低的倍数更大。DHEA对于Ptgs2的mRNA水平与其对Grem1的表达水平有相似的结果,即实验组mRNA水平比对照组降低。而另外的胚胎质量相关标记物Has2、Vcan和Ptgs1的mRNA水平如图2显示,实验组与对照组比较显著上调。Has2上调最明显。以上差异均有统计学意义。
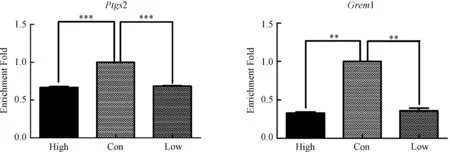
图1 卵丘细胞中胚胎质量相关基因下调基因表达情况注:横坐标中,High:高剂量处理组;Low:低剂量处理组;Con:对照组纵坐标表示基因mRNA表达水平的倍数.**P<0.01,***P<0.001Fig.1 Downregulation of genes related to embryo quality in cumulus cellsNote:In abscissa, High: high dose group; Low: low dose group; Con: control group. Longitudinal coordinates represent multiple levels of gene expression.**P<0.01,***P<0.001
2.3 卵丘细胞中凋亡相关基因转录水平
图3中卵丘细胞中凋亡相关基因Caspase3表达水平显示,DHEA处理组与对照组相比显著下调,高剂量组下调倍数比低剂量组更明显,即低剂量组下调0.8倍,高剂量组下调0.3倍。Bcl2l10的mRNA表达水平显示,实验组mRNA表达水平高于对照组。以上差异均有统计学意义。

图2 卵丘细胞中胚胎质量基因表达上调基因表达情况注:横坐标中,High:高剂量处理组;Low:低剂量处理组;Con:对照组。纵坐标表示基因mRNA表达水平的倍数。**P<0.01,***P<0.001Fig.2 Upregulation of genes related to embryo quality in cumulus cellsNote:In abscissa, High: high dose group; Low: low dose group; Con: control group. Longitudinal coordinates represent multiple levels of gene expression.**P<0.01,***P<0.001

图3 卵丘细胞中凋亡相关基因表达情况注:横坐标中,High:高剂量处理组;Low:低剂量处理组;Con:对照组。纵坐标表示基因mRNA表达水平的倍数。**P<0.01,***P<0.001Fig.3 Expression of apoptosis-related genes in cumulus cellsNote:In abscissa, High: high dose group; Low: low dose group; Con: control group. Longitudinal coordinates represent multiple levels of gene expression.**P<0.01,***P<0.001
3 讨论
Has2是透明质酸合成酶,是卵丘细胞扩张的重要因素,能够促进卵母细胞成熟和排卵[12]。Ptgs1、Ptgs2是前列腺素内过氧化物合酶1和2,二者在排卵反应中参与细胞外基质的形成与信号传导,其表达水平的高低预示着卵母细胞的质量。Vcan是多功能蛋白聚糖,是经过排卵刺激后产生的蛋白多糖,其N’端可以与蛋白质功能结构域结合,C’端与ERF受体、整合素等细胞表面蛋白相互作用。其表达在卵母细胞成熟、排卵和受精过程中起重要作用[13]。Grem1基因编码的蛋白属于分泌性蛋白,且具有高度保守性,是骨形态形成蛋白(BMP)拮抗剂家族成员,在胚胎发育的早期表达量高,并发挥重要作用[14]。有研究报道颗粒细胞中Has2、Ptgs1、Ptgs2以及Vcan的转录水平与卵丘的扩增有关,其表达水平越高卵母细胞的质量越好[15]。
本研究发现,C57BL/6J雌鼠经过DHEA灌胃一周,超排卵后,与对照组相比,排卵数量没有明显提升,但是异常卵比率明显下降。DHEA可以提高颗粒细胞中Has2、Ptgs1和Vcan基因的转录水平,优化了卵母细胞的质量。因此,DHEA可以作为一种辅助用药促进C57BL/6J青春期前雌鼠的超排卵质量。本研究中用DHEA处理后,卵丘细胞中Ptgs1的转录水平上调而Ptgs2的转录水平下调,这可能与Ptgs1与Ptgs2出现表达的时间有关,Ptgs1的表达出现在超排卵后的12 h,相当于排出第一级体后开始表达,而Ptgs2的表达出现较早,发生在超排卵后4~8 h,排卵后表达随之降低。两种同源基因表达存在时空差可能是Ptgs1与Ptgs2存在功能互补的原因[13]。Grem1也是较多研究者认为可以标志着卵母细胞和胚胎质量的基因[15],但是Myers等人报道了Grem1在原始卵泡形成前起到重要的作用,出生后Grem1的表达并不能代表胚胎质量和受精能力,本研究中DHEA使Grem1下调的机制可能是由于Grem1是BMP4信号通路的拮抗剂,应用DHEA处理时,激活BMP4信号通路,因此降低了Grem1的表达[14]。综上,DHEA可以优化青春期前卵母细胞的质量,DHEA对于成年C57BL/6J小鼠的作用效果还有待于进一步研究。
对于DHEA作用机制的研究,一方面的关注DHEA对相关激素的调节,例如DHEA可以通过增强抗缪勒管激素(AMH)、抑制素B,增加有腔卵泡的数量,改善DOR患者的卵巢功能[16]。但是也有研究者发现DHEA对于血清AMH和FSH并没有明显改变[17]。另一方面,DHEA可能通过增加对胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)的表达从而增加卵巢的反应性[18]。此外,雌鼠缺乏雄激素受体(AR)表现出较长的发情周期和较低的生育能力[19],因此有研究报道DHEA可通过诱导颗粒细胞中雄激素受体(AR)和FSH受体的表达增加,恢复卵巢的功能[20]。但是,也有文献报道,DHEA可以增加DOR患者AR的表达,但并没有增加FSH受体的表达,相反DHEA可以降低DOR患者中高表达的FSH受体水平,表明DHEA调节FSH受体的机制可能存在其他方式[21]。近年还有研究报道,对于卵巢反应性低下的女性,DHEA可以通过减少其卵丘细胞的凋亡,增加线粒体的功能,提高卵母细胞的质量和体外受精的结果[22]。在本研究用DHEA处理C57BL/6J小鼠并超排卵后,卵丘细胞中凋亡相关基因Bcl2l10与对照组相比表达上调,Caspase3表达与对照组相比表达下调,与Lin 等人的研究结果一致。本研究发现DHEA可以提高卵母细胞的质量,降低经过激素超排卵后异形卵的比例,并对DHEA影响卵丘细胞发育的机制做了初步探索,为后续DHEA的功能研究提供基础理论。
