高糖高脂饲料诱导的小型猪肥胖模型*
2019-08-28赵德明
相 磊 陈 华 赵德明
(1. 中国农业大学动物医学院,北京 100093)(2. 中国人民解放军总医院医学实验动物中心,北京 100853)
近年来,肥胖与糖尿病的发病率逐年增高,其中糖尿病已成为全球性疾病,目前仅次于心脑血管病和癌症,列为第三位大病。2017年,国际糖尿病联盟(IDF)发布了第八版全球糖尿病地图。新版地图显示,目前全球有4.25亿糖尿病患者,预计到2045年,将会有近7亿糖尿病患者。我国原是糖尿病低发区,但是近年来发病率也以惊人的速度激增。抽样调查显示,我国糖尿病患者9240万(2007-07—2008-05),每年新增患者680万,处于世界最高水平[1]。2型糖尿病人占糖尿病人总数的90%~95%左右,是糖尿病所有分型中的主要组成部分[2]。肥胖与2型糖尿病之间存在密切的关系,一方面肥胖是2型糖尿病发生的一个独立危险因子;另一方面2型糖尿病患者中约有三分之二超重或者肥胖。
由于维持费用低廉、基因组序列清楚而且便于用遗传工程手段修饰等特点,啮齿类动物模型一直是糖尿病和肥胖研究的主要工具。啮齿类肥胖模型包括自发性动物模型如C57BL/6J-ob/ob小鼠、C57BL/KsJ-db/db小鼠和Zucker-fa/fa 大鼠;诱发性肥胖大鼠模型主要通过高能量饮食诱导,一般高脂饲料诱导3个月可诱发出肥胖模型;遗传修饰改造致动物肥胖模型如Mc4RTGEM大鼠、Agouti基因突变小鼠、Tubby基因突变小鼠等。然而,由于人类和啮齿类动物之间存在明确的代谢和生理差异,特别是在新陈代谢和脂肪组织生物学方面差异显著,如脂肪酶在肥胖小鼠中含量低而在肥胖人群中含量较高;小鼠中和TNF-α作用可改善胰岛素抵抗而在人群内中和其作用则对胰岛素抵抗无影响;肥胖小鼠中抵抗素水平损害糖耐量和胰岛素敏感性而在人群中水平的高低不反应胰岛素抵抗或肥胖[3]。这些差异无疑减缓了肥胖和糖尿病的研究成果向临床的转化。随着人们对猪与人类在生理和解剖方面相似性认识的不断深入,尤其发现在代谢方面存在高度的一致性[4],现在普遍认为小型猪是基础医学研究成果向临床转化的桥梁。应用小型猪建立动物模型开展肥胖相关研究与啮齿类动物模型相比更能模拟人类疾病的发生与发展的过程。
本实验应用高脂高糖饲料饲喂动物,同时限制动物活动(单笼饲养),观察是否能够诱导小型猪肥胖,以及进一步发生糖尿病的情况,为小型猪在代谢性疾病研究领域的应用提供基础材料。
1 材料与方法
1.1 实验动物
巴马小型猪14头,8月龄,体质量25~26 kg。其中实验组8头饲喂高糖高脂饲料,对照组6头饲喂常规饲料,连续饲喂30周。
1.2 实验仪器
飞利浦64排螺旋CT(PHILIPS,荷兰),Eppendorf 5180冷冻离心机(Eppendorf,德国),东芝120型全自动生化分析仪(东芝株式会社,日本)。
1.3 实验方法
实验组8头巴马小型猪,连续饲喂高脂高糖饲料30周。高糖高脂饲料配方:蔗糖35%、牛油10%、基础饲料55%。基础饲料配方:玉米48%、小麦次粉20%、大豆饼15%、稻米糠12%、鱼粉5%。诱导饲料碳水化合物、脂肪和蛋白的能量占比分别为73.6%、11.3%和15.1%。在饲喂至第30周,做以下检测:
体质量与体形系数:应用盐酸氯胺酮与陆眠宁(体积比1∶1)按照0.3 mL/kg肌肉注射,对小型猪实施全身麻醉后称重。量取胸围、腹围以及体长。并计算身体型指数(Body Mass Index,BMI)。BMI=BW (kg)/{π/3×length×[(TC/2π)2+(AC/2π)2+(TC/2π × AC/2π)]}[5]。
CT扫描:飞利浦64位CT扫描(层厚10 mm,矩阵512х512,窗宽500HU,窗位40HU,扫面参数125 kV,50~100 mAS),比较对照与高脂高糖饲料诱导组巴马小型猪机体的脂肪含量、内脏脂肪的含量和胰腺的体积。
血清生化指标:巴马小型猪麻醉后,取后肢备皮,小型猪大腿近心端绑扎止血带,75%医用酒精消毒,外侧隐静脉穿刺采血约5 mL。血液置于促凝离心管内,应用Eppendorf 5180冷冻离心机(Eppendorf,德国), 4 ℃,1 500 r/min 10 min,取上清液。东芝120型全自动生化分析仪(东芝株式会社,日本),进行血液生化指标检测。
2 结果
2.1 体型系数
高脂高糖饲料饲喂30周后,实验组动物与对照组动物体质量差异显著(P<0.05),BMI差异显著(P<0.05)(表1),而动物的腹围、体长、胸围等指标差异不显著(P>0.05)。
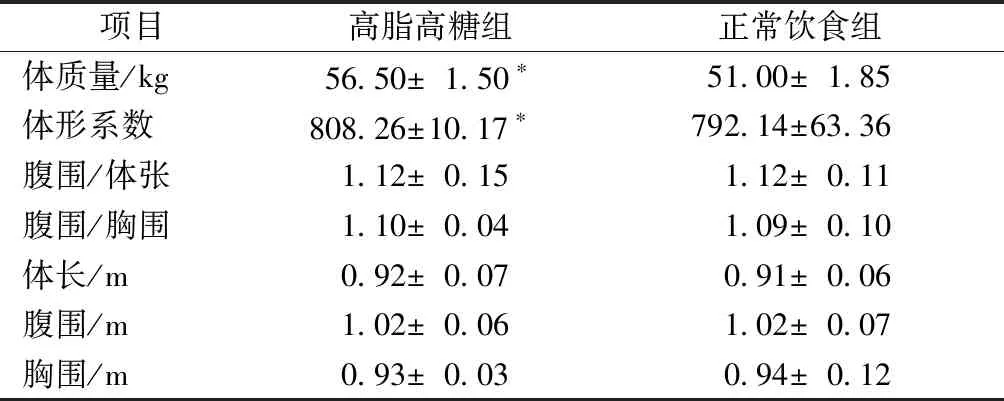
表1 高脂高糖饲料饲喂巴马小型猪30周 动物体质量与体型系数Table 1 Body weight and BMI of Bama miniature pigs fed for 30 weeks by high-fat and high-sugar diets
注:高脂高糖组与正常饮食组比较差异显著,*P<0.05
Note:There was a significant difference between the high-fat and high-sugar group and the normal diet group,*P<0.05
2.2 CT扫描
CT检查结果表明,高脂高糖饲料诱导组动物机体脂肪含量明显高于对照组(P<0.05,P=0.035);内脏脂肪占比实验组明显高于对照组(P<0.01,P=0.0028);CT扫描实验组与对照组胰腺体积差异不显著(P>0.05,P=0.57)。

图1 巴马小型猪CT扫描Fig.1 CT scan of Bama miniature pig

图2 巴马小型猪CT扫描结果分析注:A.巴马小型猪身体总脂肪含量CT扫描结果;B.巴马小型猪内脏脂肪含量CT扫描结果;C.巴马小型猪胰腺体积扫描结果Fig.2 Analysis of CT scan results of Bama miniature pigsNote:A.The results of body fat content by CT scan in Bama miniature pigs;B.The results of visceral fat content by CT scan in Bama miniature pigs;C.The results of pancreatic volume by CT scan in Bama miniature pigs
2.3 血液生化指标
高脂高糖饲料诱导30周后,实验组巴马小型猪与对照组相比血液生化指标存在显著性差异,表现为空腹血糖呈升高的趋势,胰岛素水平显著升高(P<0.01),HOMA-IR指数显著升高(P<0.01);总胆固醇、高密度脂蛋白胆固醇和甘油三脂指标显著升高(P<0.01),低密度脂蛋白胆固醇水平显著升高(P<0.05)。其中,血清总胆固醇比对照组升高了1.88倍,HDL-C升高了2.69倍,LDL-C升高了1.03倍,甘油三脂升高了3.2倍;肾功能指标中,血清蛋白、肌酸肝水平明显升高,尤其以尿酸、尿素升高最为显著(P<0.01),显示肾功能也出现损伤。
注:高脂高糖诱导组与对照组相比,*P<0.05,**P<0.01
Note:High-fat and high-sugar induction group compared with control group,*P<0.05,**P<0.01
3 讨论
人体肥胖的发生是遗传基因、饮食生活习惯、代谢紊乱及神经系统调节等因素共同作用的结果,尤其是能量供需失衡,内分泌紊乱是造成肥胖的重要因素。肥胖与2型糖尿病、血脂异常关系最为紧密。中国超重与肥胖人群中罹患糖尿病患者比例分别为12.8%与18.5%,而在糖尿病患者中超重比例为41%、肥胖比例占24.3%[6],由此可见肥胖与糖尿病之间存在紧密的联系。有研究者通过对993名不同种族人群的BMI,脂肪分布,肌肉发达程度,骨骼矿物质构成,腿长等指标进行了研究,表明机体每超重1 kg,罹患糖尿病的机率将增加4.5%~9%[7-8]。董明等通过高脂饮食诱导C57b/6 L小鼠1周出现体质量升高;4周后空腹血糖明显升高;5周后胰岛素水平明显升高;8周后体质量指数显著升高,血清总胆固醇、高密度脂蛋白胆固醇显著升高;10周后甘油三酯、血清总胆固醇、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇均升高表明该小鼠诱导成为肥胖模型[9]。本研究中巴马小型猪连续饲喂高糖高脂饲料30周,动物明显肥胖,表现为体质量、BMI比对照组显著升高(P<0.01),这与啮齿类与人类研究结果相一致,小型猪在发展为肥胖的同时,也出现了胰岛素抵抗、血脂代谢紊乱和可能的肾损伤。因此,高糖高脂饲喂这种外源性的能量过剩,能够诱发小型猪肥胖,并适用于肥胖和胰岛素抵抗、代谢综合征的研究。
胰岛素抵抗(Insulin resistance,IR)是指对胰岛素代谢效应的抵抗,其中包括胰岛素对内源性葡萄糖产生的抑制性效应、胰岛素对外周组织(主要是骨骼肌)葡萄糖摄取和糖原合成的刺激性效应以及胰岛素对脂肪分解的抑制性效应。早期的2型糖尿病患者、肥胖的胰岛素抵抗患者以及代谢综合征的儿童中观察到胰岛素的降解减少是胰岛素代谢障碍的主要早期表现。胰岛素降解减少使循环的空腹和外周胰岛素水平长期升高,进一步加剧了胰岛素抵抗。Haffner等采用微小模型法评价胰岛素敏感性,对包括非洲裔、西班牙裔及非西班牙裔美国人3 个不同种族在内共479 例2 型糖尿病人的研究结果表明,胰岛素抵抗者占92%,证实胰岛素抵抗在2 型糖尿病中普遍存在[10]。Shirai等通过高脂饲料饮食诱导出了大鼠的2型糖尿病动物模型,通过该模型研究表明肥胖与高脂饲料的饮食是引起胰岛素抵抗与胰岛细胞损伤的重要因素[11]。在高脂饲料诱导猪的肥胖模型中表明肥胖能够引起胰岛素敏感性的下降,主要表现为静脉葡萄糖耐量试验(IVGTT)、胰岛素耐性试验(ITT)以及胰岛素敏感指数(HOMA-IR)发生改变,然而值得注意的是猪的空腹胰岛素水平变化不大[12]。本研究中,小型猪连续饲喂高糖高脂饲料30周,空腹血糖呈现升高的趋势,但是还未达到失代偿的程度,而胰岛素却显著升高,HOMA-IR指数升高,表明已经出现胰岛素抵抗。
糖尿病与肥胖通常伴有机体组织的慢性炎症和脂肪组织的代谢障碍。腹内脂肪增加使胰岛素介导的葡萄糖非氧化代谢减弱,胰岛素刺激糖原合成能力减弱,同时抑制脂质氧化和游离脂肪酸的能力被制止。在此基础上机体为了维护体能糖平衡会分泌大量胰岛素,致使胰岛β细胞衰竭,胰岛素分泌缺陷,最终导致2型糖尿病的发生[13]。脂肪组织是一种内分泌器官,研究发现胰岛素抵抗与脂肪沉积的部位有很大关系,内脏脂肪含量过高易导致胰岛素抵抗,进而发展成 T2DM。研究发现,腹围与腹部总脂肪(TAV)、内脏脂肪体积(VAV)和皮下脂肪组织(SAV)均有相关性,胰岛素抵抗程度与VAV呈正相关,VAV的增高可加重胰岛素抵抗,从而产生高胰岛素血症,而SAV与胰岛素抵抗无相关性。医学研究机体脂肪含量的测定方法有CT、MRI、超声、双能X线吸收法以及人体测量法等。然而CT扫描具有准确、方便、可重复性高的特点,应用它对于腹部脂肪含量的精确判定是最为理想的方法[14]。FontiFurnols 等研究表明通过CT横断层扫描分析不同品种猪的脂肪、肌肉与骨骼等能够准确评估机体成分的组成[15]。Lara Femandez 等通过83名男性与68名女性研究不同性别、不同年龄人群机体的脂肪沉积等状况比较了人体物理测量与CT扫面分析的对应关系,对预测肥胖的判定提供了参考数据[16]。Sandeep等[17-18]研究表明脂肪分布模式是胰岛素抵抗发生的独立风险因子,而内脏脂肪与胰岛素抵抗呈现明显的正相关,减少机体腹部脂肪对有效预防胰岛素抵抗和炎症发生具有重要的意义。本研究通过CT检测分析了小型猪内脏脂肪与全身脂肪分布,结果表明,高糖高脂饲喂引起的小型猪肥胖全身脂肪增加(P<0.05),而内脏脂肪增加更显著(P<0.01),这种内脏脂肪的增高可能是引起胰岛素抵抗的重要诱因。
肥胖通常伴随着脂代谢紊乱,血脂升高,尤其HDL-C的升高为脂代谢紊乱的标志。血脂异常代表着体内脂蛋白代谢异常引起的一种状态,血脂异常所形成的脂毒性可能在胰岛素抵抗的产生和发展中发挥着重要的作用,因这种脂毒性造成的胰岛素抵抗又反过来加重了脂代谢紊乱的产生,最终形成恶性循环[19]。周博等通过高脂饲料(蔗糖10%、猪油10%及胆固醇5%)诱导C57BL/6小鼠8周构建成了小鼠肥胖模型,该模型表现为体质量、血糖以及血清胰岛素水平均升高,结果表明高脂饮食可诱发体内产生较多的ROS,引起脂类代谢紊乱,从而产生胰岛素抵抗。此外,脂肪组织释放出的游离脂肪酸(FFA)通过血液循环沉积到骨骼肌及肝细胞中,能够使蛋白激酶C(PKC)和IKK-β活性增强,从而导致IRS-1活性的降低、PI3K活性下降,GLUT-4表达减少,从而产生胰岛素抵抗[20]。本实验表明小型猪连续饲喂高糖高脂饲料,引起肥胖的同时,也存在明显的脂代谢紊乱。此外,从肾功能指标看,血清蛋白、尿酸、尿素均升高,尤其以尿素升高显著(P<0.01),推测连续30周的高糖高脂饲喂,也可引起早期的肾功能损伤。这与当前肥胖与胰岛素抵抗关系的研究成果相一致。
综上所述,本研究通过高糖高脂饲料诱导法成功建立起小型猪肥胖模型,并对小型猪肥胖与胰岛素抵抗之间的关系做了初步探讨。肥胖发生的分子机制与其进一步发展为2型糖尿病的情况还需进一步研究。
