聚球藻PCC7002营养特性分析
2019-08-28高风正冯一农杨益盛郭腾蛟冯广鑫吴浩浩曾名湧
郭 伟,高风正,冯一农,杨益盛,郭腾蛟,冯广鑫,吴浩浩,曾名湧
(中国海洋大学食品科学与工程学院,山东青岛 266003)
微藻营养丰富,蛋白质含量高,具有多种功能性成分,作为一种“超级食品”在食品中被广泛应用[1]。目前,我国的微藻类新食品原料有螺旋藻、蛋白核小球藻、雨生红球藻、盐藻及提取物、DHA藻油、裸藻和葛仙米等[2],仅占35万种微藻资源的极小部分,丰富的微藻资源尚待开发。聚球藻PCC7002(Synechococcussp.PCC7002,以下称“聚球藻”)是一种单细胞海洋蓝藻,直径在0.5~2.0 μm之间。它们分布广泛,数量巨大,在海洋初级生产力中占据重要位置[3]。聚球藻分裂速度快,对数期倍增时间小于2 h[4],环境适应能力强,兼具广盐性和广温性,可以以自养、异样和混合营养等不同方式进行生长,有希望成为生产优质蛋白和其他营养素的良好来源。
由于聚球藻具有自然转化能力,基因背景清楚,多年来被用作生物技术领域的模式生物。近年来,研究者对聚球藻中的藻蓝蛋白、多聚磷酸体、嗜铁素等活性物质进行研究[5-7],明确了不同产物的发酵、提取条件,并利用其改善肠道菌群、干预炎症性肠病,均取得了良好效果。然而,目前未见聚球藻营养成分分析的相关报道,组成成分和含量尚不明确,限制了其在食品应用领域的研究。
本文通过在实验室条件下培养聚球藻,监测其生长情况;收集藻粉,通过化学分析和仪器分析方法系统地分析了聚球藻的营养成分,以期为聚球藻食品化研究提供理论依据。
1 材料与方法
1.1 材料与仪器
食品级螺旋藻和小球藻粉 福清市新大泽螺旋藻有限公司;聚球藻 实验室培养;Medium A青岛海博生物技术有限公司;琼脂 分析纯,北京索莱宝科技有限公司;MgSO4·7H2O、KCl、NaNO3、NaCl、CaCl2、Tris-HCl、FeCl3·6H2O、EDTA·Na2、KH2PO4、Na2CO3、H3BO3、MnCl2·4H2O、ZnSO4·7H2O、Na2MoO4·2H2O、CuSO4·5H2O、Co(NO3)2·6H2O、维生素B12、石油醚(30~60 ℃)、K2SO4、浓H2SO4、甲基红指示剂、溴甲酚绿指示剂、亚甲基蓝指示剂、NaOH、95%乙醇、无水乙醇、苯酚、葡萄糖(以上试剂均为国产分析纯) 国药集团化学试剂有限公司。
GXZ-280光照培养箱 宁波江南仪器厂;G154T全自动高压灭菌锅 致微(厦门)仪器有限公司;GL-21M高速冷冻离心机 湖南湘仪离心机有限公司;UV-2550紫外可见分光光度计 日本岛津公司;索氏抽提器、凯氏定氮仪 四川蜀玻集团有限责任公司;SevenCompact pH计 梅特勒-托利多国际集团;Dionex ISC-90离子色谱仪 美国赛默飞世尔公司;Alliance 2695高效液相色谱仪 美国沃特世公司;Agilent 7890A-5975C气相色谱-四级杆质谱联用仪 美国安捷伦公司。
1.2 实验方法
1.2.1 聚球藻培养 在实验室中以Medium A为培养基,以照明日光灯做光源,光强100 μE/m2·s,温度32 ℃,通以1% CO2(V/V)的空气。固态培养时,添加1.2%琼脂。
将生长10~15 d的聚球藻从固体培养基上接种至5 L血清瓶(初始OD750=0.08~0.10),在上述条件下培养至OD750>2.0以后扩大到20 L培养袋,培养7 d后进行收获。
收获的藻液进行离心分离(7000×g,6 min),收集沉淀,用蒸馏水清洗两遍,然后通过冷冻干燥制备藻粉,研磨后置于-20 ℃密封保存做进一步分析。
1.2.2 聚球藻生长特性分析 以聚球藻培养所用Medium A为对照,利用分光光度计测定聚球藻在750 nm处的吸光值来监测其生长状况,每24 h测定一次,比生长速率根据公式μ=ln(X1-X0)/(t1-t0)计算[8]。其中,X1和X0分别为藻液在t1和t0时的OD750。
1.2.3 成分分析 聚球藻主要成分分析参照GB 5009(2016),稍作改动。以相同方法同时测定螺旋藻和小球藻藻粉。
1.2.3.1 水分 水分测定采用直接干燥法。称取1.000 g藻粉置于105 ℃干燥箱中烘至恒重(两次质量差不超过2 mg)。
1.2.3.2 灰分与矿物质 总灰分测定采用灼烧法。称取藻粉3.000 g,先在电热板上以小火加热使试样充分炭化至无烟,然后置于高温炉中,在550 ℃灼烧4 h。
钾、钙、钠、镁、磷、铜、铁、锌、硒等矿物质元素采用原子吸收法分析,在中国科学院海洋研究所分析测试中心完成。
1.2.3.3 蛋白质及氨基酸 总氮含量测定采用凯氏定氮法。称取藻粉0.500 g,加入硫酸溶液消化,碱化蒸馏使氨游离,最后通过盐酸标准溶液滴定并计算氮含量。粗蛋白含量(g/100 g)=总氮量×6.25。
水解氨基酸和游离氨基酸组成采用离子色谱法分析,在中国科学院海洋研究所分析测试中心完成。色谱条件:色谱柱:磺胺型阳离子树脂;检测波长:440和570 nm。
根据FAO/WHO建议的氨基酸评分标准模式和鸡蛋蛋白的氨基酸模式,计算三种微藻的氨基酸评分、化学评分和必需氨基酸指数(EAAI)[9]。
1.2.3.4 脂质 采用索氏抽提法测定脂质含量。称取藻粉2.000 g,经4 mol/L HCl水解后用石油醚经索氏抽提器提取。
聚球藻脂肪酸组成利用气相色谱-质谱联用仪分析,在中国科学院能源过程与工程研究所分析测试中心完成。色谱条件:色谱柱:DB-5 ms;载气:MSD氦气,FID氢气;柱温:120 ℃保持1 min,20 ℃/min程序升温至325 ℃。质谱条件:EI离子源;温度:300 ℃(离子源),150 ℃(四极杆);扫描范围:30~550 m/z。
1.2.3.5 色素与色素蛋白 叶绿素和类胡萝卜素:取0.010 g藻粉,加入5 mL甲醇,在4 ℃条件下提取1 h。以10000×g、15 min离心分离上清。重复提取直至上清不再呈现绿色(此时沉淀应为蓝紫色)。以甲醇为空白测定470、665和720 nm处的吸光度,按照下式计算[10]:
Chl a(mg/L)=12.945(A665-A720)
Car(mg/L)=[1000(A665-A720)-2.86Chl a]/221
藻胆蛋白:取0.010 g藻粉,加入5 mL Na3PO4缓冲液(pH=7.0,含0.15 mol/L NaCl),用玻珠研磨机破碎细胞后提取1 h。以10000×g、15 min离心分离上清。重复提取直至上清无色。以缓冲液为空白测定562、615和652 nm处的吸光度,按照下式计算[11]:
藻蓝蛋白(mg/L)=(A615-0.474A652)/5.34
别藻蓝蛋白(mg/L)=A652-0.208A615)/5.09
藻红蛋白(mg/L)=(A562-2.41PC-0.849APC)/9.62
1.2.3.6 维生素 聚球藻维生素A、维生素E、维生素K1、维生素B1、维生素B2、维生素B3、维生素B6以高效液相色谱法进行分析,在中国科学院海洋研究所分析测试中心完成。色谱条件参考国标GB 5009(2016)中维生素的测定。
1.3 数据处理
在本实验室内完成的测定工作均重复三次,结果表示为平均值±标准偏差(SD);送检结果以单次测定值表示。除另作说明,均以占藻粉干重的百分比表示。
2 结果与分析
2.1 生长特性
聚球藻在5 L血清瓶中的动态生长曲线如图1所示。藻种从接种到血清瓶中进入延滞期,细胞通过增加酶和代谢产物水平来调节代谢过程,准备细胞分裂和光合作用[12]。当接种量增加,藻细胞生长环境适宜时,可以缩短这一过程[13]。从第4 d开始,藻细胞进入指数增长期,直到11 d,最大比生长速率达到1.023/d。之后细胞进入稳定期,OD750基本不再增加。13 d以后收获,聚球藻藻粉收获量(干重)为1.34 g/L。

图1 聚球藻生长曲线
由于聚球藻对高光和高温耐受性强[14],在实验室条件下可以通过增加温度和光照提高生长速率,通过控制接种量和培养环境,最终将收获周期控制在7 d。
2.2 营养成分组成
2.2.1 基本成分分析 表1列出了聚球藻和螺旋藻、小球藻的营养成分。通过冷冻干燥获得的藻粉含水量在4%,而现有相关藻粉标准[15]规定为含水量≤7%,因此聚球藻分含水量符合要求,能够保持良好的质量。

表1 三种微藻基本成分组成(g/100 g DW)Table 1 Composition of general nutrients in three kinds of microalgae(mg/100 g DW)
如表1所示,三种微藻蛋白质含量在59.36%~67.25%之间,而脂质和总糖含量相对较低,分别为8.21%~14.82%和9.30%~14.20%。微藻的高蛋白含量是将其作为非传统蛋白来源进行研究的主要原因[1],而总糖(淀粉、纤维素、多糖等)主要影响微藻产品的价值和消化性。微藻中的脂质含量受藻种和环境的影响变化较大(1%~40%);绿藻在特定条件下积累脂质[16],因此具有更高的脂质含量。Becker曾将一般食物与藻类基本构成进行对比[17],微藻整体呈现高蛋白、低脂、低碳水化合物的特点,聚球藻的基本成分组成表明其可以作为蛋白质的来源。
与螺旋藻和小球藻相比,聚球藻灰分含量最高,达到13.23%。微藻灰分与培养条件和成熟度有关,非限制条件下,微藻灰分占干重的4%~20%[18]。Ben-Amotz等[19]认为,微藻灰分含量与培养基盐度呈正相关。聚球藻为海水藻,生长于高盐环境,体内积累矿物质离子以维持渗透压平衡,而且矿物质组成中,Ca和Na的含量最高,这与培养基组成是一致的。其他含量较高的元素包括K、Mg、P等(见表2),除此以外还检测到微量的Se。由于微藻生长所需要的物质均来源于培养基,而Medium A中未添加含Se的成分,因此Se很可能来源于培养基用水或由外源带入。与螺旋藻和小球藻相比,聚球藻呈现出低Fe、高Zn的特点,Medium A中添加的微量元素可能是较高Zn含量的来源,而Fe含量低可能是对大洋低铁环境的生态适应造成的[20]。从营养学角度来看,矿物质是机体所需的无机元素,以较少的量来满足多种不同的功能,它们涉及骨骼和牙齿的形成、肌肉收缩、蛋白质的合成和能量的产生[21]。聚球藻中所含的多种丰富矿物质可以很好地满足机体需求。

表2 三种微藻矿物质含量(mg/100 g DW)Table 2 Content of minerals in three kinds of microalgae(mg/100 g DW)
2.2.2 蛋白质与氨基酸组成分析 蛋白质是生物体内的重要成分,水解后转化成不同的氨基酸,用于细胞生长和修复,维持机体健康,并在一定条件下提供部分能量[21]。蛋白质的含量多少和质量高低是决定新食品原料营养价值的重要参考因素。聚球藻的粗蛋白含量高于小球藻,与螺旋藻类似,这一差别与微藻种类和培养条件有关,而且普遍用于食品中的N-Protein转换因子6.25来源于蛋白质中含有16% N的假设,而忽略了非蛋白质氮的含量,比如结构蛋白、生物活性肽、游离氨基酸、核酸和微藻中发现的氨[21]。因此,为了更准确地评估聚球藻的蛋白质价值,本文测定了水解氨基酸和游离氨基酸的含量(图2)。结果显示,三者水解氨基酸和游离氨基酸含量分别为:聚球藻52.04%、1.60%;螺旋藻64.87%、0.84%;小球藻51.21%、0.82%。对比之后可以发现,聚球藻中粗蛋白含量与螺旋藻相似,而氨基酸含量却低了12.83%,说明聚球藻中含有较多的非蛋白质氮,游离氨基酸含量测定结果也证明了这一点(表2)。
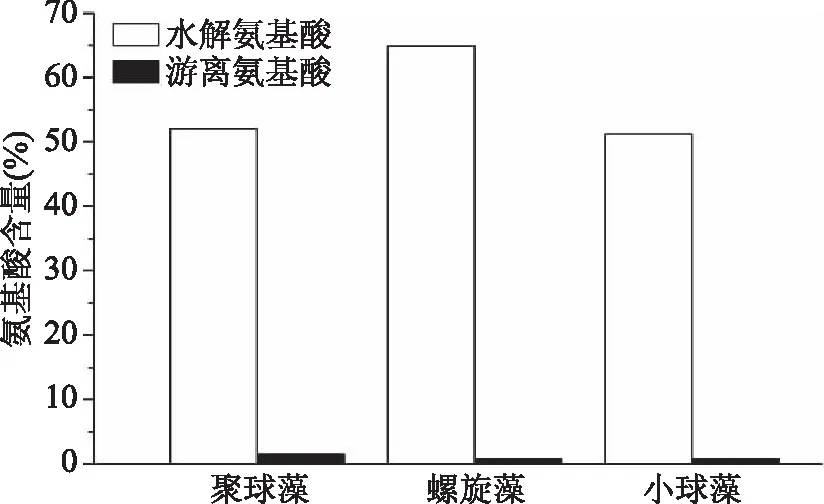
图2 三种微藻水解氨基酸和游离氨基酸含量
聚球藻蛋白质含有全部的必需氨基酸(EAA)(表3),通过氨基酸评分和化学评分可知,聚球藻的第一限制氨基酸为甲硫氨酸+半胱氨酸,第二限制氨基酸为赖氨酸(氨基酸评分)和异亮氨酸(化学评分)。三种微藻第一限制氨基酸相同,但聚球藻中甲硫氨酸+半胱氨酸的含量更高,同样蛋白质含量的情况下,其营养价值更高。

表3 三种微藻必需氨基酸组成评价Table 3 Composition of essential amino acids in three kinds of microalgae
2.2.3 脂肪酸组成分析 聚球藻总脂含量较低(8.21%),与螺旋藻接近而低于小球藻。一般来说,绿藻积累脂质的能力比蓝藻强,且小球藻和螺旋藻的总脂含量接近于Tibbetts S M[22]报道。在某些条件下(如N限制),微藻脂质积累能力得到加强。由于氮的缺乏,细胞分裂受到抑制,而细胞同化的碳以脂质的形式在胞内累积[1]。生产中常利用细胞的这一特性来获得目标脂质,如雨生红球藻在N限制条件下总脂含量高达40%[23],目标产物虾青素也随之增加。
本文进一步分析了聚球藻脂肪酸的组成,一共鉴定出8种脂肪酸,其中包括3种饱和脂肪酸,3种单不饱和脂肪酸和2种多不饱和脂肪酸,不同脂肪酸所占比例差异较大,C16∶0和C18∶1含量最高(分别为59.04%和24.90%),两者贡献了80%以上的总脂肪酸,而其他6种占比不到20%(表4)。Sakamoto等[24]分析不同培养条件下聚球藻的脂肪酸组成,C16∶0和C18∶1含量分别可达57%和23%,34 ℃培养条件下未检测到含2个以上不饱和键的脂肪酸,与本文结果一致。本研究中聚球藻饱和脂肪酸比例为60.94%,主要为C16∶0。有研究者认为,在生长周期延长的情况下,由于营养盐限制,细胞将积累更多的饱和脂肪酸(如C18∶0)[25]。对不同温度下聚球藻脂质组成的研究表明,不饱和脂肪酸的增加是细胞适应低温环境的一种机制,它可以提高聚球藻对低温的耐受性[24]。因此,微藻脂肪酸的组成具有较高的可塑性,可以通过控制条件实现预期结果。
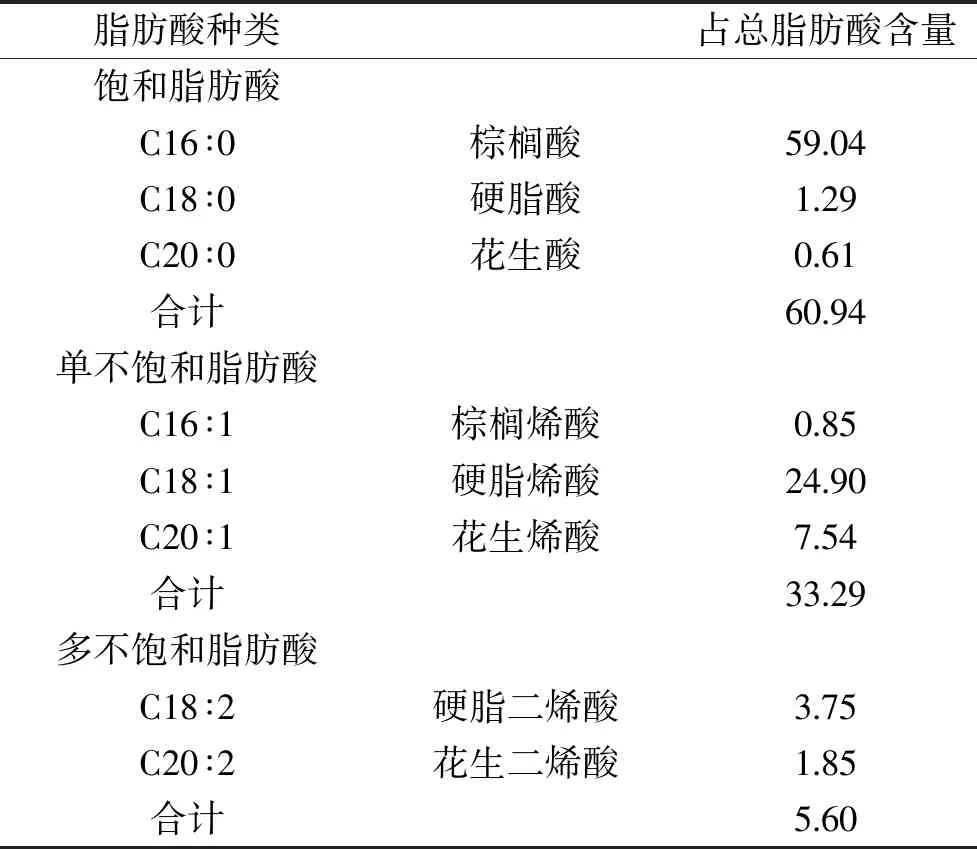
表4 聚球藻脂肪酸组成(以占总脂肪酸百分比表示)Table 4 Composition of fatty acids in Synechococcus(%)
多不饱和脂肪酸中,含量较高的C18∶2为3.75%。C18∶2无法直接通过人体代谢途径合成,必须从外界摄入,因此对营养健康尤为重要;而同样重要的C18∶3此次分析中未检出。分析不同温度和光照条件下聚球藻的脂质组成[24],结果显示在低温(22 ℃)高光照(250 μE/m2·s)条件下C18∶3含量达到19%,而高温(34 ℃)低光照(50 μE/m2·s)条件下C18∶3未检出。C18∶2和C18∶3作为EPA和DHA的前体,可为其合成提供原料。此外,有研究者利用转基因技术通过聚球藻生产γ-亚麻酸和硬脂四烯酸,得到总脂含量11.64%的硬脂四烯酸[26]。现有研究展示了聚球藻食品应用的良好前景;然而,目前聚球藻的大规模培养未得到实践,现有的收集方法耗能较高,尚不能作为食品原料使用,限制了其进一步研究和利用。
2.2.4 色素与色素蛋白 聚球藻是蓝藻中的一员,其主要特征色素为藻胆蛋白[27](包括藻蓝蛋白、藻红蛋白和别藻蓝蛋白),叶绿素和类胡萝卜素相对含量较少。因此,表5比较了聚球藻和同为蓝藻的螺旋藻的主要色素组成。

表5 聚球藻和螺旋藻中主要色素含量(g/100 g DW)Table 5 Composition of main pigments in Synechococcus and Spirulina(g/100 g DW)
与螺旋藻相比,聚球藻的藻蓝蛋白、类胡萝卜素含量较高,别藻蓝蛋白、藻红蛋白和叶绿素含量较低,色素含量总体差别不大(表5)。微藻中的色素是分类的重要特征也是其食品应用的重要领域,目前藻蓝蛋白也是螺旋藻应用中的主要成分[28]。聚球藻的色素组成表明了其在食品中应用的物质基础。同时通过聚球藻快速倍增的特点可以提高藻蓝蛋白的生产效率,降低工业生产成本。叶绿素a是直接参与光合作用的色素,在光照强度高的情况下含量减少,而次生类胡萝卜素增加,能够保护藻体免受强光伤害[1]。聚球藻耐高光照,在200 μE/m2·s的光照条件下仍可以生长。实验室培养条件(光照强度100 μE/m2·s)下,其类胡萝卜素含量高于螺旋藻。
2.2.5 维生素 维生素是人体为维持正常生理功能而必须从食物中获得的一类微量有机物质,在人体生长、代谢、发育过程中发挥着重要作用[21]。微藻被认为含有几乎所有的必需维生素,并且可以在光合作用过程中产生维生素E,而其他非光合微生物则不能[29]。本文检测了聚球藻中的多种维生素(表6),除维生素A外均有检出。与螺旋藻和小球藻相比[1],较高的维生素E提升了聚球藻的营养价值。由上文可知,聚球藻中含有一定量的类胡萝卜素,而维生素A未检出,这可能是由于聚球藻中β-胡萝卜素(维生素A原)含量较低。培养条件对维生素的积累有一定影响,降低光照可以使微绿球藻中维生素E含量增加,然而,低光照可能会影响藻体生长[29]。此外,藻粉干燥方法的选择也会对维生素含量产生影响,特别是一些热敏性维生素[1]。

表6 三种微藻中主要维生素含量(mg/100 g DW)Table 6 Main composition of vitamins in three kinds of microalgae(mg/100 g DW)
3 结论
本文分析了聚球藻PCC7002的营养成分,并将部分结果与螺旋藻和小球藻进行对比。结果显示,聚球藻具有高蛋白(65.79%)、低碳水化合物(9.30%)、低脂肪(8.21%)、灰分含量高(13.23%)的特点,甲硫氨酸+半胱氨酸为第一限制氨基酸,多不饱和脂肪酸含量低(5.6%),而藻蓝蛋白含量较高(15.81%),并含有多种矿物质和维生素,其营养价值与螺旋藻和小球藻相当。此外,聚球藻生长速率快,生产效率高,其微小的个体为功能成分的提取提供了方便。虽然目前针对聚球藻的食品应用研究刚刚起步,研究过程中有很多问题尚待解决,但是本文中营养成分分析的研究结果显示聚球藻具有良好的开发应用价值,有潜力作为食品和食品添加剂使用。
