调强放疗联合内分泌治疗前列腺癌的疗效及对患者免疫功能的影响
2019-08-28李文亮史沁兵韩文华李春明
李文亮 史沁兵 韩文华 李春明
前列腺癌是男性泌尿生殖系统恶性癌之一,在中老年群体中高发,随着人群饮食结构的改变和人口老龄化的发展,我国前列腺癌的发病率呈逐年升高趋势,严重影响患者的生命安全和生活质量[1-3]。前列腺癌发病初期症状并不明显,患者检出时常因病理分期较晚、年龄偏大以及合并症多难以接受外科手术治疗[4]。随着放疗技术的发展,调强放疗等适形性及精确性均较高的放疗手段临床应用逐渐增多。此外由于前列腺癌具有雄性激素依赖性,内分泌治疗也是前列腺癌治疗较好的选择。目前内分泌治疗及调强放疗治疗前列腺癌的相关临床研究较多[5-6],但两者联合对前列腺癌患者免疫功能及生活质量的研究仍较少。本研究对我院收治的80例前列腺癌患者进行对照研究,旨在探究调强放疗联合内分泌治疗对前列腺癌患者的疗效及免疫功能的影响,报告如下。
1 资料与方法
1.1 一般资料
入组患者共80例,均为2013年9月至2018年12月我院泌尿外科收治的前列腺癌患者,随机为观察组(40例)及对照组(40例)。观察组年龄:35~77岁,平均年龄为(56.65±7.34)岁;病程:1~17月,平均病程(6.52±2.04)月;TNM病理分期[7]:Ⅱ期20例,Ⅲ期16例,Ⅳ期4例;已婚32例,未婚8例。对照组年龄:36~75岁,平均年龄为(57.35±7.89)岁;病程:2~20月,平均病程(6.98±2.14)月;TNM病理分期:Ⅱ期21例,Ⅲ期15例,Ⅳ期4例;已婚34例,未婚6例。2组患者的年龄、病程、病理分期等一般资料进行均衡性比较,具有可比性(P>0.05)。本研究获得我院医学伦理委员会审核批准,并在其全程监督下进行。
1.2 纳入及排除标准
纳入标准:①具有尿频尿急、排尿困难、血尿等前列腺癌的临床表现,并经病理学活检确诊[8];②卡氏功能状态评分高于70分且无放疗禁忌证,能够接受全程治疗者[9];③临床资料完整,对研究知情同意并签署相关文件;④入组前1月未接受内分泌及免疫相关治疗。排除标准:①合并急慢性感染或免疫功能障碍者(如AIDS);②合并心、肝、肾等重要脏器功能衰竭及其他恶性癌者;③符合外科根治性手术指征的患者;④精神状态异常,无法完成问卷调查者。
1.3 方法
1.3.1 调强放疗 对照组患者进行调强放疗。在模拟CT机(层厚设定为5 mm)下进行定位,一般由L2至坐骨下缘10 cm。勾画临床靶区(CTV)包括前列腺、双侧精囊以及可能受到侵犯的盆腔淋巴结引流区等亚临床灶。计划靶区(PTV)在CTV的基础上进行勾画,上下左右均外放0.5 cm,考虑直肠位于前列腺的后方,因此前后仅扩大0.3 cm。同时勾画出照射易危及的相邻器官如膀胱、阴茎球部、直肠以及股骨头等。使用整体挡铅进行适形并进行不均匀组织校正,采用医科达医用电子直线加速器(ELEKTA presise2508)进行治疗。CTV接受照射剂量为2.23 Gy/次,5次/周,总剂量为78 Gy;PTV接受照射剂量为2.17 Gy/次,5次/周,总剂量为76 Gy;要求直肠以及膀胱V70<25%,股骨头V50<5%,耻骨V70<25%。
1.3.2 内分泌治疗 观察组在对照组调强放疗基础上联用内分泌治疗。在放疗前半年开始口服比卡鲁胺片(上海复旦复华药业有限公司;批准文号:国药准字H20113535),1次/天;皮下注射醋酸亮丙瑞林(北京博恩特药业有限公司;批准文号:国药准字H20093809),1次/28 d。待PSA<0.2 ng/ml且维持2个月后停药,若出现生化复发即PSA>0.2 ng/ml,则再次如上用药。
1.4 观察指标
治疗前及治疗结束后2个月,采集2组患者空腹静脉血6 ml进行各项指标检测。
1.4.1 免疫功能 通过Cytomics FC 500流式细胞仪(美国贝克曼)对血液标本中 CD8+、CD4+、CD3+及NK细胞含量进行分析。
1.4.2 生存质量 治疗前及治疗结束后2个月,通过前列腺癌症状评分表(EPCI)对2组患者生存质量进行评价,量表包括对患者泌尿功能(尿失禁、排尿困难)、肠道功能、性功能、激素功能领域的症状积分、功能积分的评价。各领域总积分满分为100分,得分越高说明患者生存质量越高[10]。
1.4.3 前列腺特异性抗原(PSA)、游离前列腺抗原(fPSA) 对血液标本进行离心处理后取上清液,通过酶联免疫吸附测定血清PSA、fPSA浓度,检测试剂盒由泉州市睿信生物科技有限公司提供。
1.5 统计方法
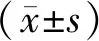
2 结果
2.1 2组患者免疫功能比较
治疗前,2组患者的CD3+、CD4+、CD8+及NK细胞水平无统计学差异(P>0.05);治疗后,2组患者的CD3+、CD4+及CD8+水平均较治疗前升高、NK细胞水平较治疗前降低,差异具有统计学意义(P<0.05);观察组患者的CD3+、CD4+水平均高于对照组(P<0.05),CD8+水平低于对照组(P<0.05);2组间NK细胞水平则无统计学差异(P>0.05)。见表1。
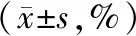
表1 2组患者免疫功能比较
注:①为治疗后与治疗前比较,P<0.05。
2.2 EPIC量表评分
治疗前,2组泌尿功能领域、肠道功能领域、性功能领域、激素功能领域的总积分、功能积分、症状积分均无统计学差异(P>0.05);治疗后,2组患者的各领域积分均降低(P<0.05),但观察组各领域积分显著高于对照组,差异有统计学意义(P<0.05)。见表2。
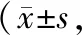
表2 2组患者EPIC量表评分比较分)
注:①为治疗后与治疗前比较,P<0.05。
2.3 2组患者治疗前后PSA、fPSA浓度比较
治疗前,2组患者的PSA、fPSA均无统计学差异(P>0.05);治疗后,2组患者的PSA、fPSA水平均降低,且观察组患者的PSA、fPSA水平均低于对照组,差异具有统计学意义(P<0.05)。见表3。
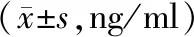
表3 治疗前后2组患者PSA、fPSA浓度比较
注:①为治疗后与治疗前比较,P<0.05。
3 讨论
外放射治疗前列腺癌具有疗效显著、适应证广及并发症发生率低等优势,调强放疗的高适形性可进一步增加癌靶区照射剂量,并减少对周围组织的辐射损伤,临床效果较常规放疗更佳[11-12]。前列腺癌细胞的生长繁殖依赖于机体的雄激素,因此内分泌治疗在前列腺癌的治疗中亦具有重要地位,可通过抑制下丘脑-垂体-睾丸轴,降低机体雄激素作用,进而抑制癌的发展[13]。廖海球等研究显示放射治疗联合内分泌治疗,相较单一放疗,可有效降低患者生化复发率,提高患者无病生存期及总生存期[14]。本研究进一步对采用内分泌治疗辅助调强放疗治疗前列腺癌患者的免疫功能、生活质量及临床症状进行评价,亦取得良好的治疗效果。
机体抗癌免疫以细胞免疫对癌细胞的直接杀伤为主,T 淋巴细胞主要介导机体细胞免疫,癌组织可分泌具有免疫抑制作用的因子,以抑制机体免疫,因此癌症患者T 淋巴细胞亚群水平以及构成不仅反映机体免疫功能,也间接反映癌的发生与进展[15-16]。本研究结果显示,治疗后2组患者的CD3+、CD4+及CD8+水平均较治疗前升高,且观察组患者的CD3+、CD4+水平均高于对照组,CD8+水平低于对照组,差异具有统计学意义。调强放射首先确定射线在靶区及周围组织上的剂量分布,再根据具体解剖关系,在同一个射野内产生优化的、不均匀的射线强度分布[17]。2组患者T淋巴细胞水平较治疗前均提升,说明通过调强放射更为有效、低副作用地灭活癌组织,降低了癌组织对周围组织的刺激,进而减少了癌组织释放的可引起机体免疫反应的抗原物质的含量,避免T细胞在抗癌免疫反应中产生耗竭。卡鲁胺片能够与双氢睾酮竞争结合癌细胞表面雄激素受体,通过降低双氢睾酮与雄激素受体结合,抑制双氢睾酮进入前列腺癌细胞后所发挥的促进生长及基因表达作用。亮丙瑞林为促性腺素释放素类似物,可对垂体-性腺功能进行抑制,直接减少双氢睾酮等雄激素分泌,抑制癌组织生长[18]。观察组放疗前即进行内分泌治疗(卡鲁胺片、亮丙瑞林),一方面可直接促进癌细胞凋亡,并使癌组织缩小,降低放射治疗的负荷;另一方面可减少放射治疗引起癌细胞再增殖加快现象,进一步解除了机体免疫抑制。而观察组CD8+水平低于对照组,推测可能与CD8+具有免疫抑制及细胞毒性双重作用有关。NK细胞能够通过放穿孔素、分泌细胞因子等途径杀伤癌细胞,骆华春等对局部晚期前列腺癌患者及健康人群进行研究,发现健康人群NK细胞水平显著低于前列腺癌患者[19]。本研究显示,治疗后2组患者NK细胞水平较治疗前均降低,与治疗后癌组织灭活及增殖受限一致,但2组间NK细胞水平则无统计学差异,故放疗联合内分泌治疗对NK细胞所参与的抗癌免疫这一前列腺癌进展的相关保护性作用位点的作用仍待进一步研究予以证明。
PSA为前列腺腺泡分泌的糖蛋白,一般存在于前列腺导管系统中,前列腺癌变后前列腺导管系统的血-上皮屏障被破坏,可导致其血清含量上升,fPSA为其血清游离形式[20]。治疗后2组患者的PSA、fPSA水平均降低,且观察组患者的PSA、fPSA水平均低于对照组,差异具有统计学意义。调强放疗及内分泌治疗均可直接杀灭癌细胞,两者协同还可发挥相互促进作用,进一步促进癌细胞凋亡,从而抑制癌组织的增殖与侵袭,降低前列腺癌血清标志物的含量。本研究进一步对2组患者生存质量进行比较,发现治疗后2组患者的EPCI量表各领域积分均降低,但观察组患者的EPCI量表各领域积分显著高于对照组,差异具有统计学意义,与既往研究结果一致[21]。说明治疗后患者病情得到一定控制,但随着疾病持续消耗及抗癌治疗产生的副作用,患者生存质量不可避免地下降了,但调强放疗联用内分泌治疗临床效果更佳,因此患者生存质量较高。
综上,在调强放疗的基础上联用内分泌治疗对前列腺癌治疗效果较好,能够有效改善机体免疫功能,控制PSA、fPSA水平,进而提高患者生存质量,值得临床推广。
