XRCC4基因多态性与肝癌发生、发展的关系
2019-08-28胡建敏谭桂花
胡建敏 谭桂花
肝癌(hepatocellular carcinoma,HCC)是当前比较危重的疾病,5年生存率不足5%,我国每年死亡病例接近60万[1-2]。我国肝癌发病率东南沿海地区高于内地,且当前的发病率和死亡率均呈上升趋势。肝癌预后差的主要原因是癌细胞增值快,且容易侵犯门静脉导致肝内播散,出现肝内高转移率[3-4]。肝癌的发病机制仍不清楚,临床上认为该病是由遗传和环境因素之间联合作用引发的复杂疾病,具有很强的家族聚集性,有接近大约300余种肝癌的易感候选基因[5-6]。肝癌的发生与发展反映在基因及分子水平上主要与原癌基因的激活、抑癌基因的失活、DNA修复基因的改变等有关。DNA修复基因也称为XRCC4(X线交叉互补基因-4)是涉及恶性肿瘤发生多个环节的重要基因[7]。XRCC4定位于人染色体5q13.q14,是DNA连接酶Ⅳ的辅助因子,能作用于非同源末端连接的连接点,在DNA双链断裂的完善修复中发挥关键的作用[8]。目前对XRCC4研究最为广泛的单核苷酸多态性(single nucleotide polymorphisms,SNP)位点为Ale247Ser,已广泛开展了XRCC4 Ale247Ser与乳腺癌、膀胱癌、肺癌、食管癌、胃癌、结肠癌的关联性研究[9-11],但是与肝癌的发生与发展关系还无相关报道。本文具体探讨了XRCC4基因多态性与肝癌发生、发展的关系,希望能为肝癌的流行病学研究提供病因线索。现总结报道如下。
1 资料与方法
1.1 研究对象
采用回顾性、病例-对照的研究方法,研究时间为2014年5月至2018年2月,选择在我院肿瘤科进行诊治的肝癌患者56例(肝癌组,肝癌诊断依据包括病理组织学/细胞学诊断、血清学定量检测、肝脏影像学检查等,乙肝病毒检测阳性),同期选择肝癌高危人群120例(高危组,有肝癌家族史,无临床症状的乙肝病毒携带者)和健康人156例(对照组,健康献血人员,乙肝病毒检测阴性),纳入标准:医院伦理委员会批准了此次研究;临床资料完整;年龄20~75岁;入选者签署了知情同意书;未经放疗、化疗或生物治疗等干预措施的处理。排除标准:心、肝功能不良者;妊娠、哺乳期者;患急性感染性疾病者;心脑血管意外患者。
1.2 XRCC4基因多态性检测
所有入选者在晨起空腹取舒适体位,肘前静脉无菌采血5~8 ml后,采用QIANGEN血液基因组DNA提取试剂盒提取外周血淋巴细胞的DNA。使用DNA MAN软件设计待测多态性位点的PCR扩增引物及单碱基延伸引物,XRCC4 Ale247Ser引物序列为:正向引物:5‘-ACGTTGGATGAGGGCCCCAGTTTTTTAGAC-3’,反向引物:5‘-ACGTTGGATGCCCGGCCTCAACAAATGTAT-3’。探针和引物由大连TAKARA公司设计和提供,严格按照实验说明进行操作。5 μl反应体系:2×Mix 2.5 μl,40×Mix Kit 0.115 μl,模板DNA 1 μl,ddH2O 1.385 μl,PCR条件:40个循环,95 ℃ 10 min,92 ℃ 15 s,60 ℃ 1 min。扩增产物片段长度为186 bp。
所有入选者的血糖、血脂指标由我院检验科统一检测(奥林巴斯全自动生化分析仪),同时记录所有入选者的性别、年龄、体重指数、HBsAg、吸烟、饮酒等资料。
1.3 统计方法
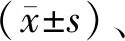
2 结果
2.1 基本特征对比
三组入选者的性别、年龄、体重指数、血糖、血脂等对比差异无统计学意义(P>0.05),肝癌组的吸烟、饮酒比例高于高危组与对照组,高危组高于对照组,对比差异都有统计学意义(P<0.05),见表1。

表1 三组入选者的基本特征对比
注:*与对照组对比,P<0.05;与高危组对比,#为P<0.05。
2.2 XRCC4基因型与等位基因分布
三组入选者的基因型分布均符合Hardy-Weinberg 遗传平衡(P>0.05),Ale247Ser位点的3种基因型CC、CT、TT和等位基因C、T在肝癌组、对照组、高危组之间的频率分布差异无统计学意义(P>0.05)。见表2。

表2 三组入选者的Ale247Ser位点基因型及等位基因分布对比(例,%)
2.3 相关性分析
在校正了年龄、性别、体重指数、血糖、血脂等混杂因素后,二元logistics回归模型显示与C等位基因相比,T等位基因入选者肝癌患病OR值为0.992;与CC基因型相比,携带CT、TT、CT+TT基因型的入选者肝癌患病OR值为0.872、0.983和0.911。见表3。

表3 不同XRCC4基因型入选者的肝癌患病风险(n=332)
3 讨论
肝癌是恶性度极高的肿瘤,具有病情进展快、侵袭性强、起病隐匿、潜伏期长、易转移等特点,严重威胁着人们的健康及生命[12]。肝癌的发生是多种因素综合作用的结果,其中基因是1个重要的因素,基因作为重要的内源性因素对肝癌的形成具有重要的作用[13]。
人类正常细胞中存在完整的DNA修复系统,通过多种DNA修复通路逆转DNA损伤,以维持基因的稳定性与正常的细胞进程[14]。DNA修复通路的获得性、遗传性缺陷将破坏基因的完整性,使细胞向恶性转变,可显著影响个体对肿瘤的易感性[15]。XRCC4是第1个被分离出来的影响细胞对电离辐射敏感性的哺乳类动物的修复基因,是1种重要的DNA修复基因,可广泛参与DNA损伤的修复,是1种重要的DNA修复基因。XRCC4可参与因电离辐射和氧化损伤引起的碱基切除修复和DNA单链断裂修复,其表达异常和多种恶性肿瘤的发生相关[16-17]。XRCC4全长33 kb,编码633个氨基酸,包含17个外显子,包括CAAT盒、N端区、CREB位点和尚未明确的转录结合位点。XRCC4基因的SNP位点比较多,主要位于XRCCI的编码区。其中Ale247Ser位点位于XRCC4基因第6外显子区域,第194密码子位点C-T的变异,可导致相应密码子丙氨酸-丝氨酸(Ale-Ser)的改变的变化[18]。本研究显示三组入选者的基因型分布均符合Hardy-Weinberg 遗传平衡(P>0.05),Ale247Ser位点的三种基因型CC、CT、TT和等位基因C、T在肝癌组、对照组、高危组之间的频率分布差异无统计学意义(P>0.05)。有学者对我国140例肝癌患者和536例对照的研究表明,在病例和对照组中,399Arg/Gln+Gln/Gln的基因型频率分别为48.6%和32.5%,对比差异有统计学意义(P<0.05)[19]。携带399Gln等位基因为肝癌的风险OR值为2.481,且与甲胎蛋白有联合作用,OR值为2.06[20]。
肝癌是多因素、多步骤、多基因、长期发展而成的,即在HBV感染及甲胎蛋白异常这两个主要风险因素以外,还有吸烟、饮酒以及遗传背景等因素[21]。特别是个体是否患肝癌不仅取决于环境因素,在很大程度上还取决于遗传易感性[22]。SNP是人类长期进化过程中由于环境的选择形成的基因点的突变,人群中的发生频率大于1%,是指基因组水平上由单个核苷酸变异引起的DNA序列多态性,包括单碱基的变化以及单碱基的插入/缺失等表现形式[23]。本研究显示二元logistics回归模型显示与C等位基因相比,T等位基因入选者肝癌患病OR值为0.992;与CC 基因型相比,携带CT、TT、CT+TT基因型的入选者肝癌患病OR值为0.872、0.983和0.911。XRCC4是KuTO/KuSO介导的DNA末端结合复合物的一部分,XRCC4与DNA连接酶Ⅳ有密切关系,能增强DNA连接酶Ⅳ的活性[24-25]。不过本研究未在动物水平进一步验证XRCC4的功能,另外在机制研究方面还有待进一步深入,将在后续的工作中进行完善。
综上所述,肝癌患者可表现为XRCC4基因多态性,XRCC4 Ale247Ser可导致肝癌的患病风险发生变化,可参与调节肝癌的发生与发展。
