罗非鱼鱼皮酶解物对罗非鱼鱼片的冷冻保护作用
2019-08-28史芮源曹文红张雨婕黄锐鑫刘珍妮
史芮源,曹文红,2,张雨婕,黄锐鑫,刘珍妮
(1.广东海洋大学食品科技学院,广东 湛江 524088;2.广东省水产品加工与安全重点实验室/广东省海洋生物制品工程实验室/广东省海洋食品工程技术研究中心/水产品深加工广东普通高等学校重点实验室,广东 湛江 524088)
【研究意义】由于水产品高蛋白、低脂肪、高水分的特性,冷冻保藏是水产品加工保藏过程中的主要方式,而在此期间发生的蛋白质冷冻变性是导致其品质下降的主要原因[1],目前最为有效的避免水产品冷冻变性的措施是添加抗冻保护剂,常用的抗冻剂有蔗糖、多聚磷酸盐、海藻糖等[2]。蔗糖会使产品带有甜味,且对肥胖者、糖尿病、高血糖患者等特殊人群产生不利影响,磷酸盐过多摄入对人体钙质的吸收也有一定影响。食源性的抗冻保护剂则可以有效避免这些问题,利用鱼皮开发新的抗冻保护剂,既可以提高鱼类的附加价值,解决鱼皮浪费问题,又能为进一步研究蛋白型抗冻剂提供理论依据。【前人研究进展】林娴萍等[3]对鲐鱼肉酶解产物的研究发现,其对带鱼鱼糜蛋白的冷冻变性有良好的抑制效果;刘永乐等[4]研究发现鲶鱼复合蛋白酶酶解物具有一定抗冻保护效果;张怡等[5]探究了碱性蛋白酶对金线鱼鱼皮进行酶解的最优条件,并对其理化性质进行探究;DU等[6]研究了鸡皮胶原蛋白水解物对天然肌动球蛋白的抗冻保护作用,发现其具有减缓蛋白质冷冻变性和氧化作用;束玉珍等[7]对鲐鱼肉酶解物进行了研究,发现其具有一定的抗冻保护作用。【本研究切入点】有关研究表明,食品蛋白质水解物多肽,尤其是水产品加工副产物中的衍生多肽,可以有效抑制水产品在冷冻保藏过程中发生的蛋白质冷冻变性,且冷冻保护效果可与传统抗冻剂媲美,避免传统抗冻剂存在的危害,使得鱼类副产物得到充分利用[8]。不同鱼源的酶解条件可能具有较大差异,罗非鱼作为消耗量极大的品种,未见利用其鱼皮开发抗冻保护剂的相关报道,需进行酶解条件的优化,同时对其抗冻保护活性进行评估。【拟解决的关键问题】利用罗非鱼鱼皮酶解制得酶解产物,对酶解时的温度、酶添加量、pH值与时间进行探究,并以罗非鱼鱼片为实验对象,对比酶解产物与含磷抗冻保护剂对其保水性、Ca2+-ATPase 活性、盐溶性蛋白与巯基含量的影响差异,以期为开发新型食源性抗冻保护剂奠定基础。
1 材料与方法
1.1 试验材料
试验于2018年5~8月在广东海洋大学广东省水产品加工与安全重点实验室及水产品深加工广东普通高等学校重点实验室进行。
材料与试剂:罗非鱼冷冻鱼皮,购于湛江国联水产有限公司;新鲜罗非鱼,购于湛江霞山东风市场;碱性蛋白酶(来源为微生物,2.4 AU/g),购于诺维信(中国)生物科技有限公司;维生素B12(1 355.38 u)、溶菌酶(14 300 u)、马尿酰-组氨酰-亮氨酸(429.47 u)、L-酪氨酸(181.19 u),购于美国Sigma公司。
仪器:CR22GLL台式高速冷冻离心机,长沙英泰仪器有限公司;VULCAN.3-550PD.马弗炉,美国VULCAN公司;FDU-1100真空冷冻干燥机,埃朗科技国际贸易有限公司;PHS-25C精密pH计,上海康仪仪器股份有限公司; HH-6数显恒温水浴锅,常州国华电器有限公司;N-1100V-WB旋转蒸发仪,上海埃朗仪器有限公司;LC20AD高效液相色谱,日本岛津公司;UV2550紫外分光光度计,日本岛津公司。
1.2 试验方法
1.2.1 罗非鱼鱼皮酶解产物的制备 冷冻鱼皮于室温解冻,去鱼鳍、鱼鳞以及与鱼皮粘连的鱼肉,清水洗净后切成细条状,脱脂后2.5% 氯化钠溶液处理10 h,沥干后加入1∶1的去离子水热烫软化,然后捣碎成鱼浆,1∶1加入去离子水,搅拌15 min,然后加入一定量的碱性蛋白酶,调节pH、温度进行酶解,酶解一定时间后,将酶解液转移至100 ℃热水中灭活15 min,8 000 r/min冷冻离心20 min后,取上清液于0.1 MPa真空度、50 ℃旋转蒸发浓缩,转移至冷冻干燥箱干燥后备用。
1.2.2 酶添加量、温度、pH值对鱼皮酶解的影响 单因素试验各设置5个处理,分别为酶添加量(碱性蛋白酶占鱼皮的百分数)0.1%、0.3%、0.5%、0.7%、0.9%;温度55、60、65、70、75 ℃;pH值6.5、7.0、7.5、8.0,3次重复,通过计算酶解液的水解度比较酶解效果,选取最优酶添加量、温度、pH值进行正交试验。
1.2.3 酶解条件的优化 选取不同酶添加量、温度、pH对罗非鱼鱼皮酶解产物进行反应条件的单因素影响研究(表1),通过计算酶解液的水解度比较酶解效果,选取最优的酶添加量、反应温度、pH,进行3因素3水平正交优化试验。

表1 罗非鱼鱼皮皮水解试验因素水平Table 1 Levels of factors for the hydrolysis test of tilapia skin
1.2.4 水解度的测定方法 运用凯氏定氮法测原料中的总氮量[9];使用甲醛滴定测酶解液中游离氨基态氮含量[10]。水解度平行测定3次。

1.2.5 酶解产物肽分子量测定 参照文献[11]的方法,稍做修改,使用高效体积排阻色谱法(HPSEC)测定酶解产物分子量分布状况。色谱条件:流动相为Tris-HCl缓冲液(pH 8.3、浓度0.05 mol/L);色谱柱:Waters Protein-pak 60A(WAT085250);0.7 mL/min的洗脱速度;25 ℃柱温;加20 μL样品,样品浓度稀释到100 μg/mL;214 nm波长进行检测。标准品分别为:维生素B12(1 355.38 u)、溶菌酶(14 300 u)、马尿酰-组氨酰-亮氨酸(429.47 u)、L-酪氨酸(181.19 u)。以分子量的对数lgM为纵坐标、保留时间(t)为横坐标,得到分子量回归方程:lgM=-0.4567t+8.9462(R2=0.9976)。
1.2.6 冻藏罗非鱼鱼片的处理
(1)洗净新鲜罗非鱼,去鱼头、鱼鳍、鱼尾和内脏后再次用清水洗净,此过程温度控制在10 ℃左右。(2)鱼肉片和皮、骨分离后将鱼肉切成均匀的薄片并均等分入小烧杯中,分成3个处理:以鱼片重量的0.5%加入复合磷酸盐抗冻剂为含磷抗冻剂处理、以鱼片重量的5%加入罗非鱼皮酶解产物为酶解产物处理、无任何添加为空白对照。(3)于-75℃冰箱冻藏2 h再转移至-18℃中冻藏,而后取样测定冻藏过程中的各项冷冻保护活性生化指标。
1.2.7 酶解产物冷冻保护作用研究 (1)失水率测定。参考俞裕明[12]的方法,在冷藏0、1、2、3、4、6周测定罗非鱼鱼片失水率,3次重复。

(2)盐溶性蛋白制备及测定。参照万建荣[13]方法稍作修改:称取3 g解冻后的罗非鱼鱼片加入磷酸盐缓冲液(I=0.05,pH=7.5)30 mL进行研磨,研磨5 min后于4 ℃、8 000 r/min冷冻离心15 min,重复2次,取沉淀物,向其中加入30 mL氯化钠溶液(pH=7.0,0.6 mol/L),0~4 ℃提取20 h后于4 ℃、8 000 r/min离心15 min,取上清液测定。采用Follin酚法测定上清液蛋白质含量(盐溶性蛋白含量),冻藏0、1、2、3、4、6周检测罗非鱼鱼片盐溶性蛋白含量,3次重复。
(3)Ca2+-ATPase酶活测定。根据超微量Ca2+-ATPase测试盒的方法和步骤来测量罗非鱼鱼片的Ca2+-ATPase酶活,吸光度波长636 nm,光径0.5 cm,冻藏0、1、2、3、4、6周分别测定1次罗非鱼鱼片Ca2+-ATPase酶活,3次重复。Ca2+- ATPase酶活计算公式:

(4)总巯基含量测定。参照BENJAKUL[14]的方法,在冷藏0、1、2、3、4、6周取样检测,3次重复。
试验数据使用Excel 2016进行统计分析。
2 结果与分析
2.1 鱼皮酶解单因素试验结果
2.1.1 酶添加量对鱼皮酶解的影响 由于酶添加量在某一区间对蛋白质水解作用影响较大,通过预实验确定酶添加量区间为0.1%~0.9%。从图1可以看出,当酶添加量为0.7%时,提取效果最为明显,水解度值最大、为30.17%。酶添加量为0.5%、0.9%时,水解度分别为27.64%、29.58%,正交试验时酶添加量选用0.5%、0.7%、0.9%。
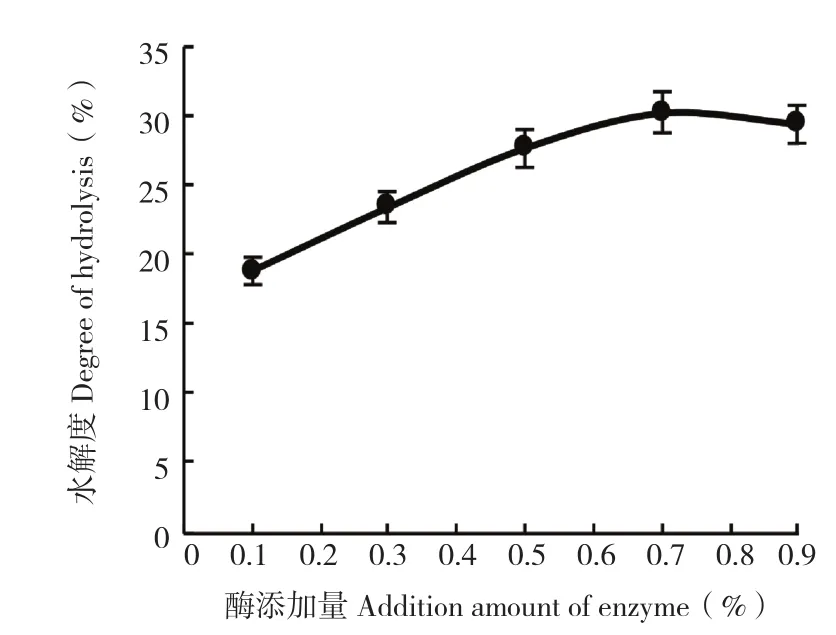
图1 酶添加量对罗非鱼鱼皮酶解的影响Fig.1 Effect of enzyme addition on the enzymatic hydrolysis of tilapia skin
2.1.2 温度对鱼皮酶解的影响 温度可能对酶解作用时酶与底物的结合方式产生作用,造成酶解产物成分不同。从图2可以看出。温度为65 ℃时,鱼皮酶解产物水解效果最明显,水解度达到31.05%,温度为55、60 ℃时,水解度分别为26.64%、30.17%,大部分蛋白酶的最佳温度在40~60 ℃,酶活性在低温下受到抑制,而酶解温度过高则容易导致酶失活,因此正交试验时选取的酶解温度为55、60、65 ℃。

图2 温度对罗非鱼鱼皮酶解的影响Fig.2 Effect of temperature on the enzymatic hydrolysis of tilapia skin
2.1.3 pH值对鱼皮酶解的影响 pH值过大或者过小均可能造成酶失活,导致水解度下降,本实验采用的是碱性蛋白酶,因此选择pH值较大的区间进行单因素试验,结果见图3。pH为7.5时,鱼皮水解度最大,为35.40%,pH为7.0和8.0时作用效果较好,确定正交试验时pH值选取7.0、7.5、8.0。
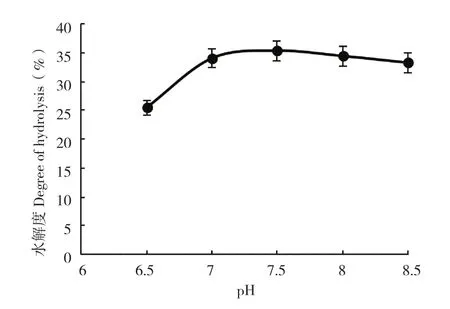
图3 pH值对罗非鱼鱼皮酶解的影响Fig.3 Effect of pH on the enzymatic hydrolysis of tilapia skin
2.2 鱼皮酶解工艺正交优化结果
酶添加量、温度、pH值3个因素对碱性蛋白酶的水解产生影响大小不一,需要进行正交试验,优化酶解因素,鱼皮酶解条件正交试验结果见表2。由表2可知,对酶解产物水解度影响最大的因素是酶添加量(B),极差值为9.95,其次是温度(A)和pH(C),极差值分别为3.00、2.85,根据各因素平均水平,得出最佳提取组合为A1B2C2,即温度55 ℃、酶添加量0.7%、pH7.5。
酶解时间达到一定时,对水解度几乎没有影响,时间过长可能使具有抗冻活性的片段失活,因此需探究不同时间对A1B2C2组合水解度的影响,结果见图4。0~7 h内,随着酶解反应时间增加,水解度也随之上升,0~3 h内,水解度上升趋势尤为明显,而4~7 h内,水解度无显著变化,表明在3 h左右酶解反应基本完成,因此确定最佳反应时间为3 h。
2.3 酶解产物肽分子量分布
酶解产物肽分子量的分布如图5所示。根据HPSEC得到的分子量回归方程,可计算出罗非鱼鱼皮酶解产物的分子分布情况,结果见表3。由表3可知,酶解产物肽的分子量主要分布在367.05~6264.80 u,其中分子量在6 264.80 u左右的多肽类占43.71%,367.05 u分子量附近的比重分别为达26.68%。孙丽洁[19]得到的抗冻多肽分子量主要分布在小于3 000 u区间,目前研究结果表明抗冻多肽相对分子质量较低,具有较强的冷冻保护活性,可能是因为分子质量小的多肽更容易与冰晶表面结合,阻碍冰晶生长,而小分子肽也可以与水形成氢键,增强冻结过程水的稳定性,减少大冰晶形成[1]。

表2 酶解正交试验结果Table 2 Orthogonal experiment result of the enzymatic hydrolysis

图4 酶解时间对罗非鱼鱼皮酶解的影响Fig.4 Effect of time on the enzymatic hydrolysis of tialapia skin
2.4 酶解产物冷冻保护效果
2.4.1 冻藏过程中罗非鱼鱼片失水率变化 鱼肉的保水性是判断冷冻保护效果的重要指标之一,罗非鱼鱼片失水率在冻藏过程中的变化如图6所示。冻藏时间延长导致罗非鱼鱼肉失水率上升,且空白对照上升幅度较复合磷处理和酶解产物处理大。冻藏4周后,空白对照失水率达到7.38%,含磷抗冻剂处理的失水率为2.16%,酶解产物处理的失水率为2.22%,与含磷抗冻剂处理失水率接近。冻藏6周时,空白对照的失水率仍显著高于含磷抗冻剂处理组和酶解产物处理。

图5 罗非鱼鱼皮酶解产物的HPSEC图谱Fig.5 HPSEC map of the enzymatic hydrolysate of tilapia skin

表2 酶解正交试验结果Table 2 Orthogonal experiment result of the enzymatic hydrolysis

图6 冻藏过程中罗非鱼片失水率变化Fig.6 Variation of water loss rate of tilapia fillets during the frozen storage

图7 冻藏过程中罗非鱼片盐溶性蛋白含量变化Fig.7 Changes of salt soluble protein content in tilapia fillets during the frozen storage
2.4.2 冻藏过程中罗非鱼鱼片盐溶性蛋白含量变化 肌原纤维蛋白是鱼肉蛋白在冻藏过程主要的变性部分,因此将盐溶性蛋白含量在冻藏过程中的变化作为评价鱼皮酶解产物的冷冻保护作用的指标。如图7所示,3个处理样品的盐溶性蛋白浓度在冻藏1~6周均呈下降趋势,而空白对照的下降趋势更为明显。冻藏1周时,空白对照的盐溶性蛋白由最初鲜鱼盐溶性蛋白含量为84.13 mg/g下降到31.13 mg/g,含磷抗冻剂处理和酶解产物处理则分别下降到41.18、53.19 mg/g;冻藏1周后,下降幅度减缓;冻藏4周后,含磷抗冻剂处理和酶解产物处理的盐溶性蛋白含量基本相同。冻藏6周结束时,空白对照、含磷抗冻剂处理、酶解产物处理盐溶性蛋白含量分别为4.65、24.02、21.39 mg/g,相比冻藏开始时分别下降了94%、71%、74%,而当冻藏时间在1~4周时,酶解产物处理的盐溶性蛋白质含量略高于含磷抗冻剂处理。
2.4.3 冻藏过程中罗非鱼鱼片Ca2+-ATPase酶活变化 冻藏中形成的冰晶和升高的离子强度使蛋白质发生改变,导致肌球蛋白球状头部的Ca2+-ATPase酶活下降[15]。因此,在冻藏过程中Ca2+-ATPase酶活的变化情况可以作为鱼肉冷冻保护效果的指标[7]。罗非鱼鱼片Ca2+-ATPase酶活冻藏过程中的变化如图8所示,冻藏开始时,空白对照组酶活下降速度最快,冻藏1周后,3组Ca2+-ATPase酶活分别为0.113、0.1619、0.1661 μmolPi/mgprot·h,分别下降了 45%、21.19%。含磷抗冻剂处理组和酶解产物处理的Ca2+-ATPase酶活下降速度较慢。冻藏结束时,3组Ca2+-ATPase酶活分别为0.035、0.0429、0.0427 μmolPi/mgprot·h,基本相等,含磷抗冻剂处理组略高。

图8 冻藏过程中Ca2+-ATPase酶活变化Fig.8 Changes of Ca2+-ATPase activity during the frozen storage
2.4.4 冻藏过程中罗非鱼鱼片总巯基变化 活性巯基和隐藏性巯基是存在于肌原纤维蛋白中的两类巯基,活性巯基可分为 SH1、SH2、SHa[15],肌球蛋白头部SH1和SH2与Ca2+-ATPase酶活性关系密切[16],冻藏时肌原纤维蛋白中活性巯基会被暴露氧化[17],因此在冻藏过程中总巯基的减少量可以作为蛋白质冷冻保护效果的指标[16]。从图9可以看出,从冻藏开始到结束,总巯基含量均呈下降趋势,含磷抗冻剂处理组和酶解产物处理组下降趋势基本相同,冻藏6周后,空白对照、含磷抗冻剂处理、酶解产物处理的总巯基含量分别为 5.176×10-5、5.265×10-5、5.333×10-5mol/L,分别下降38%、37%、36%,空白对照最低,含磷抗冻剂处理次之,酶解产物处理最高。

图9 冻藏过程中罗非鱼片总巯基含量的变化Fig.9 Changes of total sulfhydryl in tilapia fillets during the frozen storage
3 讨论
酶解过程中,酶添加量、反应温度、pH值、酶解时间均会对酶解产物的成分造成很大影响,张怡等[5]对金线鱼鱼皮酶解优化的结果表明,碱性蛋白酶最佳酶解条件为:底物与酶比例30∶1、时间147 min、温度50 ℃、pH值9,此条件下的抗冻蛋白得率为49.25(±1.34)%,分子量≥5 000~10 000 u的多肽抗冻效果最佳。洪燕婷等[18]与孙丽洁等[19]对蛋白酶酶解温度的研究结果表明,大部分蛋白酶的最佳酶解温度在40~60℃,汪少芸等[20]实验数据表明,碱性蛋白酶对鱼皮酶解的最佳pH值在7~9,漆嫚等[21]使用胰蛋白酶酶解鲈鱼蛋白最佳温度为40 ℃,李高荣等[22]研究碱性蛋白酶最佳温度为45 ℃。由于计算方法、实验原料、碱性蛋白酶的厂家以及原料处理方法不同,且不同鱼源的含量与结构有所不同,温度、酶添加量与pH值对其酶解效果的影响也不相同,优化所得温度较高,反应时间较长,酶添加量与pH值均较低。本研究制备的罗非鱼鱼皮酶解产物分子量主要分布在367.05~6 264.80 u范围内,根据文献报道此区间内的多肽物质具有较好的冷冻保护活性。
水产品的保水性、Ca2+-ATPase酶活性、盐溶性蛋白与巯基含量是衡量抗冻剂冷冻保护效果的重要指标,冷冻过程中细胞的损伤是由大冰晶造成,由此引起蛋白质变性,从而导致解冻时汁液流失增加[23]。复合磷酸盐抗冻剂能够使得蛋白质空间结构中容纳更多的水分子,从而减少鱼肉的失水率[24]。而鱼源性酶解产物可以阻挡不同水分子之间的位移,从而使冷冻过程中鱼肉肌原纤维水分比较稳定。束玉珍等[7]对鲐鱼肉酶解物进行研究发现,鱼肉酶解产物具有一定的保水性,添加鱼肉酶解产物组样品Ca2+-ATPase酶活性明显高于空白,多磷酸盐抗冻剂和鱼肉酶解物在不同程度上均有保护活性巯基的作用。
本研究亦发现,含磷抗冻剂处理和酶解产物处理的鱼片失水率在冻藏过程中减少幅度较低,说明多磷酸盐抗冻剂和酶解产物对鱼肉在冻藏过程中有提高保水性的作用;复合磷酸盐和酶解产物可以减缓鱼片Ca2+-ATPase酶活性和巯基含量的下降速度,一定程度上抑制蛋白质冷冻变性,具有冷冻保护作用,酶解产物处理效果较含磷抗冻处理好。SULTANBAWA[25]研究显示,-18℃冻藏4个月的蓝鳍鱼糜蛋白,盐溶性蛋白含量由60%下降至19%,其中空白对照最为严重,多磷酸盐抗冻剂和酶解产物均可以减缓这种变性,酶解产物的作用效果略优。多磷酸盐具有良好的纤维改善性质[26],可以稳定肌原纤维蛋白的构象,起到保水的作用,海藻糖等糖类则可以与极性基团结合,减少结合水的含量,同时与更多的水分子形成易解离的氢键,抑制冰晶的形成[27],鱼皮酶解产物的抗冻保护效果主要源于分布在367.05~6 264.80 u范围内的酶解产物含有大量暴露的羟基等亲水基团,可以与水构成氢键,以增强水的稳定性,进而避免鱼肉蛋白空间结构的剧烈变化,另一方面酶解产物能够在一定程度上抑制脂肪的氧化,阻止了鱼肉蛋白羰基化合物形成并且有效降低了总巯基损失[28],但是对于具体是哪些序列的基团具有抗冷冻变性的作用,有待进一步研究探索。
本研究从多方面证明鱼皮碱性蛋白酶酶解产物具有较强的抗冻保护活性,其具体的抗冻活性多肽有待进一步分离纯化与鉴定分析。
4 结论
以罗非鱼鱼皮为原料,单因素和正交试验优化了碱性蛋白酶酶解罗非鱼皮的最佳工艺参数:温度55 ℃、酶添加量0.7%、pH7.5;在最佳酶解工艺参数下所得酶解产物分子量主要集中在367.05~6 264.80 u;以失水率、盐溶性蛋白含量、Ca2+-ATPase酶活、总巯基含量为指标显示,以5%添加量的酶解产物处理对冷冻罗非鱼片的冷冻变性保护效果优于空白对照和含磷抗冻剂处理,表明以肽为主体的罗非鱼皮碱性蛋白酶酶解产物具有良好的冷冻保护活性。
