小柴胡汤对NTHi诱导的肺部炎症的影响
2019-08-28陈平安黄家望廖灿袁娉谢希陈俊炜程莉娟
陈平安,黄家望,廖灿,袁娉,谢希,陈俊炜,程莉娟*
(1.湖南中医药大学医学院,湖南 长沙 410208;2.湖南中医药大学中西医结合学院,湖南 长沙 410208; 3.湖南中医药大学中医学院,湖南 长沙 410208)
不可分型流感嗜血杆菌(non-typeable haemophilus influenzae,NTHi)是一种无荚膜的革兰阴性杆菌,容易引起非侵袭性感染,造成成人及幼儿肺炎、脑膜炎、中耳炎[1]。它通过寄居于呼吸道黏膜上皮细胞和巨噬细胞,躲避机体对其实施的细胞免疫[2]。 NTHi会在宿主抵抗力下降时大量繁殖,释放细菌产物,引起炎性细胞因子的释放和炎性细胞的聚集,导致炎症的发生。目前国内外还没有可以预防NTHi感染的疫苗问世,研究NTHi的防治机制仍然十分重要[3-4]。本研究利用小鼠构建NTHi急性肺部感染模型,小柴胡汤为治疗药物,探讨小柴胡汤对炎性细胞因子白介素-1β(Interleukin -1β,IL -1β)、白 介 素-6(Interleukin -6,IL-6)、 肿 瘤 坏 死 因 子 -α(Tumor Necrosis factor-α,TNF-α)和粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)表达水平的影响,小鼠肺组织损伤和炎症的改善程度,为小柴胡汤临床治疗NTHi诱导的肺部炎症提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器
精密分析天平(瑞士Mettler公司AE240),台式高速冷冻离心机(美国Thermo),医用净化工作台(吴江市净化设备总厂YJ-875A),-80℃超低温冰箱(美国Thermo),超微量分光光度计(德国IMPLEN),微量移液器(德国eppendorf),HH-W三用恒温水浴箱(金坛市大地自动化仪器厂),DHP-81恒温箱(上海医用仪器厂),石蜡切片机(美国A0820),超纯水仪(millipore公司),多功能酶标仪(美国bio-tek,Synergy2)。
1.1.2 主要试剂
小鼠IL-1β(Abcam,ab100704),IL-6(Abcam,ab100712),G-CSF(Abcam,ab197743),TNF-α(Abcam,ab100747)ELISIA检测试剂盒。
1.1.3 实验菌株
用哥伦比亚巧克力血琼脂平板在37℃,5%CO2的环境下传代培养NTHi 12h,无菌生理盐水重悬细菌,无菌甘油调至20%终浓度,-80℃保存[5]。
1.1.4 实验动物
6~8周C57小鼠,雌雄各半,体质量(20±2)g,由湖南中医药大学动物实验中心代购。
1.1.5 实验药品
药物购自湖南中医药大学第一附属医院。氨苄西林,联邦制药,0.5 g/片,批号:70910804,用双蒸水配置成0.011 g/mL作为阳性对照药物。小柴胡汤的主要成分为柴胡24 g,黄芩9 g,姜半夏9 g,生姜6 g,党参9 g,甘草9 g,大枣4枚。将上述7味中药,以8倍量蒸馏水浸泡30 min,加热保持微沸30 min,过滤;残渣加6倍量蒸馏水,微沸30 min,过滤,合并2次滤液,混合后滤液干燥浓缩至138.8 mL,配成浓度为0.562 g/mL,4℃冰箱保存。
1.2 实验方法
1.2.1 NTHi感染小鼠肺炎模型建立
将40只C57小鼠正常饲养2~3天,采用随机数字表法编号,随机抽取10只作为正常对照组,其余30只小鼠作为实验组。通过预实验筛选出2×105CFU/肺为小鼠感染的造模剂量。照参考文献[6]方法制备琼脂珠包裹的NTHi琼脂珠悬液,对实验组小鼠进行滴鼻造模,互相感染24h,正常组给予等量灭菌生理盐水滴鼻干预。采用随机数字表法将实验组的30只小鼠分为模型组、氨苄西林阳性对照组、小柴胡汤组,每组10只,分笼饲养,自由饮水取食,并与正常组小鼠分房间饲养。
1.2.2 给药
正常组和模型组小鼠给予0.4 mL/(20 g·d)灌胃生理盐水,各药物组给予0.4 mL/(20 g·d)灌胃相应药物,连续给药7 d。动物给药剂量按动物每公斤体质量占人体表面积的比值计算[7]。
1.2.3 分离血清
最后一次给药结束后,小鼠禁水禁食8 h,眼眶取血,灭菌1.5 mLEP管收集血液, 4℃静置2 h,2 500 rpm离心10 min,小心吸取出上层血清,-20℃保存。
1.2.4 检测小鼠体质量、肺指数及免疫器官指数
记录造模和给药期间各组小鼠的体质量。最后一次给药结束后,禁水禁食8 h,断颈处死小鼠,取出肺组织、胸腺和脾脏,称重并记录。称重后的肺组织取左肺用4%的多聚甲醛溶液固定,常温保存,右肺于-80℃保存。脏器指数按如下公式进行计算[8]。
脾指数(mg/g)=脾脏重量(mg)/体质量(g)
胸腺指数(mg/g)=胸腺重量(mg)/体质量(g)
肺指数(mg/g)=肺脏重量(mg)/体质量(g)
1.2.5 HE染色观察小鼠肺组织病理变化
取4%多聚甲醛固定的左肺、梯度脱水、二甲苯透明、石蜡包埋、间断连续5 μm厚切片,HE染色、脱水、透明、封片。光学显微镜下观察肺组织病理变化。
1.2.6 ELISA法检测小鼠血清中IL-1β、IL-6、TNF-α和G-CSF表达水平
按照说明书进行标准品的稀释,每个标准样本和实验样本做3个复孔,向孔内加入生物素标记和酶标抗体,37℃孵育60 min,洗涤拍干重复5次后,先后加入显色剂A和显色剂B各50 μL,37℃避光显色10 min,加入50 μL终止液终止反应,放入酶标仪中用450 nm波长测量各孔吸光度(OD)值,计算出标准曲线的直线回归方程,算出样品浓度,分析它们在小鼠血清中的表达水平。
1.2.7 统计分析
2 结果与分析
2.1 各组小鼠状态
正常组小鼠精神状态良好,活动能力强,毛发顺滑,皮肤紧致,抓取时反抗强烈。模型组小鼠精神萎靡,不好动,毛发竖起,皮肤松弛,经常蜷缩在一起,饮食量少。各药物组小鼠的状态较模型组小鼠有不同程度地缓解。
2.2 体质量变化
实验前均衡好各组小鼠的体质量,使其符合NTHi造模的要求(P>0.05)。NTHi感染小鼠后,模型组小鼠的体质量下降明显,与正常组比较,差异显著(P<0.01)。药物组小鼠的体质量均有不同程度地增加,与模型组比较,有显著差异(P<0.05)。各组比较结果见表1。
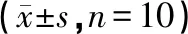
表1 药物对小鼠体质量变化的影响
注:与正常组同期比较,**P<0.01;与模型组同期比较,△P<0.05
2.3 脏器指数分析
模型组小鼠肺指数明显增加,胸腺指数和脾指数降低,与正常组比较有显著差异(P<0.01)。与模型组比较,各药物组小鼠肺指数均有不同程度地下降(P<0.05),胸腺指数和脾指数也有一定程度地升高,但无统计学差异。各组比较结果见表2。
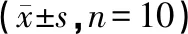
表2 药物对小鼠脏器指数的影响
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05
2.4 肺组织炎性细胞因子表达水平比较
模型组小鼠血清中炎性细胞因子IL-1β、IL-6、TNF-α和G-CSF的表达水平明显增加,与正常组比较有显著差异(P<0.01)。药物组小鼠血清中炎性细胞因子的表达水平均有不同程度地下降(P<0.05)。结果见表3。
2.5 HE染色光镜观察
正常组:小鼠肺支气管和肺泡结构完整,肺内未见炎症细胞浸润;模型组:肺组织纤维化严重,肺泡壁增厚加重,炎性细胞浸润增多;氨苄西林组:肺组织纤维化减轻,肺泡开始扩张,肺间质未见炎性细胞浸润,肺组织损伤程度较模型组明显减轻;小柴胡汤组:肺组织纤维化减轻,肺泡开始扩张,呈修复趋势,肺间质有少量炎性细胞浸润,肺组织损伤程度较氨苄西林组无明显差异,较模型组有所减轻。各药物组均能不同程度地改善肺组织纤维化及炎症渗出现象。结果见表4与图1。
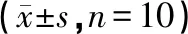
表3 药物对炎性细胞因子表达含量的影响
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05
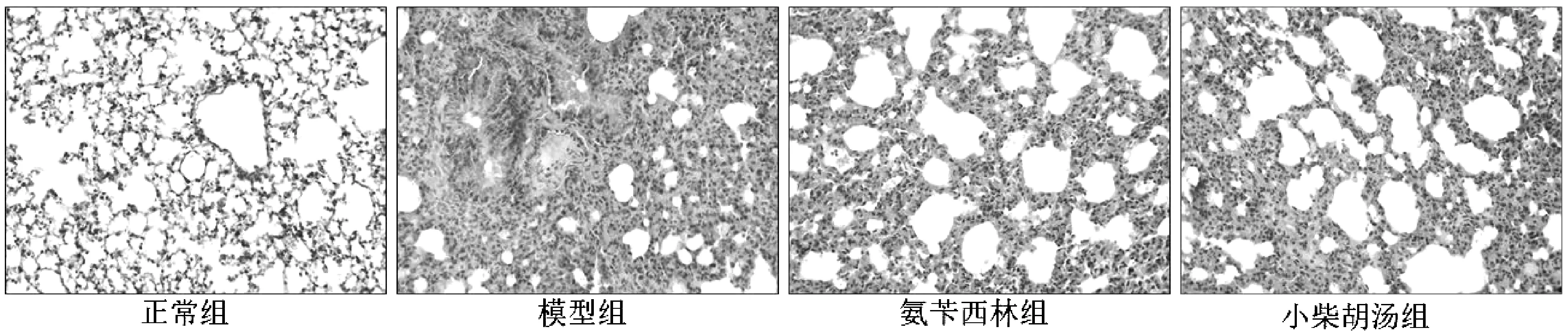
图1 各组小鼠肺组织HE染色光镜观察(200×)
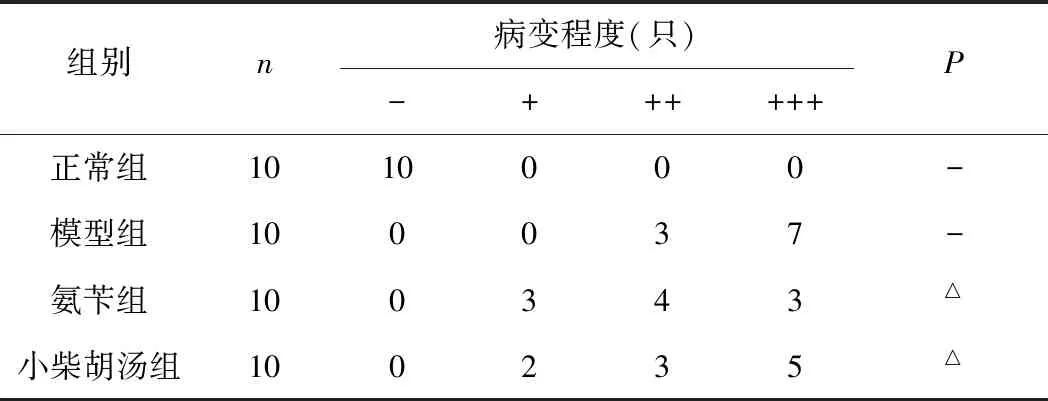
表4 各组小鼠肺组织病变程度
注:与模型组比较,△P<0.05
3 讨论
NTHi是一种无荚膜的革兰阴性杆菌,其释放的细菌产物如内毒素、纤毛毒素和蛋白水解酶等,容易导致炎性细胞因子释放和炎性细胞在呼吸管道和肺部组织聚集,诱发巨噬细胞和肥大细胞脱颗粒。NTHi感染后,白介素(Interleukin,IL)-8、IL-6、和TNF-α的分泌会大量增加,细胞间黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达含量上升,从而引发炎症,导致肺组织纤维化和肺泡壁增厚加重[9]。本研究肺组织切片显示,模型组小鼠肺组织纤维化明显,肺泡壁增厚加重,炎性细胞浸润增多,而小柴胡汤组小鼠的肺组织纤维化及炎症渗出现象得到了一定程度地改善。
NTHi感染诱发的炎症反应主要是由IL-1β、IL-6和TNF-α等炎性细胞因子介导的[10]。IL-1β来源于周围和中枢神经细胞,是一种重要的炎性因子,可诱导IL-8、巨噬细胞炎症蛋白1等多种炎性因子的产生及释放[11]。IL-6 作为促炎因子,对炎症反应具有促进和放大的作用。同时,组织细胞受损的程度可以通过测量IL-6的含量得到有效的反映,因此临床上常用它来诊断急慢性炎症[12]。TNF-α主要由巨噬细胞和单核细胞产生,可诱导中性粒细胞在肺内聚集,在炎症反应中发挥着重要的作用[13]。G-CSF是一种糖蛋白,主要通过TNF-α、内毒素和干扰素-γ可活化巨噬细胞和单核细胞产生,它能刺激粒细胞、单核细胞和巨噬细胞成熟,调节中性粒细胞系增殖和分化[14],临床上可用G-SCF治疗由感染引起的中性粒细胞减少症。因此,本研究选取IL-1β、IL-6、TNF-α和G-CSF为研究靶点,探讨了它们在药物干预前后NTHi感染小鼠血清中的表达水平,旨在为临床治疗NTHi感染提供新的治疗方案。
小柴胡汤出自《伤寒论》,由柴胡、黄芩、党参、甘草、半夏、生姜、大枣七味药组成。实验研究证实[15],小柴胡汤可以降低脂多糖诱导大鼠发热模型的体温,并且解热效果明显。现代药理学研究表明[16],柴胡中的柴胡皂苷可抑制炎性介质如IL-1β、IL-6、TNF-α的释放,又能抑制白细胞向炎症组织聚集,还能改善炎症组织增生现象。Zhang等研究表明[17],黄芩中的黄芩苷能通过降低TNF-α mRNA的表达水平,从而减少炎性细胞因子的释放。另有研究发现[18],黄芩素可以通过抑制NF-κB通路的活化,从而降低IL-1β、IL-6和IL-8等炎性细胞因子的释放。本研究脏器指数结果显示,小柴胡汤能够增加小鼠的脾和胸腺指数,从而提高小鼠的免疫力,达到治疗肺炎的目的[19-20]。炎性细胞因子比较结果显示,小柴胡汤组炎性细胞因子IL-1β、IL-6、TNF-α和G-CSF较模型组表达水平明显降低,表明小柴胡汤对以上炎性细胞因子的分泌具有抑制作用,从而缓解炎性反应,其机制可能是通过抑制NK-κB通路的激活来降低炎性细胞因子的释放,但其具体的作用机制还有待进一步研究[21]。
综上所述,本研究结果提示小柴胡汤可通过抑制炎性细胞因子IL-1β、IL-6、TNF-α和G-CSF的分泌来缓解NTHi诱导的小鼠肺部炎症损伤和炎症程度,为小柴胡汤临床治疗NTHi诱导的肺部炎症提供了初步理论依据。
