齐墩果酸衍生物SZC014同时诱导乳腺癌细胞的凋亡和自噬
2019-08-28谢贤鑫王聪李伟杰李欢姜大庆
谢贤鑫,王聪,李伟杰,李欢,姜大庆*
(1.中国医科大学肿瘤医院,辽宁 沈阳 110042;2.辽宁省乳腺癌研究重点实验室,辽宁 沈阳 110042)
乳腺癌是女性最常见的恶性肿瘤之一,约占女性肿瘤的三分之一[1-3]。外科手术切除作为治愈性治疗的基石传统上是早期癌症的初始治疗,而化疗及靶向治疗的参与可明显提高进展期和晚期癌症的总生存期和无进展生存期[4]。近年来,大量治疗乳腺癌的化疗药物问世,然而不幸的是绝大多数乳腺癌的患者最终往往对化疗药物耐受,从而导致治疗失败甚至死亡。一类靶定乳腺癌细胞特异性分子缺陷的药物可以使乳腺癌患者获益,其中曲妥珠单抗和拉帕替尼治疗HER-2过表达的乳腺癌[5]以及依维莫司联合内分泌治疗对抗激素受体阳性的转移性乳腺癌[6]是这类靶向药物的代表。尽管如此,根据美国癌症协会2014年的统计分析,乳腺癌仍为女性肿瘤的第二大死因,仅次于肺癌。因此,迫切需要研发高效而低毒的新药或辅助药。
三萜系化合物是来自植物提取物的传统中药的重要成分,同时三萜系化合物单体及其合成性衍生物已被广泛应用于生物医学科学[7]。齐墩果酸(OA),在植物系中经常出现的三萜系化合物之一,具有多种药理学作用,如保肝、抗炎、抗HIV、降血糖及抗氧化作用[8]。近来的研究表明,OA可抑制多种肿瘤细胞增殖,包括肝细胞癌[9]、非小细胞肺癌[10]、黑色素瘤[11]、骨肉瘤[12]、乳腺癌[13]、结肠癌[14]与白血病[15]。
然而,作为一种具有潜在抗癌活性的天然产物,其相对较弱的活性、低生物利用度及低效能限制了它的科研进展和临床应用。此外,OA及其衍生物抗癌活性的确切机制仍然不清楚。
在本研究中,我们合成了新的OA衍生物—SZC014,且进一步证明SZC014在乳腺癌细胞(MCF-7、MDA-MB-435、MDA-MB-231)中显示出较OA更强的细胞生长抑制作用,而这种抗肿瘤活性可能与其诱导凋亡及自噬相关。
1 材料与方法
1.1 试剂与仪器
所有的试剂与化学药品均经正规商业来源获得,且应用时没有进一步纯化。其中实验仪器包括:CyFlow Counter流式细胞术系统(德国Partec公司)、200kV场发射透射电子显微镜(日本电子株式会社)、SpectraMax M2全波长酶标仪(美国美敦力公司)、伯乐bio-rad-蛋白印迹(伯乐生命医学产品上海有限公司)。corning 6、24、96孔板、离心管(1.5 mL、2 mL、4 mL、10 mL、50 mL)、细胞培养瓶(贴壁、悬浮)、塑料试管、移液管(美国Corning康宁有限公司)。实验试剂包括:DMEM细胞培养液、胰酶、PBS、pro-caspase 9一抗、pro-caspase 3一抗、cleaved-caspase 9一抗、cleaved-caspase 3一抗、Bax一抗、Bcl-2一抗、Cyto-c一抗、actin一抗、Beclin一抗、ATG 5一抗、二抗。
1.2 药物合成
1.2.1 3-oxo-OA的合成
3-oxo-OA(3-oxo-olean-12-en-28-oic acid)的合成,OA(2.0 g, 4.4 mmol)溶于100 mL二氯甲烷与丙酮的混合溶剂中(体积比1∶1),而后冷却至0℃。将Jones 试剂(2.0 mL)于30 min内逐滴加入溶液中,而后搅拌30 min,再加入异丙醇(2 mL)。10 min后,过滤混合液,滤液在低压中蒸发,析出固体物,而后将其溶于50 mL的乙酸乙酯中并用饱和盐水冲洗(50 mL×3)。有机相以玄明粉干燥并真空收集。制成的粗制品用经石油醚/乙基乙酸盐(体积比20:1)洗脱的硅胶柱色谱法纯化以获得白色固体状3-oxo-OA(1.97 g, 产出率98.2%)。
1.2.2 SZC014的合成
SZC014[2-(Pyrrolidine -1-yl)methyl-3-oxo-olean- 12-en-28-oic acid]的合成,将吡咯烷盐酸盐(1.08 g, 10.0 mmol)、SnCl2(0.38 g,2.0 mmol)与低聚甲醛(0.3 g) 加入含3-oxo-OA(0.91 g, 2.0 mmol)的40 mL乙醇溶液中。将反应混合物反流加热20 h,而后过滤。滤液在低压下收集并干燥。将得到 的残余固体物溶解于200 mL的乙酸乙酯中并以饱和盐水冲洗(50 mL×3)。有机层以玄明粉干燥并真空收集。制成的粗制品用经氯仿/乙醇/水(体积比15∶1∶0.1)洗脱的硅胶柱色谱法纯化以获得白黄色固体化合物SZC014(0.24 g, 产出率22.3%)。
1.3 细胞培养
人乳腺癌细胞系MCF-7、MDA-MB-435、MDA-MB-231(日本熊本大学)在37°C、5% CO2条件下培养于添加10%胎牛血清(FBS)和1%抗生素的RPMI-1640培养基中。
1.4 MTT法测定细胞存活率
为测定细胞存活率,MCF-7、MDA-MB-435及MDA-MB-231细胞在37°C条件下,以1×105/孔的密度培养于96孔板中12 h,而后设置空白对照组(0 μmol/L)及不同浓度的OA及其衍生物组(10,20,40,80 μmol/L)。在37℃下与待测复合物共培养3、6、12及24 h后,每孔加入15 μL的MTT溶液(5 mg/mL)。而后将形成的结晶溶于100 μL的Triple溶液(10%SDS、5%异丁醇及0.01 mol/L HCl)中。应用酶标仪(Multiskan MK3;Pioneer Co;China)在570 nm处测定吸光度。3次重复实验后,每个治疗组的细胞存活率以相比于对照组的百分率表示。
1.5 PI染色进行细胞周期分析
MCF-7细胞(60%~70%)同步进行过夜血清饥饿处理后用SZC014 (0,10,20,30 μmol/L)在RPMI-1640 完全培养基上培养24 h。然后将细胞用胰蛋白消化,用冷的磷酸盐缓冲液(PBS)洗涤并以1 000 r/min离心5 min。细胞用70%冷乙醇(1 000 μL)固定,4℃过夜,然后黑暗条件下培养于包含50 μg/mL碘化丙啶 (PI)和20 μg/mL RNase A 的细胞周期与凋亡分析液中30 min。用流式细胞仪(BD FACSAria II; BD Co; America)进行细胞周期分析,每个样本分析10 000次。
1.6 倒置相差显微镜下的形态学观察
MCF-7细胞培养于24孔板中并用浓度为20 μmol/L的SZC014处理0、6、12 和 24 h。然后在倒置相差显微镜下观察细胞形态学变化。
1.7 透射电子显微镜下细胞超微结构的观察
经SZC014处理的MCF-7细胞被胰酶消化,洗涤,离心并以2.5%的戊二醛固定,4℃过夜。随后,细胞用锇四氧化物处理30 min进行后固定,再用以10%为梯度的50%~100%的乙醇进行脱水,嵌入环氧树脂812中进行树脂化。然后使用超薄切片机(LKB-V; JEOL Co; Japan)制作超薄切片,用乙酸双氧铀和柠檬酸铅进行染色,最后使用透射电子显微镜(JEM-2000EX; JEOL Co; Japan)进行观察。
1.8 细胞质和核蛋白提取物的准备
MCF-7细胞经不同浓度的SZC014处理后,用核-质提取物试剂盒提取核碎片和胞质中的蛋白质。细胞经胰蛋白酶处理,PBS洗涤并用200 μL缓冲液A(10 mmol/L Hepes 7.5, 10 mmol/L KCl, 1.5 mmol/L MgCl2,0.5 mmol/L DTT, 1 mmol/L NaF, 1 mmol/L甘油磷酸和1蛋白酶抑制剂)重悬。冰浴20 min后,在悬浮液中加入22 μL缓冲液B(0.15% of Nonidet P-40)。等待1 min,以16 000 r/min离心细胞5 min后上清液中即为细胞质蛋白提取物。然后,沉淀以100 μL悬浮液C (20 mmol/L Hepes 7.5, 420 mmol/L NaCl, 1.5 mmol/L MgCl2, 0.5 mmol/L DTT, 1mmol/L NaF, 1 mmol/L甘油磷酸和1蛋白酶抑制剂)重。冰浴30 min后,以16 000 r/min离心10 min后上清液即为细胞核蛋白提取物。
1.9 Western blot检测
取胞质蛋白和核蛋白样本(30 μg蛋白/样本)加入到预制的12%的SDS聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,随后将蛋白质从凝胶转到PVDF膜上。封闭,并加入一抗4℃孵育过夜,PBS充分洗涤后,加入HRP标记的二抗,室温孵育1 h,PBS洗膜显影,用化学发光法检测标本膜上的信号。
1.10 统计分析
2 结果
2.1 SZC014抑制乳腺癌细胞(MCF-7、MDA-MB-435及MDA-MB-231)生长
为了评估SZC014的抗癌效果,我们选用三种乳腺癌细胞系(MCF-7、MDA-MB-435及MDA-MB-231),分别予以不同浓度的SZC014(0,10,20,40,80 μmol/L),并分别处理0,3,6,12,24 h,MTT比色法检测细胞存活率。结果显示SZC014时间及剂量依赖地抑制乳腺癌细胞(MCF-7、MDA-MB-435及MDA-MB-231)的生长(图1)。SZC014处理乳腺癌细胞MCF-7、MDA-MB-435及MDA-MB-231 24 h后,其IC50分别为24.51,28.85和30.03 μmol/L。作为对照,我们同样用MTT法检测OA对于乳腺癌细胞(MCF-7、MDA-MB-435及MDA-MB-231)的生长抑制作用,结果显示MCF-7、MDA-MB-435及MDA-MB-231经OA处理24 h,后其IC50分别为120.405,130.065及125.305 μmol/L。结果表明,SZC014可抑制乳腺癌细胞生长,且生长抑制作用强于OA(图1)。
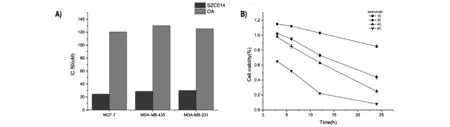
注:对照组与实验组(n=3)的细胞存活率以百分率表示。数值以表示,*P<0.05,**P<0.01。(A)SZC014处理MCF-7、MDA-MB-435及MDA-MB-231 细胞24 h后测得IC50分别为24.51, 28.85和 30.03 μmol/L;相应地,OA处理24 h测得IC50分别为120.405, 130.065及125.305μmol/L。(B)表明SZC014剂量及时间依赖地抑制MCF-7细胞的生长图1 SZC014抑制乳腺癌细胞生长
2.2 SZC014促进MCF-7细胞凋亡
为了研究细胞凋亡是否参与SZC014对乳腺癌细胞的生长抑制作用,我们采用20 μmol/L SZC014处理MCF-7细胞0、6、12和24 h,后使用光学显微镜观察其细胞的形态学变化。结果显示,SZC014处理过的实验组细胞形态学改变包括变圆、皱缩、变形及漂浮,而空白对照组中则未观察到上述变化(图2)。此外,对于20 μmol/L SZC014处理0、6、12和24 h后的,使用透射电子显微镜观察细胞的超微结构。结果显示,对空白照组细胞形态正常,细胞核为圆形并位于细胞中央,细胞器形态正常和且有丰富的微绒毛(图2)。而经SZC014处理过的实验组细胞则出现了显著的凋亡改变,比如微绒毛的丢失(图2),内质网的膨胀,染色质的凝集,染色质边缘化等。
2.3 SZC014诱导MCF-7细胞G2-M期停滞
为了评估SZC014对细胞周期的影响,我们使用PI单染的流式细胞术检测发现,随SZC014浓度的提高,G0/G1期细胞的比例出现了显著的下降(74.68%~43.49%),G2期细胞的比例出现显著的增加(3.84%~20.84%),而S期细胞的比例也出现改变(21.48%~35.67%)。与空白对照组相比,实验组G2/M期细胞的比例增加了17%,这表明了SZC014可能诱导 MCF-7细胞G2/M期停滞(图3)。

注:MCF-7细胞用SZC014(20 μmol/L)处理0,6,12,24 h,并观察细胞形态学变化及超微结构变化;(A)倒置相差显微镜显示,对照组及实验组细胞形态学变化;(B)投射电子显微镜显示,对照组及实验组细胞超微结构的变化图2 SZC014诱导MCF-7细胞凋亡
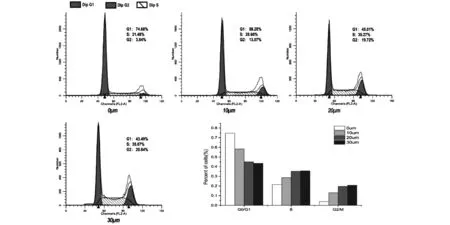
注:将细胞用SZC014(0,10,20,30 μmol/L)处理,用以流式细胞计数为基础的PI法测定细胞周期分布。细胞周期分布以相比于对照组的百分率表示。数据显示随着SZC014浓度的增加,G1期细胞百分比明显减少,G2期细胞百分比显著增加,而S期细胞百分比亦升高图3 SZC014诱导MCF-7细胞G2-M期阻滞
2.4 SZC014通过线粒体途径诱导MCF-7细胞凋亡
作为典型的细胞凋亡的重要标志,caspases出现并需要在特定的位点裂解开来以显示活性。为了检验caspases是否与SZC014诱导的凋亡相关,我们检测了经SZC014处理过的 MCF-7细胞中caspases蛋白水平。数据表明在SZC014处理过的MCF-7细胞中pro-caspase 3和pro-caspase 9蛋白水平随时间增长而下降;相对应地,cleaved-caspase 3和cleaved-caspase 9蛋白水平随时间增长呈现出先上升后下降的趋势(图4)。此外,cyto-c蛋白水平随时间增长先上升后下降,表明SZC014可诱导MCF-7细胞中cyto-c的释放。更进一步,我们检测到SZC014处理的MCF-7细胞Bcl-2蛋白水平下降,而Bax蛋白水平升高。从而使得Bax/Bcl-2比值出现显著的增加,进一步促进了细胞的凋亡(图4)。综上所述,SZC014可能通过线粒体途径诱导MCF-7细胞凋亡。
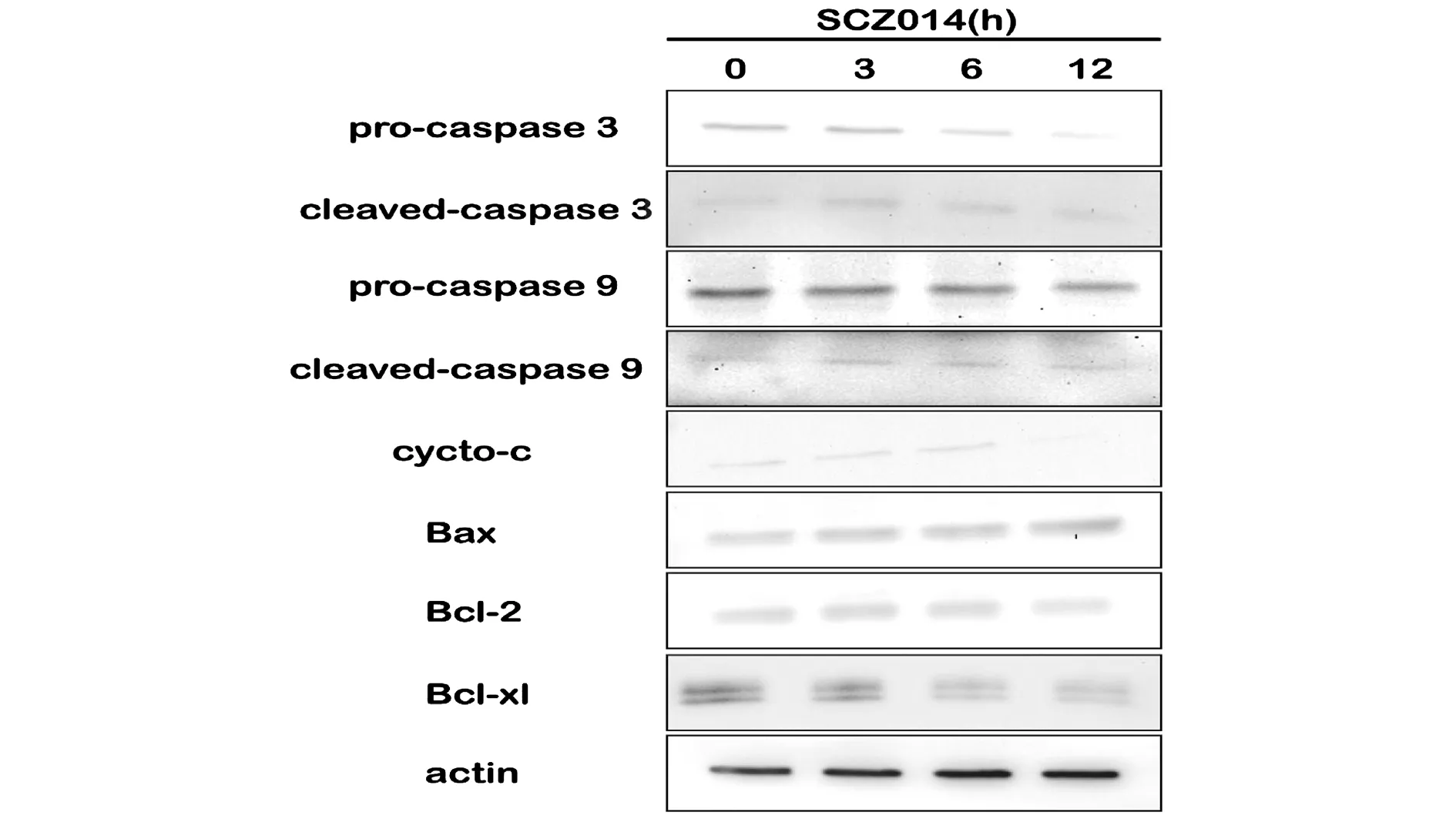
注:SZC014(20 μmol/L,处理MCF-7细胞0,3,6,12 h,提取总蛋白并用Western blot分析相关蛋白的表达。以actin蛋白作为内参。数据显示在SZC014处理的MCF-7细胞中,pro-caspase3、pro-caspase9、Bcl-2和Bcl-xl表达降低,而cleaved-caspase 3、cleaved-caspase 9、cycto-c和Bax表达升高图4 SZC014诱导MCF-7细胞中线粒体途径 凋亡相关蛋白表达的改变
2.5 SZC014诱导MCF-7细胞自噬
考虑到自噬在调节肿瘤细胞生存和死亡信号通路中的重要作用,我们进一步探究SZC014是否能引起MCF-7细胞的自噬反应。电子显微镜仍是观察细胞自噬的最精确的手段之一。我们用透射电子显微镜观察典型的自噬改变,即自噬小体。空白对照组细胞的超微结构依然保持正常,比如细胞膜、核膜和粗面内质网保持完整,核仁清晰,胞质均匀;而20 μmol/L的 SZC014处理12、24 h后的MCF-7细胞中出现了明显的自噬性改变,即包含细胞质或细胞器的致密体(图5)。此外,我们还检测不同浓度SZC014下两种自噬相关蛋白,beclin 1和ATG 5的变化。结果表明SZC014能够时间依赖地增加beclin 1和ATG 5的表达(图5)。所有这些结果表明自噬可能参与SZC014对MCF-7细胞的生长抑制作用。

注:将细胞用SZC014(20 μmol/L)处理0,12 h,在TEM下观察典型的自噬改变。并应用Western blot提取和分析自噬相关蛋白表达的改变。(A)透射电子显微镜显示,SZC014处理12 h后,MCF-7细胞出现典型的自噬改变,即自噬小体。(B)SZC014处理后,beclin 1和ATG 5的表达升高,表明beclin和ATG 5可能参与了SZC014诱导的自噬图5 SZC014诱导MCF-7细胞自噬
3 讨论
由于OA水溶性差,那么对于它的结构改造成为了提高其水溶性就一个重要策略。因此,Huang等人[16]通过Jones氧化反应,合成了OA的三氧化衍生物(3-oxo-OA),并且探究其抗癌活性。与OA相比,3-oxo-OA对于在体外培养的不同组织癌细胞的生长有重要的抑制作用,并对体内肿瘤细胞有抑制作用的同时,对正常细胞的毒性较小。另一个改造OA的成功例子是CDDO (2-cyano-3,12-dioxo-olean-1,9-dien- 28-oic acid)[17],它对于鼠巨噬细胞中由IFN-γ 诱导所产生的NO有强烈的抑制作用(IC50,0.4 nM)。此外,已经证明CDDO甲酯(CDDO-Me)在了人类非小细胞肺癌中,通过细胞色素C触发的caspase激活通路来诱导凋亡,IC50值从0.1到0.3 mol/L不等[18]。另外有研究指出在蕈样肉芽肿病(MF)和Sézary综合症细胞系以及自Sézary综合症病人新鲜提取的外周血淋巴细胞中,与空白对照组相比,1~5 mol/L CDDO作用48 h引起剂量依赖性的凋亡[19]。本研究中,为了提高OA的水溶性和抗癌活性,我们合成了新的OA衍生物,SZC014[2-(Pyrrolidine -1-yl) methyl-3-oxo-olean- 12-en-28-oic acid]。
另外,我们证明了SZC014以剂量依赖性的方式抑制三种乳腺癌细胞的生长,并且其生长抑制作用强于OA,表明了SZC014可能是潜在的抗乳腺癌药物。SZC014的药理活性是否比得上其他OA衍生物如CDDO(CDDO-Me)和3-oxo-OA,需要进一步证明。流式细胞术揭示了SZC014显著地将MCF-7细胞阻滞在G2/M期,表明了周期阻滞可能是SZC014抑制MCF-7细胞生长的机制之一。目前已知, 细胞周期停滞可发生在G1/G0期,S期以及G2/M期3个时相。在细胞受到 DNA 损伤后, p53的激活常会导致G1/G0期停滞, 而缺乏p53时则多引起G2/M期停滞。本文中SZC014诱导MCF-7细胞G2/M期周期阻滞,从而进一步诱导细胞生长抑制,可能与MCF-7细胞中P53缺乏相关。
已经有报道称,OA在乳腺癌MCF-7和MDA-MB-231细胞,胰腺癌Panc-28细胞,前列腺癌PC-3细胞和SH-SY5Y神经胶质瘤细胞中诱导细胞凋亡[20-22]。本研究证明,SZC014可诱导MCF-7细胞凋亡,在这个过程中,电镜下观察到了典型的凋亡特点如染色质固缩,核片段化,染色质边缘化等。为了探究SZC014诱导凋亡的机制,我们用Western blot检测了凋亡相关蛋白的表达,研究结果表明SZC014可能通过线粒体途径诱导MCF-7细胞凋亡。
该研究的另一个新颖有趣的发现是SZC014在MCF-7细胞中诱导自噬。自噬是一种渐进的,保守的溶酶体降解过程,在大量的疾病尤其是癌症中,自噬对于调节促存活和促死亡的信号通路中发挥重要作用。一些关键的自噬介质,包括Beclin1,ATGs,mTOR,ROS,已经被证明在癌症细胞中的复杂的自噬网中发挥重要作用[23]。已经发现在一些抗癌药物的作用下可以发现自噬现象,如雷帕霉素,白藜芦醇和他莫西芬[24-26],这说明自噬可能是一种潜在的抗癌机制。我们的研究发现20μmol/L的SZC014作用12、24 h后的MCF-7细胞中,电镜可观察到典型的自噬改变,即自噬小体。另外,SZC104时间依赖地增加了Beclin 1和ATG 5的表达,这说明了Beclin 1和ATG 5可能参与SZC014诱导的自噬。这些结果都说明了SZC014可诱导MCF-7细胞自噬,它可能是一种潜在的抗癌方式。另外,尽管我们发现SZC014诱导MCF-7细胞发生凋亡和自噬,但两者的关系仍不清楚。一些研究表明OA会影响Akt,mTOR,ERK,JNK的磷酸化形式的表达,它们在凋亡中发挥重要作用。与此同时,近年来,有大量研究报道称,这些信号转导通路在自噬中也发挥作用。因此,在MCF-7细胞中,OA可能通过调节这些信号通路来诱导凋亡和自噬。特殊信号转导通路的调节和时间上的先后顺序则需要进一步研究。
综上,本研究可以总结如下:我们合成新的OA衍生物SZC014,并证明SZC014抑制乳腺癌细胞增殖,比OA的药理活性更强。SZC014可诱导MCF-7细胞周期停滞在G2/M期。此外,SZC014还诱导MCF-7细胞发生凋亡及自噬。表明SZC014可能是一种新的、有潜力的抗乳腺癌药物。
