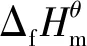溶解法测定纳米AgCl 的热力学函数
2019-08-272
2
(1.广西民族大学化学化工学院, 广西南宁530008; 2.广西高校食品安全与药物分析化学重点实验室, 广西南宁530008)
0 引言
纳米科学技术为解决传统科学技术无法解决或难以解决的问题提供了广阔的空间和机会。近年来,纳米材料在光学、磁学、催化领域取得了重要的进展,为经济和社会发展作出了重大的贡献[1-3]。纳米材料的热力学性质实质是纳米材料微观原子排布、电子结构及几何结构的综合体现[4]。已有研究表明纳米材料的热力学性质与其形貌结构密切相关[5],极大影响其吸附、传感、催化、溶解、分解等诸多性能。张娟等[6]研究了不同形貌和粒径CeO2对甲基橙和盐基品红的吸附热力学均有显著的影响;Hu等[7]合成了Co3O4纳米片,纳米带和纳米块体,利用氢氧化钴前驱体的水热过程和随后的直接热分解。主要暴露的平面分别是{112},{011}和{001},催化甲烷燃烧活性顺序为{112}>{011}≫{001};肖立柏[8]研究了不同平均粒径的纳米碳酸钙和纳米草酸钙对热分解反应热力学性质的影响。在纳米尺度下选择性合成具有均匀和不同活性晶面的化合物,有望为设计、调整和控制化学活性、特异性和选择性提供新的机会。因此,研究纳米材料的热力学性质,对于进一步分析纳米结构的吸附与催化性能及其结构之间的关系具有重要的科学意义。然而,目前对于纳米材料的研究主要聚焦于对纳米材料的尺寸、形貌的精准调控和催化性能的优化等,对纳米材料热力学函数及随温度的变化规律的研究仍不深入。
Gibbs自由能是一个重要的物理化学参数,对其研究也比较多,例如杨氏方程接触角法[9],该方法假设纳米材料的接触面光滑平整,但纳米材料因其独特结构不可避免的吸附空气中气体分子,传统测定块体材料的方法已经不适用于纳米系统,实际系统也难以满足杨氏方程的使用条件;如Douillard等[10]用经典吸附测量和van Oss理论相结合,测定矿物表面吉布斯自由能;Broughton等[11]通过模拟晶体—液体界面的过剩表面自由能直接计算研究晶体流体界面的分子动力学;Van De Walle等[12]通过对氢化GaN表面的研究,发现相关的重建Gibbs自由能强烈依赖于温度和压力,认为该方法具有在真实生长条件下解释和预测表面能量和结构特性的能力。以上常用的测定方法多为理论研究,而溶解度法[13-14]采用的是实验的方法,使其拥有操作简单,精度高的特点。
纳米AgCl 在照相化学、光催化、生物杀菌等领域具有广泛的应用。Abbasi等[15]在超声辐照下,通过AgNO3和KCl反应制备了AgCl的纳米结构,发现纳米颗粒的粒度和形态取决于温度和反应时间,他们也研究了这些参数对纳米结构生长和形貌的影响。庄元其等[16]研究了部分照相增感染料,在氯化银上的吸附和光谱增感作用;曹亮等[17]研究了纳米氯化银光催化降解亚甲基蓝(MB)的性能,发现纳米粉体氯化银对MB的催化效率优于胶体氯化银,且两者的动力学模型存在差异;郑允权等[18]的研究表明氯化银纳米粒子结构和抑菌性具良好的稳定性,对大肠杆菌、金黄色葡萄球菌和绿脓杆菌的抑菌率均可达到99.99 %。因此,以纳米AgCl为研究对象,采用溶解热力学方法与理论,研究难溶盐类纳米材料的热力学函数存在一定意义。
本文以室温下采用微乳液法控制合成的纳米AgCl为研究对象,通过高精度、高灵敏度电导率仪测定了288.15~328.15 K五个温度下的平衡电导率,计算了纳米AgCl的标准摩尔平衡常数、摩尔表面热力学函数、偏摩尔表面热力学函数和规定热力学函数,并研究了Gibbs自由能热力学函数随温度的变化关系。
1 实验部分
试剂:AgNO3,NaCl,C19H42BrN,CH3COCH3,C2H6O,块体AgCl均为分析纯,使用前未进一步纯化。
仪器:场发射扫描电子显微镜(SEM)、X射线粉末衍射仪(XRD)和电导率仪。
AgCl 纳米颗粒(nano AgCl)的制备见参考文献[19];电导率的测定:校准电导率仪后,测定不同温度下的AgCl的饱和溶液电导率,平行实验3次,取平均值。
2 结果与讨论
2.1 产物表征
通过扫描电子显微镜(SEM),X射线粉末衍射仪(XRD)表征产物的形态和组成(图1)。结果表明,纳米AgCl与决明子相似,粒径主要分布在32.5~42.5 nm,说明该产物具有良好的结晶度和均匀的粒径分布。在2θ=27.8°,32.2°,46.2°,54.8°,57.5°,67.5°,74.5°,76.8°的XRD衍射峰分别对应于标准AgCl的(111),(200),(220),(311),(222),(400),(331),(420)面,与标准卡片AgCl(JPCDS卡片NO.31-1238)对应,表明合成的AgCl粒子为立方面心结构。

(a) 纳米AgCl的SEM(b) 纳米AgCl的粒径分布(c) 纳米AgCl的XRD
2.2 热力学函数
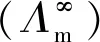

表1 纳米AgCl和块体AgCl溶解平衡浓度Tab.1 Concentration of nano and bulk AgCl
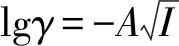

表2 AgCl溶解平衡常数Tab.2 Solution equilibrium constant of AgCl
由热力学基本公式ΔGm=-RTlnKC可计算反应平衡时,纳米AgCl和块体AgCl的溶解吉布斯自由能(ΔGm)。在不同温度下纳米AgCl与块体AgCl溶解吉布斯自由能比较见图2,由图2可以直观地看出,块体AgCl的ΔGm在任意温度下均大于纳米AgCl的ΔGm,说明纳米材料相对于块体材料更容易溶解;随着温度的升高,纳米AgCl和块体AgCl的ΔGm均增大,并且在相同的温度区间(10 K)内(ΔGm2-ΔGm1)的差值变小,结果表明,当达到一定温度时,自发反应的速率可能会接近某个极限值。
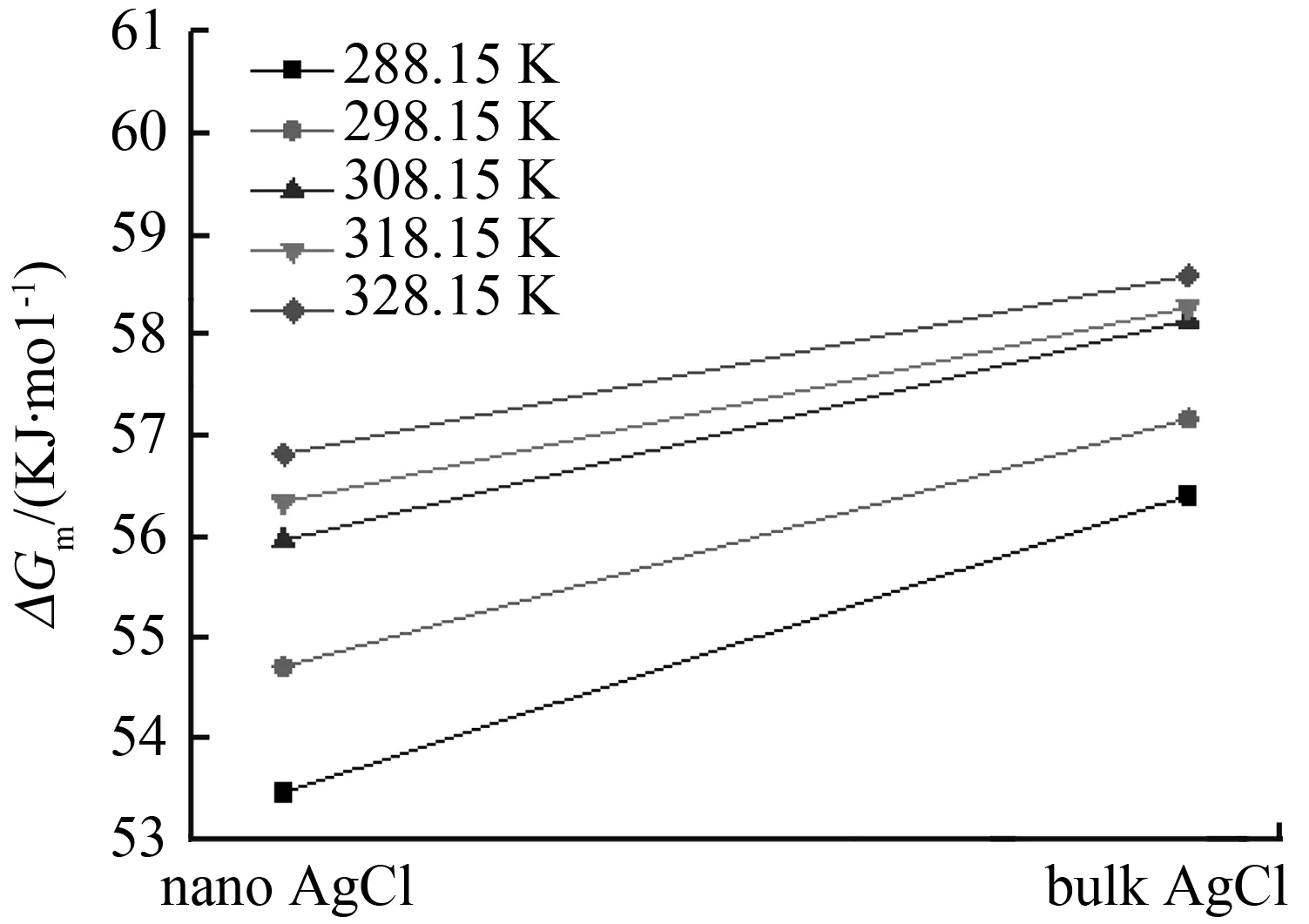
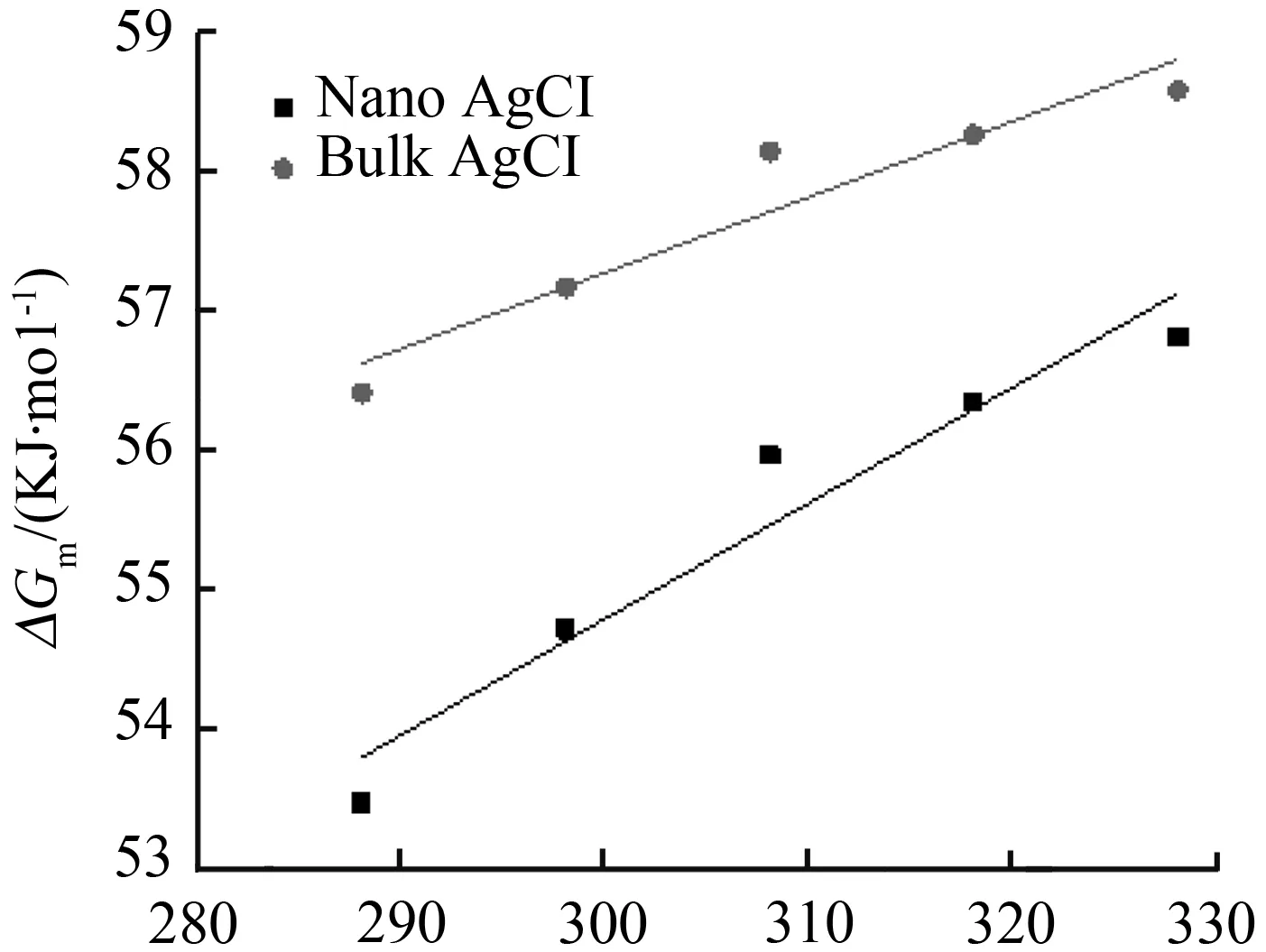
图2 不同温度下块体AgCl和纳米AgCl溶解吉布斯自由能
Fig.2 Gibbs free energy for dissolution of bulk and nano-sized AgCl at different temperatures
ΔGm与温度的线性关系较好,根据公式ΔGm=ΔHm-TΔSm,可以计算出常温下(298.15 K)时纳米AgCl和块体AgCl的溶解焓(ΔHm)分别为32.11 kJ/mol和39.89 kJ/mol;溶解熵(ΔSm)分别为-75.52 J/(mol·K)和-57.61 J/(mol·K)[14](图3)。
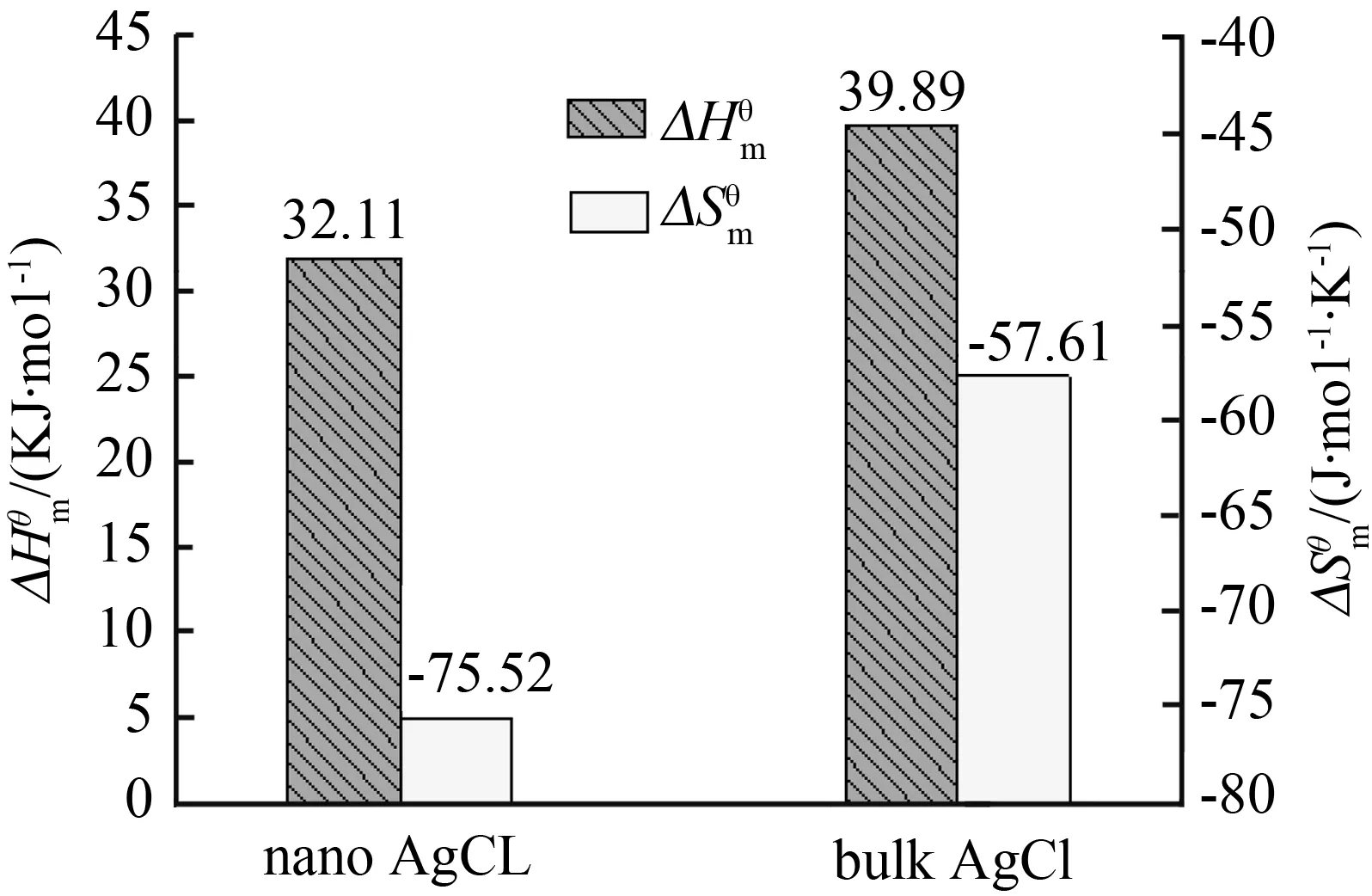
图3 块体AgCl和纳米AgCl 在298.15 K 时的溶解焓(ΔHm)和溶解熵(ΔSm)Fig.3 Enthalpy of solution (ΔHm) and solution entropy (ΔSm) of bulk and nano-AgCl at 298.15 K

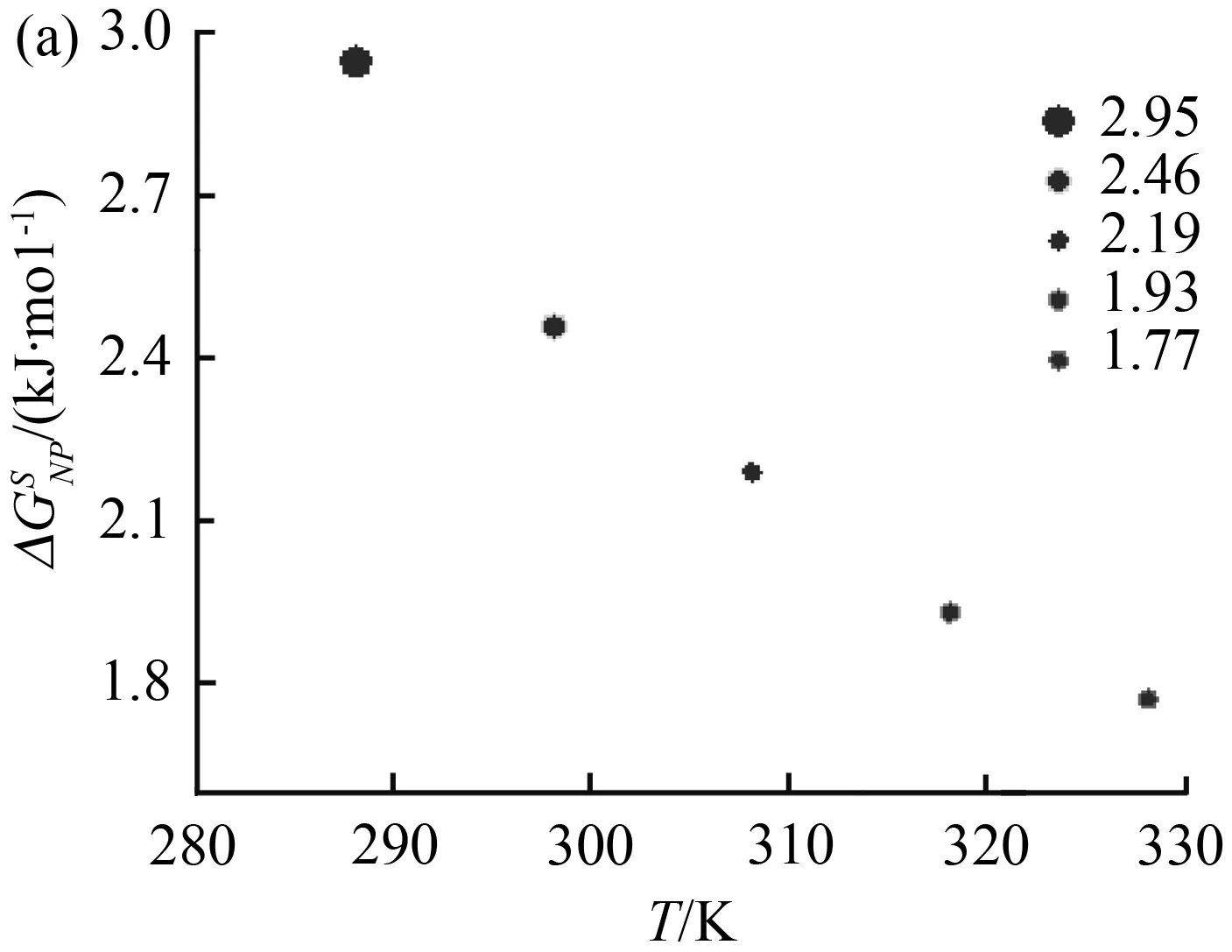
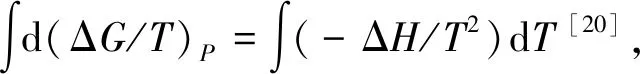

图5 块体和纳米AgCl的规定热力学函数Fig.5 Defined thermodynamic functions of bulk and nano-AgCl
3 结论