QuEChERS-气相色谱质谱联用法测定辣椒中的咪鲜胺及2,4,6-三氯苯酚残留量
2019-08-27张彦军洪霞钱滢文王克辉熊敏晖王燕娇马燕尚欣春
张彦军,洪霞,钱滢文,*,王克辉,熊敏晖,王燕娇,马燕,尚欣春
(1.甘肃省商业科技研究所有限公司,甘肃 兰州 730010;2.甘肃中商食品质量检验检测有限公司,甘肃 兰州 730010)
辣椒是世界上仅次于豆类、番茄的第三大蔬菜作物,在我国种植规模大、产品类别多样、市场需求高,是我国最大的蔬菜产业。辣椒中含有丰富的辣椒红素、辣椒素、维生素、矿物质等,具有很高的保健功能和营养价值,有抗菌消炎、抗氧化、降低胆固醇、溶解血栓等方面的功效能增,为重要的蔬菜和调味品[1-2]。
咪鲜胺是一种咪唑类广谱高效杀菌剂,其作用机理主要通过抑制麦角甾醇的生物合成,破坏细胞膜结构功能,从而达到杀菌目的,对辣椒枯萎病菌引起病害具有很好的保护和治疗作用,用于防治辣椒的枯萎病[3-4]。咪鲜胺在环境中首先降解为N-丙基-N-[2-(2,4,6-trichlorophenol,2,4,6-三氯苯氧基)乙基]脲(BTS44595)和 N-醛基-N-丙基-N-[2-(2,4,6-三氯苯氧基)乙基]脲(BTS44596),后降解为 BTS45186[5-6],即 2,4,6-三氯苯酚(2,4,6-TCP)。根据国内外研究咪鲜胺的毒性[7],咪鲜胺毒性较低,在推荐使用剂量范围内,其对哺乳动物的致突变作用、致癌作用以及致畸作用的危害较小。但2,4,6-TCP 作为咪鲜胺的最终降解物,已经被确定为我国水体中的优先污染物,是一种具有毒性、致突变性和致癌性的环境污染物,会对人类的健康造成潜在威胁[8],其残留问题受到越来越多的关注。
国内外对于咪鲜胺和2,4,6-TCP 检测的前处理,样品提取液在210 ℃~240 ℃条件下与吡啶盐酸盐发生水解反应,将咪鲜胺及其代谢物全部转化为2,4,6-TCP,经石油醚提取后采用磺化法净化,检测2,4,6-TCP 的含量[9-11]。该方法操作复杂费时,且吡啶盐酸盐毒性较大,对试验人员的健康和环境安全造成威胁。QuEChERS(quick、easy、cheap、effective、rugged、safe)为这一问题提供了新的解决途径,该方法利用N-丙基乙二胺(primary secondary amine,PSA)去除组份中的色素和油脂,以无水硫酸镁去除水分,适用于辣椒中咪鲜胺和2,4,6-TCP 农药残留的提取和净化,是一种快速、简单、便宜、可靠和安全的样品前处理方法[12]。目前,对咪鲜胺和2,4,6-TCP 的检测方法有气相色谱法(gas chromatography,GC)[13],液相色谱法(lliquid chromatography,LC)[14],气相色谱-质谱联用法(gas chromatogarphy-mass spectrometry,GC-MS)[15],液相色谱-质谱联用法(liquid chromatography-mass spectrometry,LC-MS)[16-17]等,主要涉及到样品有水果[18]、谷物[19]、油料作物[20]、中药材[21]和土壤[22]等,而对辣椒中咪鲜胺和2,4,6-TCP 残留的研究尚无报道。
本文建立了QuEChERS-气相色谱-质谱连用测定辣椒中咪鲜胺和2,4,6-TCP 残留的方法,具有对咪鲜胺和2,4,6-TCP 精密度好、准确度高、溶剂使用量少、样品制备过程简单和分析成本廉价的优点。能够对低浓度的咪鲜胺和2,4,6-TCP 进行定性与定量分析,填补了辣椒中咪鲜胺和2,4,6-TCP 残留检测研究中的空白。
1 材料与方法
1.1 材料与试剂
无水硫酸镁(分析纯,使用前650 ℃下灼烧4 h,备用):天津市凯信化学工业有限公司;乙酸钠(分析纯):天津市光复精细化工研究院;PSA:天津博纳艾杰尔科技有限公司;冰乙酸(分析纯):国药集团化学试剂有限公司;甲醇、乙腈(色谱纯):北京百灵威科技有限公司;甲醇中咪鲜胺溶液标准物质(25165XM,纯度98.4%,浓度为 100 μg/mL)、甲醇中 2,4,6-TCP 溶液标准物质(26233XM,纯度 99.5 %,浓度为 100 μg/mL):北京振翔科技有限公司。
1.2 仪器与设备
7890A-5975C 气相色谱-质谱联用仪:美国安捷伦科技有限公司;VORTEX genius3 涡旋混合器:艾卡(广州)仪器设备有限公司;RJ-TDL-60B 离心机:无锡市瑞江分析仪器有限公司;JJ500 电子天平:常熟市双杰测试仪器厂。
1.3 条件
1.3.1 气相色谱条件
DB-1701 石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度260℃;升温程序:初始温度60℃保持1 min,以 10 ℃/min 升至 280 ℃,保持 10 min;进样量 1.0 μL,不分流进样。
1.3.2 质谱条件
EI 电离源,电离电压70 eV;离子源温度280 ℃;传输线温度280 ℃;溶剂延迟:5 min;咪鲜胺选择监测离子:定量离子 m/z 180;定性离子 m/z 308、266。2,4,6-TCP 选择监测离子:定量离子 m/z 196;定性离子 m/z 198、132。
1.4 样品处理
称取10.00 g 样于50 mL 离心管,加10 mL 乙腈-乙酸(99 ∶1,体积比),摇匀,加 3.0 g 无水硫酸镁,1.0 g乙酸钠,涡旋1 min,4 000 r/min 离心5 min。取上清液5 mL 于15 mL 离心管,加1.0 g 无水硫酸镁PSA量(3 ∶1,质量比),涡旋 1 min,4 000 r/min 离心 5 min,取1 mL 上清液过膜,待测。
1.5 标准溶液的配制
分别准确移取 1 mL 100 μg/mL 的咪鲜胺和2,4,6-TCP 标准品溶液至10 mL 容量瓶中,用甲醇定容,配成两种10.0 μg/mL 的标准储备液,分别吸取以上两种标准储备液适量,并用样品提取液稀释至质量浓度为0.01、0.02、0.05、0.1、0.2、0.5、1.0 μg/mL 系列混合标准溶液。
2 结果与分析
2.1 提取溶剂的选择
选用丙酮、乙腈、乙腈-乙酸作为提取溶剂进行比较。在辣椒中添加 0.1 μg/mL 咪鲜胺和 2,4,6-TCP 标准溶液测定其回收率见表1。
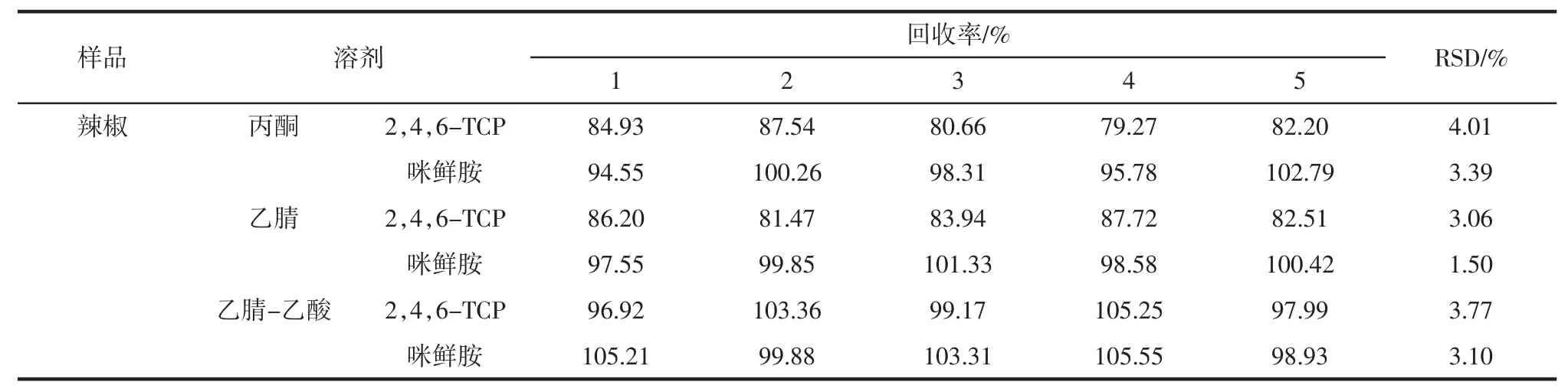
表1 辣椒中咪鲜胺和2,4,6-TCP 在0.1 μg/mL 添加水平下的回收率及其相对标准偏差(relative standard deviation,RSD)Table 1 Recoveries and the relative standard deviation(RSD)of prochloraz and 2,4,6-TCP at 0.1 μg/mL spiked in pepper
由表1可知,咪鲜胺在丙酮、乙腈、乙腈-乙酸中回收率在94.55%~105.55%之间,三者对咪鲜胺均有较好的提取效果。2,4,6-TCP 在丙酮和乙腈中回收率为79.27 %~87.72 %之间,在乙腈-乙酸中回收率为96.92%~105.25%,说明 2,4,6-TCP 在乙腈-乙酸提取效率比乙腈好。这是由于2,4,6-TCP 具有较强的极性和酸性,其羟基上的H+与环境中的Na+进行交换从而生成 2,4,6-三氯苯酚钠,而 2,4,6-三氯苯酚钠在水相中的溶解度大于在有机相中的溶解度,有机相无法对样品基质中的2,4,6-三氯苯酚钠进行有效提取,加入乙腈-乙酸,存在大量的H+,促进样品基质中2,4,6-三氯苯酚钠形成 2,4,6-TCP,从而提高提取效率,2,4,6-TCP 与 2,4,6-三氯苯酚钠的转化见图1。
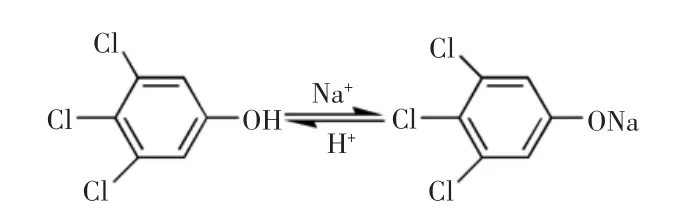
图1 2,4,6-TCP 与 2,4,6-三氯苯酚钠的转化Fig.1 The transformation of 2,4,6-TCP and 2,4,6-trichlorophenosodiumsalt
因此,本研究选择乙腈-乙酸作为咪鲜胺和2,4,6-TCP 的提取剂。
2.2 无水硫酸镁PSA用量的优化
本研究选用无水硫酸镁PSA 量净化提取液,PSA对多糖、肽类(包括氨基酸)和色素有强吸附作用,无水硫酸镁去除提取液中少量的水分,有助于加强PSA的净化效果。考察不同用量的无水硫酸镁PSA 量对净化效率的影响见表2,按1.4 过程在辣椒中添加0.10 μg/mL 咪鲜胺和 2,4,6-TCP 混合标准溶液,分别以 0.2、0.5、1.0、1.5、2.0 g 无水硫酸镁 PSA 量净化提取液,观察不同用量的无水硫酸镁PSA 对提取液的净化效果。试验结果显示,随3 ∶1 的无水硫酸镁PSA 用量增加对提取液净化效果越好。
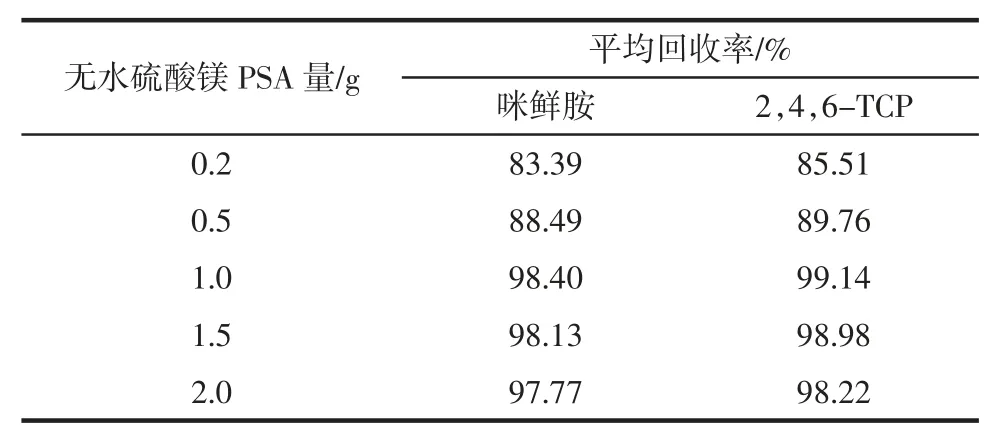
表2 辣椒中在0.10 μg/mL 添加水平下不同量3 ∶1 的无水硫酸镁PSA 对平均回收率的影响(n=5)Table 2 Effects of amount of anhydrous magnesium sulfate PSA(3 ∶1,m/m)on average recoveries of 0.10 μg/mL spiked in pepper(n=5)
由表2可知,当无水硫酸镁和PSA 的量达到1.0 g后2,4,6-TCP 和咪鲜胺回收率基本不变。综合净化效果和回收率,本研究选择1.0 g 无水硫酸镁PSA 量净化提取液。
2.3 线性范围和检出限
取1.4 配制的咪鲜胺和2,4,6-TCP 标准混合工作液,在最佳的试验条件下检测咪鲜胺和2,4,6-TCP,以进样质量浓度为横坐标、峰面积为纵坐标见图2。
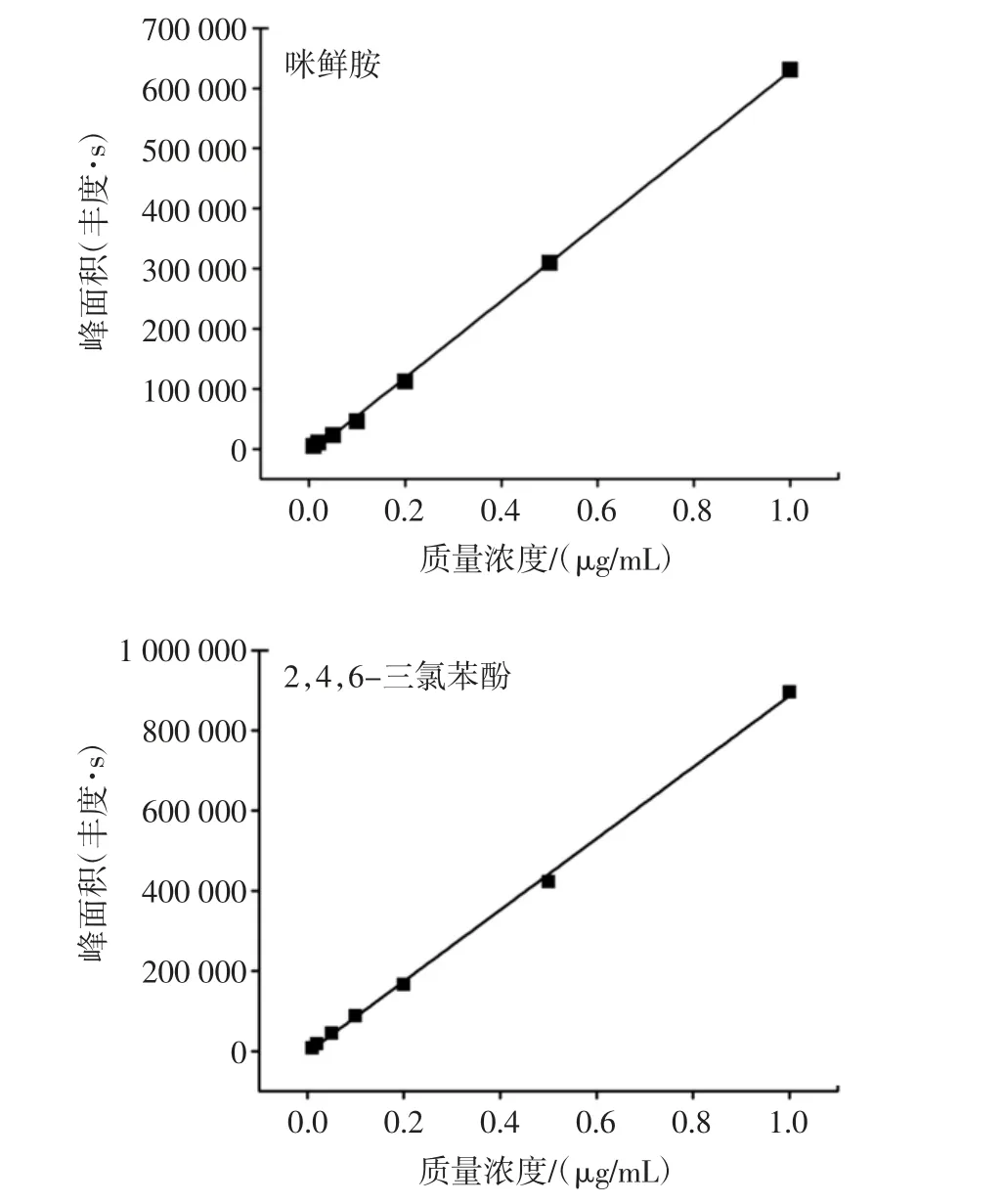
图2 咪鲜胺和2,4,6-TCP 标准曲线Fig.2 The standard curve of the prochloraz and 2,4,6-TCP
得到咪鲜胺和2,4,6-TCP 的线性方程分别为Y=637 497.3X-8 786.1 和 Y=890 775.9X-3 978.6,其相关系数r 值分别为0.999 1 和0.999 2,表明咪鲜胺和2,4,6-TCP 在 0.01 μg/mL~1.0 μg/mL 范围内的线性关系均良好,以3 倍信噪比(S/N=3)确定咪鲜胺和2,4,6-TCP 检出限为 0.003 3 mg/kg,满足残留定量分析要求。
2.4 回收率和精密度
试验对辣椒进行了加标回收试验,考察该方法的回收率与精密度。按照1.5 步骤对辣椒添加0.02、0.10、0.50 μg/mL 3 个水平的咪鲜胺和 2,4,6-TCP 标准溶液,经前处理后GC-MS 分析,测定后计算回收率见表3。
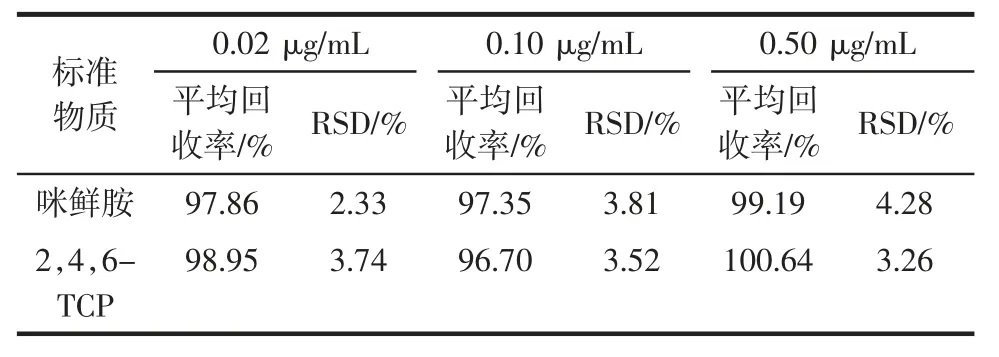
表3 辣椒中咪鲜胺和2,4,6-TCP 在3 个添加水平下的平均回收率及其相对标准偏差(n=7)Table 3 Average recoveries and the RSD of prochloraz and 2,4,6-TCP at three spiked levels in pepper(n=7)
由表3可知,在3 个添加水平下咪鲜胺和2,4,6-TCP 的平均回收率在96.70%~100.64%的范围之间,相对标准偏差(relative standard deviation,RSD)介于2.33%~4.28%之间,表明此方法具有较高的准确度和精密度。因此,试验中开发的方法满足2,4,6-TCP 和咪鲜胺分析的要求,可用于辣椒样品中2,4,6-TCP 和咪鲜胺农药残留的检测。
2.5 实样分析
利用本试验方法按1.5 样品处理步骤,以市售的辣椒50 个样品进行定性定量分析见表4。
其中 4 个样品检出咪鲜胺和 2,4,6-TCP 残留,结果见表4,其余样品均未检出,对检出样品做5 次平行检测,咪鲜胺和2,4,6-TCP 分别在0.049 mg/kg~0.25 mg/kg 和 0.018 mg/kg~0.19 mg/kg 之间,相对标准偏差在6.02%~11.28%之间。
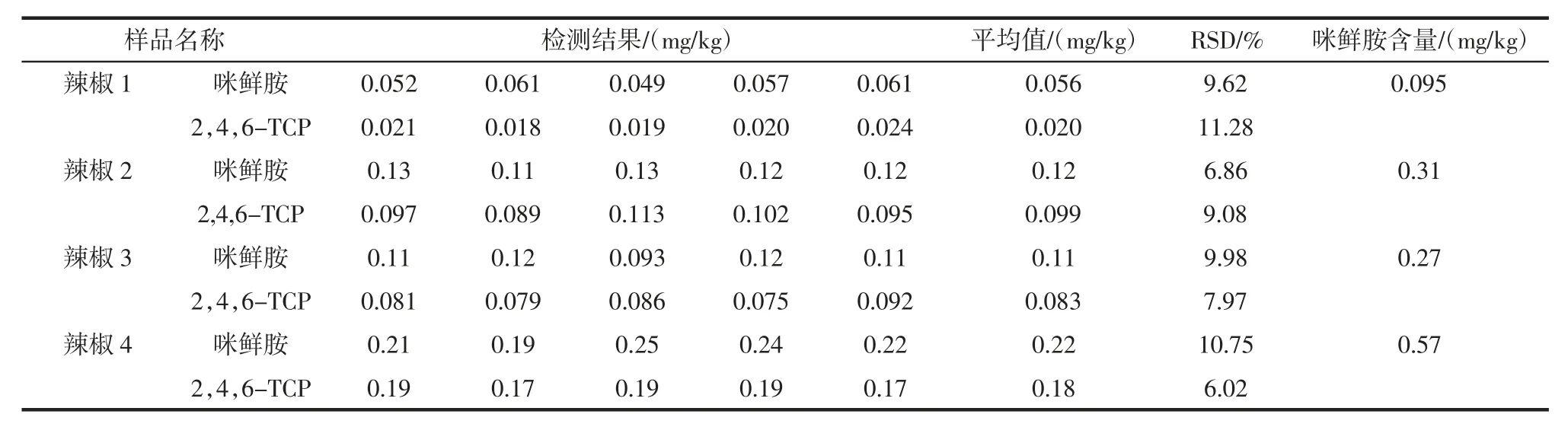
表4 实样检测结果Table 4 Sample test results
由于咪鲜胺最终降解为2,4,6-TCP,根据水解反应的化学计量法,1 摩尔咪鲜胺(分子量为376.7)水解产生 1 摩尔的 2,4,6-TCP(分子量为 197.5),所以它们之间存在下一种转换关系[23-24]:
1(mg/kg)2,4,6-TCP=1.907(mg/kg)咪鲜胺
按照GB2763-2016《食品安全国家标准食品中农药最大残留限量规定》[25],咪鲜胺及其含有2,4,6-三氯苯酚部分的代谢产物之和,以咪鲜胺表示,根据转换关系计算4 个样品中咪鲜胺的含量在0.095 mg/kg~0.57 mg/kg 之间,在辣椒中的最终残留量均低于最大残留量2 mg/kg。
3 结论
采用QuEChERS-气相色谱-串联质谱法对蔬菜中咪鲜胺及其代谢物2,4,6-三氯苯酚残留量的检测技术进行了研究。该方法前处理简便快速、选择性好、灵敏度高、抗干扰能力强,具有良好的线性响应,且在0.02、0.10、0.50 μg/mL 添加水平下,两种农药均有较好的回收率。表明该方法符合农药残留分析的要求,适用于辣椒中咪鲜胺及其代谢物2,4,6-三氯苯酚残留检测的定性和定量分析。
