复合诱变筛选高产柠檬酸黑曲霉及其发酵研究
2019-08-27孙士健王丽娟秦郦毕付提王德培
孙士健,王丽娟,秦郦,毕付提,王德培,3,*
(1.工业发酵微生物教育部重点实验室,天津300457;2.天津科技大学生物工程学院,天津300457;3.省部共建食品营养与安全国家重点实验室,天津300457)
柠檬酸(citric acid)又名枸橼酸,学名2-羟基丙烷-1,2,3-三羧酸,白色晶体,含一分子结晶水,无臭,具有令人愉快的强烈的酸味,入口爽快,无后酸味,安全无毒,被广泛用作食品和饮料的酸味剂[1]。自1945年美国Miles公司借鉴深层发酵青霉素工厂,采用无菌空气供给系统和机械搅拌通风发酵罐的成功经验基础上,首先成功开发了深层发酵法工业化生产柠檬酸[2]。柠檬酸已成为全球产量和需求量最大的有机酸品种。世界柠檬酸工业的集约化程度非常高,除中国外,全球主要的柠檬酸制造商只有5家~6家[3](美国、奥地利、加拿大、巴西等),而中国的产量为最大,2017年,全球柠檬酸及其盐产量达到212万吨,我国产量达到152万吨,占全球近70%,是柠檬酸主要生产国和出口国。
国内外柠檬酸工业化生产主要采用液体深层发酵法、表面发酵法及固体发酵法。上世纪90年代至今,我国利用玉米发酵柠檬酸,将玉米粉调浆,高温液化加入高温淀粉酶,快速过滤去除部分玉米渣后进行发酵,使柠檬酸发酵过程溶氧好、产酸快、发酵周期短,单罐产酸提高到16%,发酵指数在2.4 kg/(m3·h)~2.8 kg/(m3·h)之间。决定柠檬酸产能优势的两个关键技术是高产柠檬酸菌株和发酵工艺的优化。
自从上世纪初开始用微生物生产柠檬酸以来,人们对生产柠檬酸的菌种进行持续不断的诱变研究。我国在柠檬酸生产菌黑曲霉的育种方面积累了丰富的经验,20世纪50年代末和60年代初,金其荣等进行了柠檬酸发酵的菌种研究,从土壤中经酸性平板分离获得的野生黑曲霉628作为出发菌株,经多次γ射线(Co60)和硫酸二乙脂等复合诱变,获得了高产柠檬酸菌株Co827,可直接利用薯干粉发酵,产酸达12%~13%,平均转化率为95%,发酵周期54 h~64 h,发酵指数1.8 kg/(m3·h)~2.0kg/(m3·h)[4]。无锡工业大学以黑曲霉H-142为出发菌株,通过γ射线、硫酸二乙脂、高温单独或复合诱变处理,通过高温、高酸及高渗培养条件的定向筛选获得HQL-601菌种,发酵温度为40℃~41℃,周期60 h~64 h,20%薯干粉摇瓶产酸13%,其柠檬酸纯度明显优于出发酵菌[5]。复合诱变的方法比用单一的物理方法或化学方法更为有效[6]。黑曲霉育种较为有效的诱变因子有:γ-射线、x-射线、紫外线、激光、亚硝基胍(nitroso-guanidin,NTG)、亚硝基脲、乙基胺等,此外还有高能电子流、电磁场等[7]。
本文以江苏国信协联能源有限公司天津分公司保藏的菌种zs-10为出发株,经过γ射线(Co60)及亚硝基胍复合诱变,得到一株高产柠檬酸且遗传稳定性高的诱变菌株。通过对该菌株发酵工艺的优化,提高了柠檬酸产量,缩短了发酵周期。试验结果在50 L发酵罐中试试验中得到验证。
1 材料与方法
1.1 菌种
黑曲霉(Aspergillus niger)zs-10:江苏国信协联能源有限公司天津分公司保藏。
1.2 试剂
无水葡萄糖、酵母粉、琼脂粉、大豆蛋白胨:分析纯,天津市北方天医试剂公司;(NH4)2SO4、KH2PO4、MgSO4、CaCl2、KCl、FeSO4:分析纯,天津市四通化工厂;玉米浆(试剂级):金丰玉米有限公司;糖化酶(100 000 U/mL):上海源叶生物科技有限公司;耐高温的α-淀粉酶(20 000 U/mL):诺和诺德(中国)生物技术有限公司;玉米蛋白粉、麸皮粉、豆饼粉:鄢陵胜源豆业有限公司。
1.3 仪器与设备
LS-B50L型立式压力蒸汽灭菌锅、SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;CX23型光学显微镜:OLYMPUS公司;HZQ-QX恒温振荡器:中国哈尔滨市东联电子技术开发有限公司;FA2004N电子天平:上海精密科学仪器有限公司;50 L发酵罐:镇江东方生物工程设备技术有限公司。
1.4 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯削皮切块,称取200 g,加入适量蒸馏水煮沸30 min,4层纱布过滤除渣,取清液加蒸馏水定容至1L,加入2%葡萄糖充分溶解,加入琼脂粉20 g,121℃,20 min灭菌。制成斜面或平板备用。
筛选培养基(g/L)[8]:马铃薯的煮汁 200 mL,K2HPO43.6 g,MgSO4·7H2O1.5 g,葡萄糖60 g,琼脂20 g,溴甲酚绿0.05 g;121℃灭菌20 min;制成平板备用。
种子液培养基:4.8 g玉米粉,40 mL水,2滴耐高温的α-淀粉酶加入250 mL三角瓶中,121℃灭菌0.5 h,冷却后备用。
玉米液化液的制备:玉米粉与水以质量比1∶4的比例混合,搅拌均匀后加热到70℃,加入耐高温α-淀粉酶(0.5 kg/t),保温10 min后加热到90℃保温4 h~5 h,趁热经两层纱布过滤得糖化清液。过滤清液冷却后加水调整总糖到要求的浓度[9]。
摇瓶发酵培养基:18%浓度玉米粉液化液,每250 mL三角瓶装量35 mL液化液,1.93 g玉米粉末,1滴耐高温的α-淀粉酶,121℃灭菌30 min,冷却后备用。
1.5 诱变方法
1.5.1 孢子悬浮液的制备
用10 mL无菌水洗脱新鲜斜面孢子,置于预先灭菌的带玻璃珠的20 mL无菌水中,于旋转式摇床上180 r/min振荡40 min至镜检为分散的单孢子,用两层无菌滤纸加一层灭菌的脱脂棉过滤,得到单孢子悬液,将孢子悬液离心稀释,用血球计数板对单孢子悬液进行镜检计数,调节孢子浓度约为106个/mL[10-11]。
1.5.2 γ射线(Co60)-亚硝基胍复合诱变
取106孢子/毫升Co60照射(剂量为1 400 Gy)辐照不同时间后的孢子悬浮液与亚硝基胍诱变剂混合不同时间,诱变后均与涂布于筛选平板,35℃恒温培养60 h后进行初筛。
1.6 筛选方法
1.6.1 诱变菌株的初筛
从经过γ射线(Co60)-亚硝基胍复合诱变高浓度孢子液中取0.1 mL稀释涂布于初筛平板中,以黑曲霉未经离子注入的存活率为100%,将制好的平板与35℃培养36 h后开始观察,每6 h观察1次,至产酸为止,统计致死率、突变率及正负突变率,挑取高产菌落于斜面上传代培养。
致死率/%=(处理前菌落数-处理后菌落数)/处理前菌落数×100
突变率/%=突变菌落数/处理后菌落数×100
正突变率/%=发生正突变菌落数/处理后菌落数×100
负突变率/%=发生负突变菌落数/处理后菌落数×100
式中:突变菌落数为黄色透明圈直径与对照样相比出现差异的菌落数;发生正突变的菌落数为黄色透明圈直径比对照样大的菌落数;发生负突变的菌落数为黄色透明圈直径比对照样小的菌落数[12-13]。
1.6.2 诱变菌株的复筛
从初筛得到的斜面菌株上挑取适量的黑曲霉孢子于总糖为18%的玉米发酵液中,500 mL三角瓶中装入50 mL培养液,摇床转速350 r/min,36℃振荡培养72 h。测定发酵液总酸。
1.7 柠檬酸发酵工艺优化
1.7.1 种子液的培养条件
1.7.1.1 种子培养氮源种类优化
氮源分别为玉米蛋白粉、麸皮粉、豆饼粉,分别称取一定量溶于50 mL水中,2滴液化酶,121℃灭菌30 min,冷却后接入1环黑曲霉孢子于250 mL三角瓶中,摇床200 r/min,35℃恒温培养24 h,测定种子液中18 h pH值并观察菌球形态。
1.7.1.2 种子培养总糖源浓度优化
在氮源一定的情况下,将种子液总糖浓度分别调至3%、6%、10%、15%、20%,50mL种子培养液,121℃灭菌30 min,冷却后接入1环黑曲霉孢子于250 mL三角瓶中,摇床200 r/min,35℃恒温培养24 h,测定种子液中菌球数量。
1.7.2 发酵工艺的优化
1.7.2.1 温度对黑曲霉发酵产酸的影响
采用摇瓶培养基,无菌接入一环孢子,分别在温度为 26、29、32、35、38 ℃条件下进行摇瓶发酵培养,转速为350 r/min,发酵72 h后测定不同温度条件下的发酵液中总酸的含量,确定黑曲霉柠檬酸发酵的最适温度。
1.7.2.2 初始pH值对黑曲霉发酵产酸的影响
调整摇瓶发酵培养基初始pH值分别为2.5、3.5、4.0、5.0、6.0、7.0、8.0、9.0 后灭菌。无菌环境下接入一环黑曲霉孢子,在35℃发酵72 h后测定不同初始pH值条件下柠檬酸的生成量,确定柠檬酸发酵的最适初始pH值。
1.7.2.3 氮源种类对黑曲霉发酵产酸的影响
摇瓶发酵培养基中分别加入不同种类的蛋白质含量为0.6%的氮源后灭菌,氮源分别为蛋白胨、玉米浆、豆饼粉、硫酸铵、尿素、氯化铵、硝酸铵,在35℃发酵72 h后测定在不同的氮源条件下发酵液中总酸的含量,确定柠檬酸发酵的最适氮源。
1.7.2.4 氮源含量对黑曲霉发酵产酸的影响
摇瓶发酵培养基中分别加入不同含量的最适氮源后灭菌,氮源加量为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%,35℃发酵72 h后测定在最适氮源的不同含氮量下发酵液中柠檬酸的含量,确定柠檬酸发酵的最适氮源的用量。
1.8 50L发酵罐中试试验
将7.84 kg玉米粉与水混合至28 L,加入液化酶进行液化,液化后过滤后取清液21 L,再加入30%浓度玉米液化混液4.5 L作为氮源,采用二级接种,10%接种量,发酵温度35℃,罐压0.08 MPa,通气量0.12 V/V·M~0.15 V/V·M (V/V·M 表示通风比),转速350 r/min。
1.9 分析方法
1.9.1 还原糖和总糖的测定
采用菲林法测定。
1.9.2 发酵液中总酸的测定
取1 mL发酵过滤液于250 mL锥形瓶中,再加入约100 mL蒸馏水,加入2滴0.1%酚酞指示剂,用0.142 9 mol/L的NaOH溶液滴定至变红为止,记录所消耗NaOH溶液的体积V[14]。

式中:V为滴定时消耗NaOH的体积,mL;0.142 9为滴定系数。
1.10 数据处理方法
Excel 2007数据统计处理,SPSS17.0软件进行单因子方差分析
2 结果与讨论
2.1 Co60与亚硝基胍复合诱变黑曲霉
2.1.1 γ 射线(Co60)诱变
由于此前黑曲霉zs-10是经过γ射线(Co60)诱变后筛选得到的菌株,因此采用高剂量γ射线(Co60)进行孢子悬浮液诱变,选用γ射线(Co60)处理的剂量分别为 1000、1200、1400 Gy,其致死率与正突变率见表 1。

表1 不同剂量下Co60诱变黑曲霉的致死率及正突变率Table1 Death rate and positive rate of Co60mutagenesis Aspergillus niger at different doses
由表1可以看出,Co60诱变的致死率和菌种正变率都随着处理时间的增加而升高,在处理剂量为1 400 Gy时,正变率达到30.6%。所以选取诱变剂量为1 400 Gy。
2.1.2 亚硝基胍诱变黑曲霉
NTG诱变孢子存活率与时间的关系见图1。
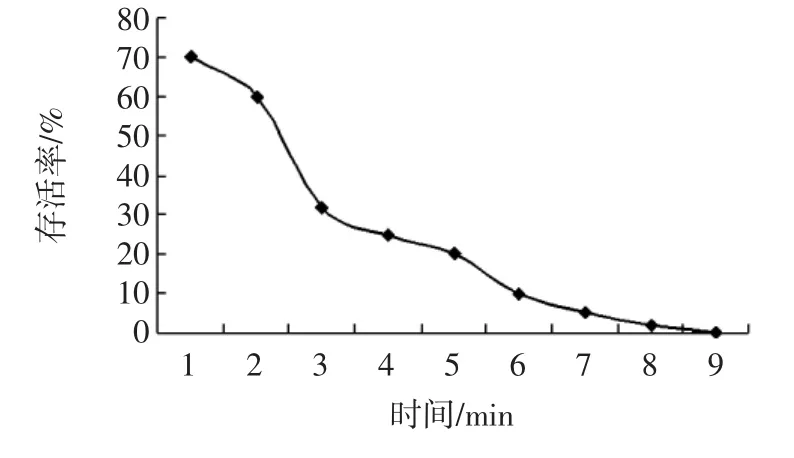
图1 NTG诱变孢子存活率与时间的关系Fig.1 Relation between the survival rate of NTG mutagenesis spores and time
由图1可以看出,随着NTG诱变时间的延长,菌株存活率在下降。当诱变时间为4 min时存活率为25%,致死率在75%左右。因此当用浓度为1 mg/mL的NTG做诱变剂时,诱变时间为4 min。
2.1.3 Co60与亚硝基胍复合诱变
通过Co60和亚硝基胍单独诱变确定最适的诱变剂量,进行Co60与亚硝基胍复合诱变黑曲霉孢子。通过挑选圏径比大的菌株进行初筛,初筛后得到30株然后进行第一轮复筛结果见表2,将第一轮复筛产酸高于15.2 g/dL菌株进行第二轮复筛见表3。
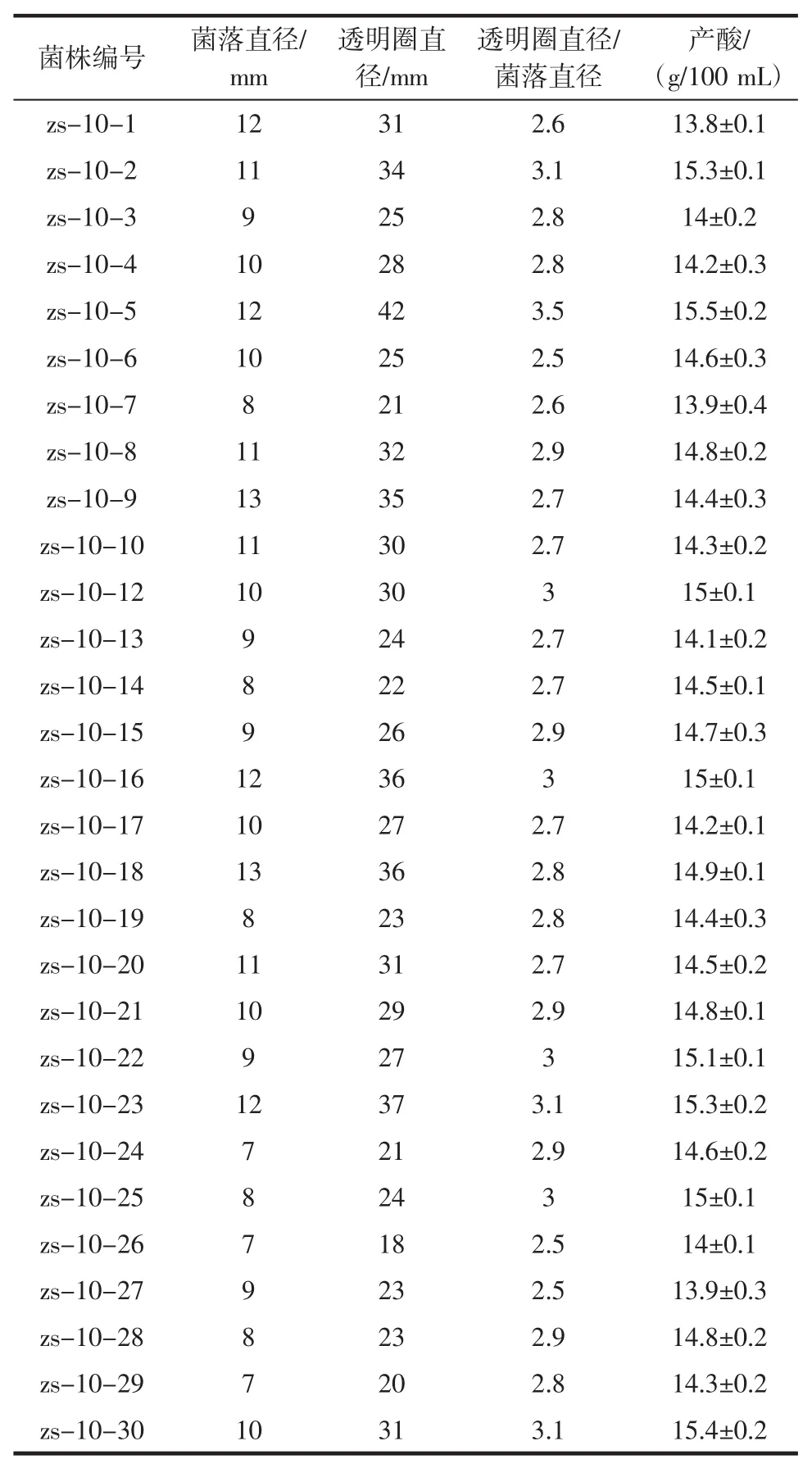
表2 诱变黑曲霉孢子复筛结果Table 2 Results of mutagenic Aspergillus niger spore screening
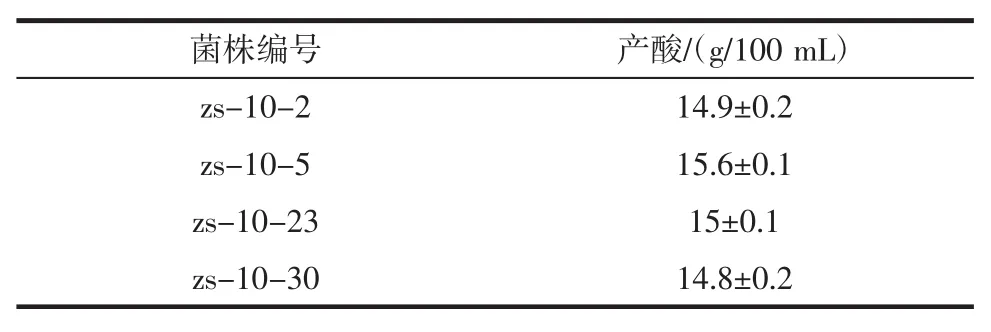
表3 诱变黑曲霉孢子二次复筛结果Table 3 Secondary screening results of mutagenic Aspergillus niger spores
通过表2和表3可以看出,经过二次复筛得到平均产酸为15.5 g/dL的菌株zs-10-5,接下对其遗传稳定性进行考察。黑曲霉zs-10-5的传代培养情况见表4。

表4 黑曲霉zs-10-5的传代培养情况Table 4 Subculture of Aspergillus niger zs-10-5
从表4可以看出,经过10次传代培养后,黑曲霉zs-10-5仍保留了较高产酸能力,具有较好的遗传稳定性。经过初筛、复筛和传代培养,获得产酸有较大提高且遗传性状稳定的突变株zs-10-5。
2.2 种子液的培养条件
2.2.1 氮源对种子的影响
种子摇瓶中添加不同的氮源对种子发酵液的pH值,菌球的形成时间及菌球的形态产生了不同的影响结果见表5。
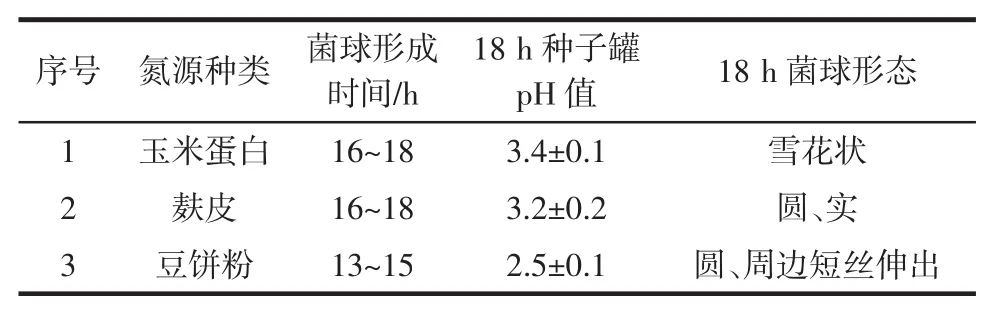
表5 氮源对种子的影响Table 5 Influence of nitrogen source on seed
由表5可以看出,添加豆饼粉的种子液菌种生长较快,在同样时间下pH值下降幅度大,因此,在使用豆饼粉的工艺中,可以缩短种子的培养时间3 h~4 h,而且菌球形态有利于发酵。
2.2.2 碳源浓度对种子的影响
种子液的初糖浓度的高低直接影响黑曲霉菌体的生长与发育,影响产酸效率。从黑曲霉发酵柠檬酸的过程分析,如果种子液初糖浓度过高,会对孢子的生长发育有抑制作用。同时过高的糖浓度还会使发酵培养基浓度过高,严重影响发酵液溶氧。由于种子生长初期,孢子发育耗氧量非常大,所以种子液初期糖浓度过高会严重影响菌丝球成型。但是,如果种子液初总糖过低,则菌丝球会长的很大,且形状不规则,生长不正常。以下是不同糖浓度下,菌球生长情况。糖浓度与菌球数的关系见图2。
由图2可以看出在一定范围内随着糖浓度的升高菌球数也随之增加,当糖浓度为10%时,菌球数达到最大值。糖浓度超过10%时,菌球数随之下降,说明糖浓度过大会抑制孢子的萌发和菌球的形成。

图2 糖浓度与菌球数的关系Fig.2 Relationship between sugar concentration and mycosphere number
2.3 黑曲霉柠檬酸发酵工艺优化
2.3.1 温度对黑曲霉发酵产酸的影响
温度是影响黑曲霉发酵过程的一个重要因素。温度过低,细胞内控制酶合成的关键酶的活性受到抑制,合成柠檬酸的生物反应趋向停滞状态,温度偏高,可能会造成微生物细胞中关键酶的不可逆失活,是微生物代谢减慢。在不同的温度下,黑曲霉发酵72 h后柠檬酸的生成情况见图3。
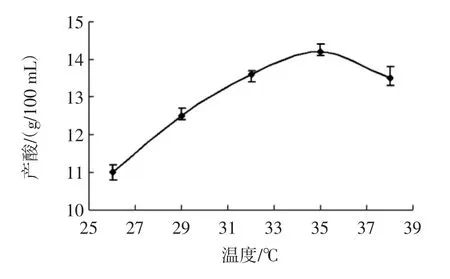
图3 不同温度对黑曲霉产酸的影响Fig.3 Effects of different temperatures on acid production by Aspergillus niger
从图3可以看出,黑曲霉进行柠檬酸发酵时,在26℃~35℃范围内,随着温度的升高,发酵液中柠檬酸的含量逐渐升高,当温度大于35℃时,发酵液中柠檬酸的含量明显降低,因此黑曲霉发酵产生柠檬酸的最适温度为35℃。
2.3.2 初始pH值对黑曲霉发酵产酸的影响
实验室内的摇床三角瓶发酵,调节合适的发酵初始pH值十分重要。特别是像柠檬酸发酵这种以淀粉作为发酵原料的发酵,发酵液初始pH值的高低会直接影响到菌体糖化酶的活力,由于柠檬酸发酵是以玉米粉为原料的发酵过程,属于边糖化边生长边产酸的过程。初始pH值过低,会直接导致糖化酶活性低,淀粉不能完全水解,反之如果发酵液初始pH值较高,会使发酵过程中草酸和葡萄糖酸大量积累,使发酵液中杂酸含量过高。不同发酵液初始pH值对柠檬酸发酵产量的影响见图4。
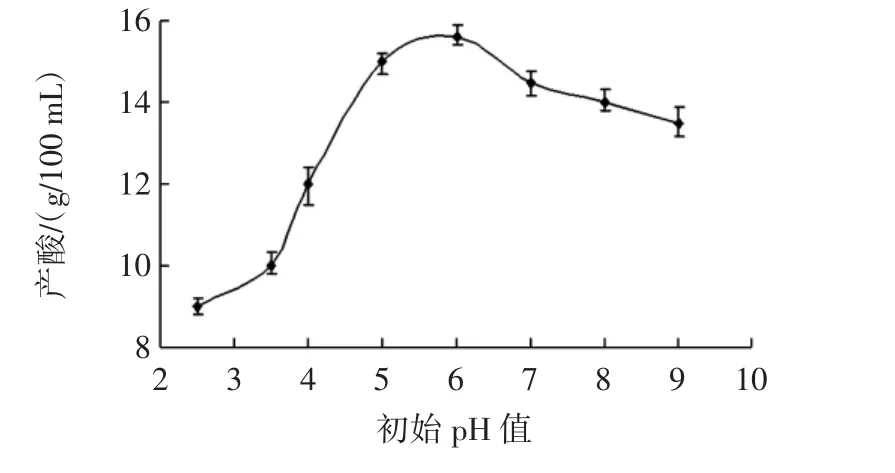
图4 不同pH值对黑曲霉的产酸影响Fig.4 Effects of different pH on acid production by Aspergillus niger
如图4所示,黑曲霉在进行柠檬酸发酵时,只有发酵液初始pH值为5~6时,产酸最高。究其原因主要是,糖化酶的活性最高pH值为4.0~4.6,如果起始pH值低于糖化酶的作用最适范围,会使得发酵原料得不到充分利用,进而影响最终产酸率。反之如果发酵液初始pH值过高,则黑曲霉菌丝球会出现老化现象,提前进入衰老期。所以,发酵液初始最适pH值为5~6。
2.3.3 氮源种类对黑曲霉发酵产酸的影响
菌体利用发酵液中的氮源是为了合成自身生长发育所需要的各种蛋白质、核酸和各种氨基酸。在菌体的生长过程中,不同菌体利用各种有机氮或无机氮的种类是不同的。但是黑曲霉的生长过程比较粗放,可以利用各种有机或无机氮源作为其自身氮源。柠檬酸产酸与氮源种类的关系见图5。
结果如图5所示,以豆饼粉为氮源时菌株的产酸能力高于其它氮源。
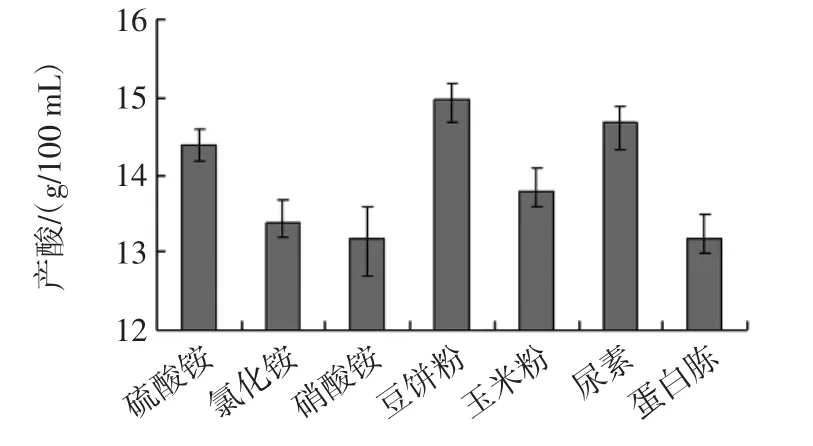
图5 柠檬酸产酸与氮源种类的关系Fig.5 Relation between citric acid production and nitrogen source species
2.3.4 氮源含量对黑曲霉发酵产酸的影响
柠檬酸产酸与氮源含量的关系见图6。

图6 柠檬酸产酸与氮源含量的关系Fig.6 Relation between acid production and nitrogen source content
从图6可以看出,黑曲霉进行柠檬酸发酵时,当氮源的用量为0.8%时,柠檬酸的产量最高。因此,在以豆饼粉为氮源的条件下,黑曲霉利用进行发酵产生柠檬酸的最适氮源含量为0.8%。
2.4 50 L发酵罐中试试验
50 L中试试验结果见表6。
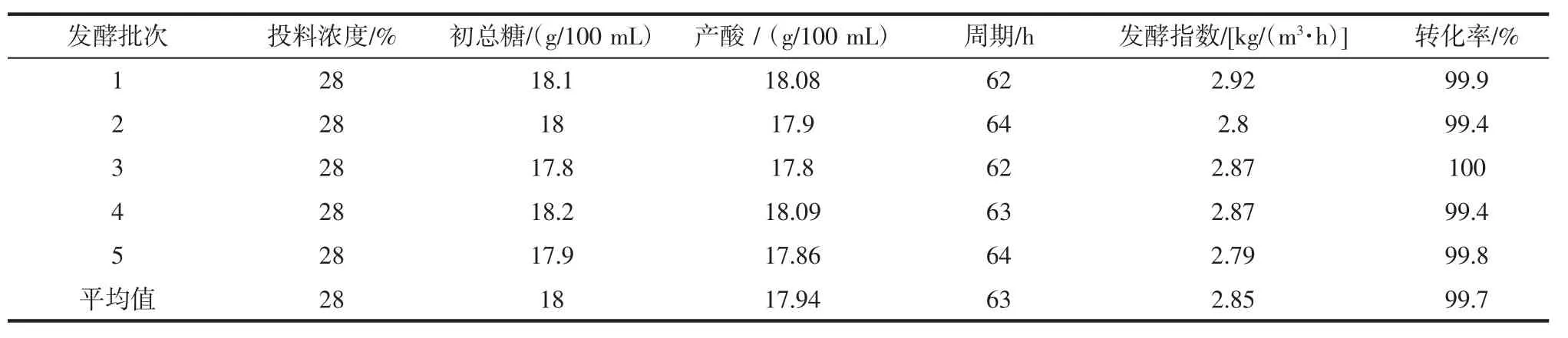
表6 50L中试试验结果Table 6 50L pilot test results
由表6可以看出,通过优化柠檬酸发酵工艺,中试罐发酵产酸17.94%,周期63 h、发酵指数2.85 kg/(m3·h)及转化率99.7%都达到较好的发酵水平。
3 结论
以菌种zs-10为出发株,经过γ射线(Co60)及亚硝基胍复合诱变,得到一株高产柠檬酸且遗传稳定性高的诱变菌株zs-10-5。通过对种子培养条件和发酵条件的优化,最终发现种子以豆饼粉为氮源,初总糖浓度10%培养24 h左右形成菌丝球性能最好。发酵最适温度35℃,初始发酵在pH5~6,以豆饼粉为氮源为0.8%,通过50 L发酵罐进行了验证,其发酵结果为周期63 h,产酸17.94 g/100 mL,发酵指数为2.85 kg/(m3·h),转化率为99.7%。比出发菌株发酵周期缩短3 h,产酸提高10%,转化率提高5%。
