高效液相色谱法测定蔬菜和水果中15种欧盟优控多环芳烃
2019-08-27王钟何漪王敏邢燕殷茂荣
王钟,何漪,王敏,邢燕,殷茂荣
(淄博市疾病预防控制中心,山东淄博255026)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是非常重要的一类持久性有机污染物(persistent organic pollutants,POPs),广泛存在于自然界中。多环芳烃是由2个或2个以上的苯环以稠环或非稠环的形式相链接的性能稳定的化合物,其中大部分化合物具有较强的致癌特性[1]。随着所含苯环数的增加,多环芳烃的致癌特性明显增强。目前关于多环芳烃的研究主要集中于美国环保署(U.S Environmental Protection A-gency,EPA)提出的16种优先控制多环芳烃,而对于欧洲食品安全局2008年提出的15种欧盟优控多环芳烃(European priority controlled polycyclic aromatic hydrocarbons,EU-PAHs)的报道较少。欧盟优控多环芳烃中包括8种EPA优控PAHs及其他8种新物质,EU优控新增了更多重质多环芳烃,剔除了EPA优控中的轻质多环芳烃。目前,对于水[3]和土壤[4]中多环芳烃的研究较多,而鲜有对于蔬菜和水果中欧盟优控多环芳烃的研究。截至目前,我国尚未建立检测蔬菜和水果的欧盟优控多环芳烃检测的标准方法。由于蔬菜和水果中PAHs的种类复杂且含量较低,故选择简单、快速的样品前处理方法尤为重要。近年来,一些常用的前处理辅助技术[5]例如超声波、加压等与传统前处理方法相结合,开发出了一些高效、经济的前处理技术。测定多环芳烃含量的方法主要有荧光分光光度法[6]、气相色谱(gas chromatography-flame ionization detector,GCFID)法[7]、气相色谱质谱(gas chromatography mass spectrometry,GC-MS)法[8]及高效液相色谱法(high performance liquid chromatography,HPLC)[9-10]等。本研究利用超声波辅助乙腈提取,经N-丙基乙二胺(primary secondary amine,PSA)和无水 MgSO4净化,用高效液相色谱-荧光检测(HPLC-FLD)法检测蔬菜和水果中15种欧盟优控多环芳烃,取得了较好的结果。
1 材料与方法
1.1 仪器与设备
1.1.1 仪器
Waters e2695液相色谱仪(带荧光检测器)、Waters PAH C18色谱柱(5.0 μm,4.6 mm×250 mm):美国Waters公司;ST 16R型高速离心机:美国Thermo Fisher公司;KQ-250B型超声波清洗器:昆山市超声仪器有限公司;OA-SYS型氮气吹干仪:美国Organomation;SZ-1型快速混匀器:江苏金坛实验仪器厂;Milli-Q型纯水机:美国Millipore公司。
1.1.2 色谱条件
色谱柱:WatersPAHC18(5.0μm,4.6mm×250mm);柱温:35.0℃;流动相:乙腈+水,梯度洗脱;柱流速:1.2 mL/min;进样体积:20.0 μL。液相色谱梯度洗脱程序见表1,液相色谱检测器条件见表2。

表1 液相色谱仪梯度洗脱程序Table 1 Gradient eluted program in HPLC

表2 液相色谱检测器条件Table 2 The conditions of HPLC detector
1.2 试剂与材料
N-丙基乙二胺(primary secondary amine,PSA):天津博纳艾杰尔科技有限公司;无水MgSO4,纯度98%:德国CNW科技公司;15种欧盟优控PAHs混合标准溶液:苯并(c)芴、苯并(a)蒽、屈、5-甲基-1,2-苯并菲、苯并(j)荧蒽、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、二苯并(a,l)芘、二苯并(a,h)蒽、苯并(g,h,i)苝、茚并(1,2,3-cd)芘、二苯并(a,e)芘、二苯并(a,i)芘、二苯并(a,h)芘,浓度均为 10 μg/mL,-18℃下保存:德国Dr.Ehrenstorfer公司;乙腈(色谱纯):德国Merck公司。
多环芳烃标准中间液1(100 ng/mL):德国Dr.Ehrenstorfer公司,-18℃下保存;多环芳烃标准中间液2(20 ng/mL):德国 Dr.Ehrenstorfer公司,现用现配。
样品:按照国家食品安全风险计划,随机采集山东省17地市售蔬菜和水果各30份,共计60份。
1.3 试验步骤
1.3.1 样品处理
称取10.0 g粉碎后的蔬菜、水果样品于50 mL具塞离心管中,加入20.0 mL乙腈,振摇1 min,超声30 min,加入5.0 g氯化钠,振摇1 min,5 000 r/min离心5 min,吸取上清液10.0 mL,氮吹浓缩至2.0 mL,加入150 mg PSA和300 mg无水MgSO4,涡旋1 min,5 000 r/min离心5 min,吸取上清,过0.22 μm有机滤膜,备用。吸取10 μL,进样分析。以其标准溶液峰的保留时间进行定性,利用峰面积求出样品溶液中待测物的浓度。
1.3.2 标准曲线的绘制
分别吸取多环芳烃标准中间液2(浓度为20ng/mL)0.025、0.050、0.25、0.50、1.00 mL,用乙腈定容至 1.0 mL,配制成浓度分别为 0.50、1.00、5.00、10.0、20.0 ng/mL的标准溶液。将配制的系列标准液注入高效液相色谱分离。从低浓度到高浓度依次进样,以峰面积Y作因变量,分别以15种标准品系列浓度x(ng/mL)作自变量,绘制标准曲线。
1.3.3 样品测定
在优化的色谱条件下,吸取标准溶液及样品测试液各10 μL,注入高效液相色谱仪进行分离,进样分析。以其标准溶液峰的保留时间进行定性,利用峰面积求出样品溶液中待测物的浓度。
1.3.4 结果计算
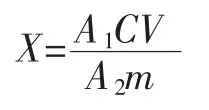
式中:X为样品中多环芳烃的含量,μg/kg;A1为样品峰面积;C为标准溶液浓度,ng/mL;V为样品定容体积,mL;A2为标准溶液峰面积;m为样品质量,g。
1.4 试验条件优化
1.4.1 萃取溶剂的选择
由于蔬菜和水果的基体成分复杂,且多环芳烃(PAHs)的浓度水平较低,因此选择适宜的萃取溶剂是保证结果准确可靠的前提。分别选择正己烷、二氯甲烷和乙腈作为萃取剂,比较其对15种欧盟优控多环芳烃(EU-PAHs)的回收率。
1.4.2 超声提取时间优化
称取适量水果蔬菜样品6份,加入多环芳烃标准溶液,使加标后的样品中多环芳烃的浓度达5.0 μg/kg,冷冻保存24 h后,考察不同超声时间对提取效率的影响,试验考察了在 10、20、30、45、60 min 的超声提取效果,其回收率与提取时间的趋势如图1所示。

图1 不同超声提取时间平均回收率趋势图Fig.1 Trend chart of average recovery rate for different ultrasound extraction time
由图1可以看出,超声30 min~40 min平均回收率变化不大,故超声时间选为30 min。
1.4.3 分离条件和检测波长的优化
多环芳烃组分的沸点较高,色谱柱选择PAH C18(5.0 μm,4.6 mm×250 mm),分离效果良好。分别选取不同配比的水+乙腈作为流动相,从保留时间、分离效果、峰形等进行比较,确定梯度洗脱分析条件。利用紫外检测器对紫外波长扫描鉴定,利用荧光检测器扫描确定灵敏荧光波长;最终确定色谱条件,另外,对流动相流速、色谱柱温度等进行选择并优化,15种多环芳烃标准的分离效果如图2所示,该色谱条件下,15种物质均能达到基线分离。

图2 15种欧盟优控多环芳烃色谱图Fig.2 Chromatographic charts of 15 EU-PAHs
2 结果与讨论
2.1 萃取溶剂的选择
通过比较,乙腈作为提取溶剂时可获得较高的回收率,15种PAHs的平均回收率可达90.0%。而正己烷和二氯甲烷做为萃取溶剂时,平均回收率分别为67.2%和81.4%。考虑到本方法以乙腈和水为流动相,在提取过程中选择乙腈作为提取溶剂,无需溶剂置换,避免了因置换溶剂而造成组分的损失。因此本试验选择乙腈做为萃取溶剂。
2.2 方法的线性范围、检出限、回收率和精密度
用乙腈为溶剂,配制多环芳烃标准系列,浓度均为0.50 ng/mL~20.0 ng/mL。在试验条件下分离检测,每个浓度水平平行测定2次,以标准的峰面积对浓度作曲线,标准曲线相关系数见表3。
分别精密量取混合标准溶液5.00、20.0 ng/mL,加入到已得到浓度的样品溶液中,使加入后待测物含量分别为1.0 μg/kg和5.0 μg/kg,按上述色谱条件进行分析,每个样品平行进样6次测定峰面积,计算回收率和相对标准偏差。在不同的加标浓度下,加标回收率在83.6%~97.2%之间,相对标准偏差(relative standard deviation,RSD)4.2%~12.0%之间。方法的回收率和精密度结果见表3。

表3 方法的回收率、精密度、线性范围和检出限Table 3 Recovery,precision,linear range and detection limit of the method
由表3可见,15种多环芳烃在试验浓度范围内,线性关系良好,相关系数达0.999以上。方法的最低检出浓度检出限(detection limit,LOD)以3倍信噪比计算,检出限为0.07 μg/kg~0.10 μg/kg。(按取样10.0 g计算)。
2.3 蔬菜水果中15种欧盟优控多环芳烃浓度水平的检测
为了解市售水果和蔬菜中15种欧盟优控多环芳烃污染水平。按照全省食品安全风险监测计划,采集全省17地市市售蔬菜和水果各30份,用本方法分析了蔬菜和水果中15种欧盟优控多环芳烃的浓度水平。通过分析,15种欧盟优控多环芳烃检出8种,其中屈检出率最高,共有40份样品检出,浓度范围为0.10 μg/kg~0.81 μg/kg。60份蔬菜水果中15种欧盟优控多环芳烃的检出情况见图3。
由图3可以看出,蔬菜水果中15种欧盟优控多环芳烃以屈、苯并(c)芴、苯并(a)蒽及苯并(g,h,i)苝等 8种多环芳烃检出率较高,其中屈的检出率最高,浓度最大达 0.81 μg/kg。

图3 蔬菜和水果中15种欧盟优控多环芳烃的检出情况Fig.3 Detection of 15 EU-PAHs in vegetables and fruits
3 结论
本文采用超声波辅助乙腈提取,PSA和无水MgSO4净化,高效液相色谱仪分离,荧光检测器检测法测定蔬菜和水果15种欧盟优控多环芳烃。该方法操作简单,试剂消耗量少,且该方法检测效率高,方法检测线性范围宽,准确度、灵敏度高及检出限低,适用于蔬菜和水果中15种欧盟优控多环芳烃的检测。
