低温连续相变萃取对蓝圆鱼蛋白结构的影响及其抗氧化肽制备工艺优化
2019-08-26王淑惠罗旭洸周爱梅
王淑惠,罗旭洸,王 爽,周爱梅,曹 庸
(华南农业大学食品学院,广东省天然活性物工程技术研究中心, 广东省功能食品活性物重点实验室,广东广州 510642)
蓝圆鲹(Decapterusmaruadsi),又称为巴浪鱼、池鱼,为鲹科(Carangidae)圆鲹属(Decapterus),其广泛分布于中国南海、东海和台湾海域,是我国主要的经济鱼类之一[1-2],具有形体小、产量大、营养丰富等特点[3],其中蓝圆鲹粗蛋白干重含量为80.16%,粗脂肪干重含量为10.38%[4]。但蓝圆鲹的渔获期在夏季,鱼体颜色深,容易发生腐败产生不愉快的气味,因此常被丢弃或者加工成鱼粉或肥料等低值副产品[5]。越来越多的研究报道,将低值海洋鱼类加工成高价值的产品,如鱼糜以及具有生物活性的蛋白质水解产物,有利于充分开发海洋资源[6-9]。目前对蓝圆鲹的开发利用尚不充分,若能将蓝圆鲹的资源进行综合利用,将具有重要的经济效益。
低温连续相变萃取[10]是在超临界、亚临界萃取技术的基础上由本研究团队自主研发的一种新型食品加工技术,萃取时在较低的温度下进行,可以对物料进行连续的逆流萃取,且不会对样品中的目标成分和热敏性成分造成损害,得到的萃取残渣溶剂残留少,富含蛋白质[11]。目前关于低温连续相变萃取鱼油后对蛋白质结构和活性影响的研究尚未见报道。故本研究利用该技术提取鱼油后得到的脱脂蓝圆鲹鱼粉作为原料,研究该技术对脱脂蓝圆鲹鱼粉中蛋白二级结构的影响。
蛋白质的二级结构是反映蛋白质是否发生变性的重要体现[12],某些物理、化学因素都会使蛋白质的空间结构发生明显的变化,从而导致其生物活性的丧失[13]。基于此,本文采用傅里叶红外光谱、圆二色光谱两种方法来表征低温连续相变萃取技术对脱脂蓝圆鲹鱼粉中的蛋白质微观结构变化,并进一步以脱脂蓝圆鲹鱼粉为原料,利用碱性蛋白酶制备抗氧化肽,优化其制备工艺,为蓝圆鲹的综合利用提供有益的参考。因此,对脱脂蓝圆鲹鱼粉进行加工利用对南海低值鱼高值化综合利用具有重要意义。
1 材料与方法
1.1 材料与仪器
新鲜蓝圆鲹 广州市天河区长湴市场;丁烷(99.99%) 广州深岩燃气有限公司;碱性蛋白酶(1.925×105U/g) 广州市齐云生物技术有限公司;DPPH(1,1-二苯基-2-苦基肼自由基) 美国Simga-Aldrich贸易有限公司;其余试剂 均为分析纯。
LSC-60D型水分测定仪 沈阳龙腾电子有限公司;HYP-308型消化炉、KDN-103F型凯氏定氮仪 上海纤检仪器有限公司;SRJX-8-13型高温马弗炉 北京市永光明医疗仪器厂;DHG-970型鼓风干燥箱 上海齐心科学仪器有限公司;3L、21L低温连续相变萃取装置 珠海共同机械有限公司;VERTEX 70型傅立叶红外光谱仪 德国BRUKER;AL104型万分之一电子天平 梅特勒-托利多仪器有限公司;Chirascan型圆二色光谱分析仪 英国应用光物理公司;Enspire2300酶标仪 美国Perkin Elmer公司。
1.2 实验方法
1.2.1 脱脂蓝圆鲹鱼粉的制备 将去除内脏部分的新鲜蓝圆鲹在45 ℃烘箱内干燥至含水量为10%左右,粉碎后过120目筛得到蓝圆鲹鱼粉。参照杨小斌等[14]的方法,利用低温连续相变技术提取蓝圆鲹鱼油,得到的萃取残渣即为脱脂蓝圆鲹鱼粉,过120目筛后用于后续研究。
1.2.2 基本成分分析 分别对新鲜蓝圆鲹、蓝圆鲹鱼粉和脱脂蓝圆鲹鱼粉的水分、灰分、蛋白质、脂肪等基本成分进行测定。其中水分的测定采用直接干燥法,具体操作按照国标GB 5009.3-2010食品中水分的测定[15];灰分的测定按照国标GB 5009.4-2010食品中灰分的测定[16];蛋白质测定采用凯氏定氮法,具体操作按照国标GB 5009.5-2010食品中蛋白质的测定[17];粗脂肪的测定按照国标GB 5009.6-2016食品中粗脂肪的测定[18]。
1.2.3 傅里叶变换红外光谱分析 采用溴化钾压片法[19],对脱脂蓝圆鲹鱼粉和蓝圆鲹鱼粉采用傅立叶变换红外光谱仪进行红外扫描分析。将样品置于40 ℃烘箱中充分干燥至恒重,取1 mg恒重样品与100 mg溴化钾混合研磨进行压片,以100 mg溴化钾磨碎进行压片作为空白背景,进行全波段(4000~400 cm-1)扫描,每次试验对信号进行32次扫描,分辨率为4 cm-1,扣除背景后得到红外光谱图。利用OMNIC数据处理软件校正,限制谱带范围为1600~1700 cm-1[20];用Peakfit软件将谱图进行两点基线校正,再进行二阶导数拟合。根据各指认峰积分面积计算出各种二级结构的相对百分含量。
1.2.4 圆二色谱测定 对脱脂蓝圆鲹鱼粉和蓝圆鲹鱼粉进行溶解,配制成浓度为0.2 mg/mL的样品溶液。设置圆二色仪器的温度为24.7 ℃,扫描范围为190~260 nm,将样品放置于1 mm的比色皿中,放入圆二色谱仪中进行扫描,得到去除背景的圆二色的光谱曲线[21]。
1.2.5 碱性蛋白酶酶解脱脂蓝圆鲹鱼粉制备抗氧化肽的研究
1.2.5.1 酶解工艺的单因素实验 以DPPH自由基清除率为指标,研究温度、pH、料液比和加酶量对酶解物DPPH自由基清除率的影响。
固定反应条件:料液比为1∶30 (w/v),加酶量为8000 U/g·pro,pH9.0,酶解时间为6 h,考察不同温度45、50、55、60、65 ℃对酶解物DPPH自由基清除率的影响。
固定反应条件:料液比为1∶30 (w/v),加酶量为8000 U/g·pro,温度为55 ℃,酶解时间为6 h,考察不同pH8.5、9.0、9.5、10.0、10.5对酶解物DPPH自由基清除率的影响。
固定反应条件:温度为55 ℃,加酶量为8000 U/g·pro,pH9.5,酶解时间为6 h,考察不同料液比1∶25、1∶30、1∶35、1∶40、1∶50 (w/v)对酶解物DPPH自由基清除率的影响。
固定反应条件:温度为55 ℃,料液比为1∶30 (w/v),温度为55 ℃,pH9.5,酶解时间为6 h,考察不同加酶量2000、4000、6000、8000、10000 U/g·pro对酶解物DPPH自由基清除率的影响。
1.2.5.2 酶解工艺的正交试验 在单因素试验的基础上,料液比、酶解温度、加酶量这三个因素是影响抗氧化指标的主要因素,选择确定的pH9.5,以DPPH自由基清除率为指标,设计L9(34)正交表,实验因素及水平见表1。
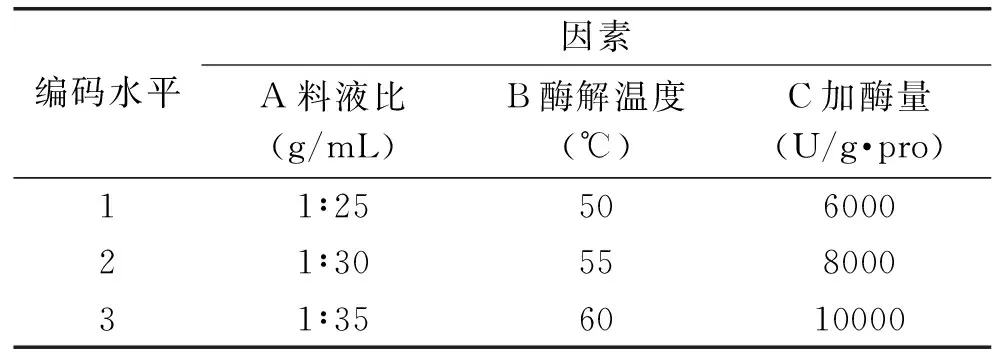
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experimental
1.2.6 DPPH自由基清除率的测定 参照Sampath等[22]的方法,并适当改进。吸取100 μL待测液于96孔板中,加入100 μL DPPH溶液(0.2 mmol/L,溶于95%乙醇),混合均匀后,于室温下避光放置30 min,随后在517 nm处测定其吸光值,记为A1,将100 μL DPPH溶液和100 μL 95%乙醇混合,其它操作同A1,记为A0;将100 μL待测液和100 μL 95%乙醇混合,其它操作同A1,记为A2;按照下式计算DPPH自由基清除率。
式中:A0表示100 μL 95%乙醇+100 μL DPPH溶液的吸光值;A1表示100 μL待测液+100 μL DPPH溶液的吸光值;A2表示100 μL待测液+100 μL 95%乙醇的吸光值。
1.3 数据处理
实验数据以均值±标准差来表示,采用SPSS 17.0统计软件进行单因素方差分析,Origin 8.5软件作图,peakfit软件处理傅里叶红外数据,CDNN分析圆二色谱数据。
2 结果与分析
2.1 基本成分分析
由表2可以看出,新鲜蓝圆鲹中主要为水分,约占原料中的77.87%,其余主要为蛋白质(17.17%)及脂肪(3.53%);而在对新鲜蓝圆鲹进行干燥后,蛋白质及脂肪成为原料中主要成分,约占80%~86%;脱脂蓝圆鲹鱼粉的主要成分为蛋白质(88.78%),显著高于新鲜蓝圆鲹(17.17%)及蓝圆鲹鱼粉(73.81%)样品中的蛋白质含量(p<0.05)。脱脂蓝圆鲹鱼粉中灰分为4.29%,显著高于新鲜蓝圆鲹中灰分(1.05%)含量(p<0.05),原因可能是蓝圆鲹在提取鱼油后其无机物如矿物质的含量残留多。上述结果说明,蓝圆鲹经低温连续相变技术提取鱼油后,其脱脂鱼粉富含蛋白质,可进一步综合利用。

表2 蓝圆鲹脱脂前后基本成分比较Table 2 Comparison of basic components before and after defatting of Decapterus maruadsi
2.2 傅里叶红外光谱分析
红外光谱的定量分析依据是比耳定律,由于不同基团振动频率的吸光度系数差异不同,故而不同基团的特征吸收峰就相差很大。因此傅里叶红外光谱可以用于测定物质特性及其相互作用,分析低温连续相变对蓝圆鲹蛋白质结构的影响,其傅里叶变换红外光谱分析如图1所示。
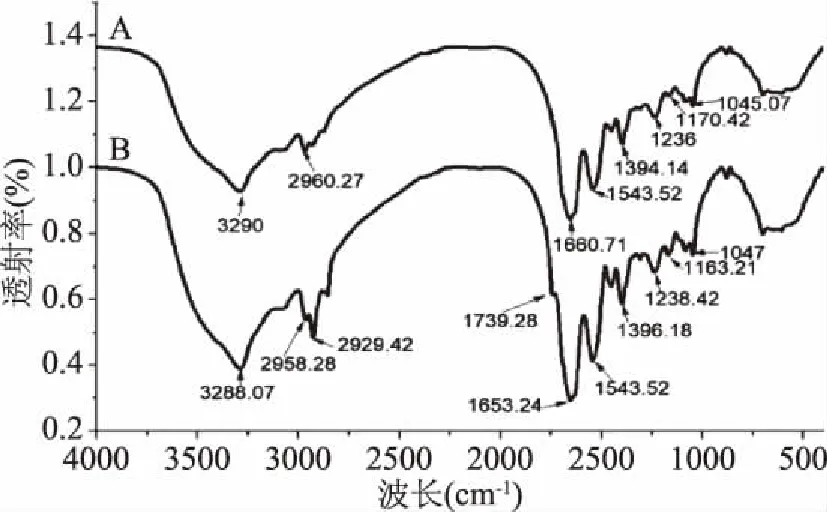
图1 蓝圆鲹鱼粉脱脂前后的红外光谱Fig.1 FT-IR spectrum of before and after defatting Decapterus maruadsi powder注:A:脱脂蓝圆鲹鱼粉;B:蓝圆鲹鱼粉。
通过红外光谱的扫描分析,可以显示出各物质的分子结构和具有特征性的化学键。从图1可以看出,蓝圆鲹鱼粉脱脂前的图谱与蓝圆鲹鱼粉脱脂后的图谱基本相似,主要区别就是特征峰的峰高和峰面积有所不同,它们两者都在3600~3100 cm-1范围内出现大波段吸收峰,说明里面都含有大量的具有伸缩振动的吸收峰-OH,由于-OH是个强极性基团,因此羟基化合物的缔合现象非常显著;1690~630 cm-1为C=O的伸缩振动吸收峰,由于氮原子上未共用电子对与羰基的键进行共轭,从而使其在此范围内有振动;1650~500 cm-1为N-H的面内弯曲振动吸收峰;1440~360 cm-1为-COO的对称伸缩振动,强度弱于反对称伸缩振动吸收,并且常是两个或三个较宽的峰。1330~1050 cm-1为C-O-C的对称伸缩振动吸收峰。1140~1030 cm-1为C-O的酯类伸缩振动吸收峰;在1250~800 cm-1范围内,是C-C的震动,特征性不强。与脱脂蓝圆鲹鱼粉相比,蓝圆鲹鱼粉在2929.42与1739.28 cm-1处有峰值的变化,在2975~2845 cm-1范围内是饱和的C-H伸缩振动,也包括甲基、亚甲基和次甲基的对称与不对称伸缩振动;在1740~1720 cm-1范围内,是羰基的伸缩振动。除此之外,其余的特征峰没有太大不同,只是峰面积不同。由此可以初步断定,蓝圆鲹鱼粉在经过低温连续相变技术脱脂后,其蛋白质结构没有发生变化。
肽键作为一种酰胺键,它在红外光区有其特征吸收峰。酰胺Ⅰ的吸收峰范围是1700~1600 cm-1;酰胺Ⅱ的吸收峰范围是1550~1450 cm-1;酰胺Ⅲ的吸收峰范围是1300~1200 cm-1[23]。在研究蛋白质构象的变化中,酰胺Ⅰ带主要包含了C=O的伸缩振动,这对蛋白质二级结构的变化十分敏感,对于研究蛋白质二级是否发生变化很有价值[24]。为了进一步研究低温连续相变技术对蓝圆鲹鱼粉中蛋白二级结构的影响,利用去卷积方法对酰胺Ⅰ带进行拟合,结果如图2~图3所示。

图2 蓝圆鲹鱼粉酰胺I带的红外(上)和高斯曲线拟合图谱(下)Fig.2 Decapterus maruadsi powder FTIR spectrum of amide I(up)and Gaussian multiple peaking fitting analysis for the peaks(down)
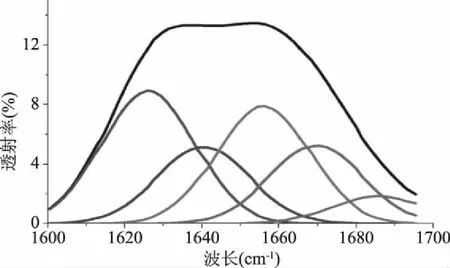
图3 脱脂蓝圆鲹鱼粉酰胺I带的红外(上)和高斯曲线拟合图谱(下)Fig.3 Defatted Decapterus maruadsi powder FTIR spectrum of amide I(up)and Gaussian multiple peaking fitting analysis for the peaks(down)
采用高红艳等[25]的谱带指认进行确定指认范围:1610~1640 cm-1为β-折叠;1650~1660 cm-1为α-螺旋;1640~1650 cm-1为无规则卷曲;1660~1695 cm-1为β-转角,谱带指认结果如表3所示。
由图2~图3和表3可知,蓝圆鲹鱼粉中的蛋白质包含四种结构:β-折叠、无规则卷曲、α-螺旋、β-转角。α-螺旋和β-折叠属于相对规则的构象,多数存在于蛋白质的内部,这两种结构中分布着较多的氢键,能与其它基团发生氢键键合,使得蛋白质的二级结构趋于规则,从而具有一定的刚性,β-转角和无规则卷曲中不存在氢键或其它相互作用,使分子表现出较大的柔性[26]。与蓝圆鲹鱼粉的蛋白相比,脱脂蓝圆鲹鱼粉的蛋白中β-折叠含量减小了0.52%,无规则卷曲减少了0.22%,α-螺旋增加了0.55%,β-转角增加了0.09%。有学者研究,在一般情况下,蛋白质会随着温度的改变,α-螺旋的含量会大幅度变化[27],而在经过低温连续相变技术提取鱼油之后,脱脂蓝圆鲹鱼粉的蛋白中α-螺旋仅增加了0.55%,说明在此温度条件下,蛋白质分子之间并没有发生反应,故而氢键作用力并没有被破坏[28]。经过低温连续相变提取鱼油之后得到的脱脂蓝圆鲹鱼粉,其蛋白的刚性结构从50.42%增加了50.55%,柔性结构从49.58%减少到49.45%,说明低温连续相变技术可以使蓝圆鲹蛋白的二级结构趋于规则,其刚性增加,稳定性也有明显提高。
2.3 圆二色光谱分析
圆二色谱(CD)是一种电子吸收光谱,也是研究溶液中蛋白质结构的一种比较快速且简单的方法,通过图谱可以得到其手性特征,可以根据在190~260 nm处的吸收值可以得出其内部的二级结构,该技术在食品中已广泛应用。将蓝圆鲹鱼粉溶液及脱脂蓝圆鲹鱼粉溶液放入圆二色谱仪中进行光谱扫描,结果如图4所示,从图4中可以得出,两者的CD谱图相差不大,在经过低温连续相变技术提取鱼油之后,脱脂蓝圆鲹鱼粉的蛋白保持了完整的三级结构,且结构没有发生明显变化。
经过CDNN软件分析得知,蓝圆鲹鱼粉及脱脂蓝圆鲹鱼粉的蛋白均含有四种二级结构,其组成如图5所示。从图中可以看出,蓝圆鲹鱼粉的蛋白二级结构包含有β-折叠、无规则卷曲、α-螺旋和β-转角四种。其中,在β折叠中,由于氢键几乎都垂直于伸展的肽链,这些肽链分为平行排列(走向由N到C方向),或者是反平行排列。蓝圆鲹鱼粉的蛋白反平行排列所占比例较高,说明蓝圆鲹鱼粉中的蛋白主要是由氢键进行连接的。从图5中可以看出,蓝圆鲹鱼粉在提取鱼油后其蛋白质二级结构中各比例基本处于不变的状态,说明其肽链中主链原子的局部空间排布没有发生改变,即空间构象没有变化,因而也从微观上验证了蓝圆鲹鱼粉在经过低温连续相变技术提取鱼油后,其蛋白质内部结构没有发生改变。

图5 蓝圆鲹鱼粉脱脂前后的蛋白质二级结构所占比例Fig.5 Proportion of the secondary structure of before and after defatting Decapterus maruadsi powder注:不同字母表示差异显著(p<0.05);图6~图9同。
2.4 脱脂蓝圆鲹鱼粉的酶解单因素实验结果
2.4.1 温度对酶解液DPPH自由基清除率的影响 由图6可知,随着温度的增加,酶解液中的DPPH自由基清除率呈现先增加后下降的趋势,在温度为55 ℃下达到最大值(85.67%),超过55 ℃时,其清除率呈现下降的趋势(p<0.05)。这表明在酶促反应中,酶分子不断吸收能量,当温度持续升高,酶分子的次级键因吸收过多能量而断裂,导致酶蛋白结构变性,酶活性丧失,并且蓝圆鲹蛋白自身也发生变性,使得生成的抗氧化肽减少,DPPH自由基清除率降低[29];同时温度从55 ℃上升至70 ℃,导致已生成的具有较好抗氧化活性多肽被降解,抗氧化活性变弱,从而致使DPPH自由基清除率下降[30]。张建贺等[31]在利用碱性蛋白酶酶解苜蓿叶蛋白时得到同样的结果,当酶解温度为55 ℃时,得到的苜蓿叶蛋白抗氧化肽的DPPH自由基清除率最高。因此,选择酶解温度为55 ℃。
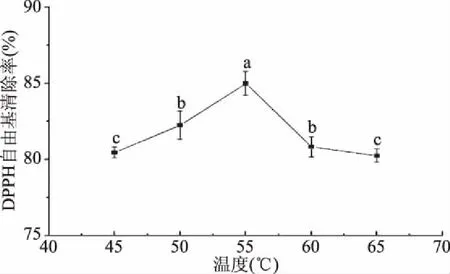
图6 温度对酶解物DPPH自由基清除率的影响Fig.6 Effect of temperature on DPPH free radical scavenging rate of enzymatic hydrolysate
2.4.2 pH对酶解液DPPH自由基清除率的影响 碱性蛋白酶的最适pH范围是8~10,其催化能力与环境的pH有密切关系,而pH的变化也会影响酶反应中酶分子和底物之间的解离状态,从而影响酶解反应速率[32-33]。由图7可知,酶解液的DPPH自由基清除率随着pH的增加而呈现先增加后降低的趋势,在pH为9.5时达到最大值(85.89%),但在pH为9.0~10.0之间的值差异不显著(p>0.05)。说明当pH大于9.5时,碱性蛋白酶的活性降低,导致酶的催化效率下降,降低DPPH自由基清除率。因此,选择pH9.5为最佳酶解pH。

图7 pH对酶解物DPPH自由基清除率的影响Fig.7 Effect of pH on DPPH free radical scavenging rate of enzymatic hydrolysate
2.4.3 料液比对酶解液DPPH自由基清除率的影响 料液比的不同,对酶反应的最佳结果也不尽相同。由图8可知,随着料液比的增加,酶解液中的DPPH自由基清除率呈现先增加后降低的趋势,且在料液比为1∶30 (w/v)达到最大值(86.87%),与其他料液比条件下的值相比有显著性差异(p<0.05)。由于初始底物浓度过高,过量的底物大量集聚在酶分子表面,降低酶解的效率,DPPH自由基清除率低;当料液比为1∶30 (w/v)时,底物浓度适中,酶的催化效率最高,DPPH自由基清除率最高;而当液体的量逐渐增加时,底物浓度和酶的浓度都在降低,使酶解效率下降[34],从而导致DPPH自由基清除率又下降。因此,确定酶解的最佳料液比为1∶30 (w/v)。

图8 料液比对酶解物DPPH自由基清除率的影响Fig.8 Effect of ratio of water to material on DPPH free radical scavenging rate of enzymatic hydrolysate
2.4.4 加酶量对酶解液DPPH自由基清除率的影响 一般认为,酶反应过程中加酶量的不同,其反应速度也呈现相应的变化,且成正相关的变化。由图9可知,在加酶量为4000~6000 U/g·pro范围内,随着加酶量的增加,DPPH自由基清除率增加差异不明显(p>0.05),当加酶量为8000 U/g·pro时,酶解液中的DPPH自由基清除率达到最大值(86.67%)。结果表明,当底物浓度足够大时,酶促反应速率随着加酶量的增加而增加。当酶浓度增大到一定浓度时,反应体系中底物消解达到饱和,酶解效率将不再上升甚至会降低。同时,过多的酶会酶解生成的多肽,与蛋白质竞争蛋白酶的作用位点,进而被水解为寡肽或氨基酸,所以当加酶量增加到8000 U/g·pro时,酶解液的DPPH自由基清除率开始下降,由此可推断具有较强抗氧化活性的多肽其氨基酸构成较多,而非寡肽或氨基酸[34]。因此,选择最适加酶量为8000 U/g·pro。
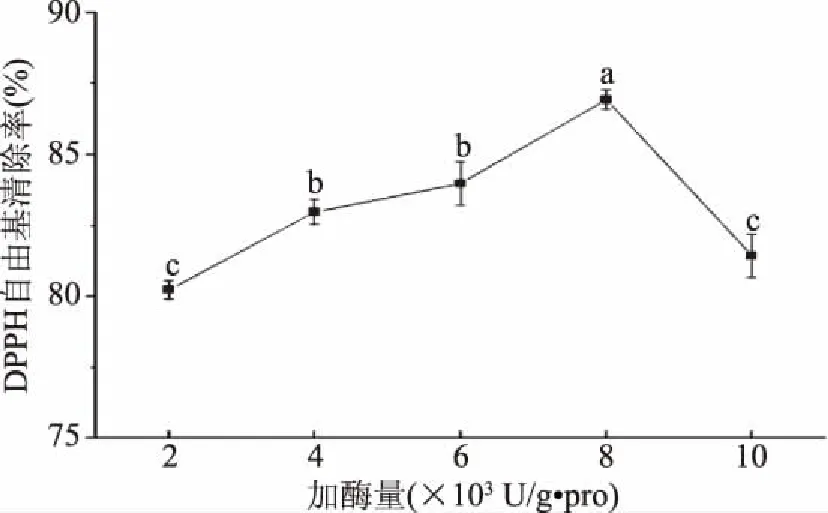
图9 加酶量对酶解物DPPH自由基清除率的影响Fig.9 Effect of the amount of enzyme on DPPH free radical scavenging rate of enzymatic hydrolysate
根据单因素实验结果,料液比、温度和加酶量是影响蓝圆鲹抗氧化肽DPPH自由基清除率的主要因素。从图7中可看出,在pH分别为9.0、9.5和10.0时,DPPH自由基清除率没有显著性差异,但在pH9.5时自由基清除率最高。故选取确定的pH9.5,选择料液比、温度和加酶量三个因素进行正交试验优化。
2.5 正交实验结果及方差分析
为了得到DPPH自由基清除率最高的脱脂蓝圆鲹鱼粉的蛋白酶解物,在碱性蛋白酶酶解单因素结果的基础上,对其进行最适水解条件的优化,选择料液比(A)、酶解温度(B)、加酶量(C)三个因素为考察指标,采用L9(34)正交试验设计,确定酶解时间为6 h,pH为9.5,进行抗氧化肽的最佳酶解工艺优化,正交试验结果见表4。
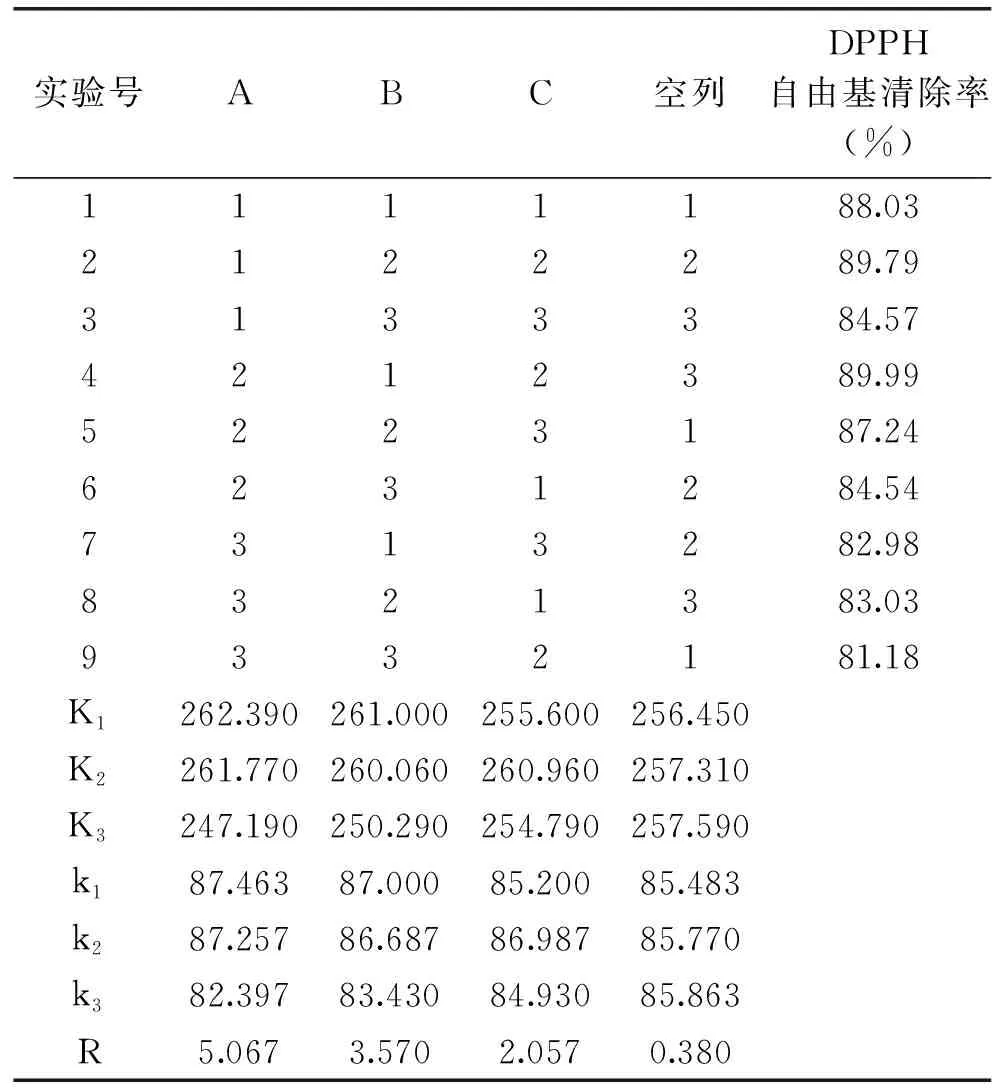
表4 L9(34)正交试验结果表Table 4 L9(3)4 orthogonal experiment result table
由正交试验结果可知,不同因素对酶解液中抗氧化活性的影响为:A>B>C。以DPPH自由基清除率为指标,得出最佳的酶解方案为A1B1C2,即在酶解料液比为1∶25 (w/v),酶解温度为50 ℃,加酶量为8000 U/g·pro时,在此条件下的DPPH自由基清除率最高,达到89.99%±0.13%,因此选择此条件进行酶解制备脱脂蓝圆鲹抗氧化肽。
3 结论
本文首次研究了采用低温连续相变萃取技术提取蓝圆鲹鱼油后萃取残渣的基本成分和蛋白质内部结构变化,并利用碱性蛋白酶酶解制备蓝圆鲹抗氧化肽。红外光谱图结果显示,蓝圆鲹鱼粉在脱脂后,其蛋白质二级结构中的刚性结构与柔性结构与未脱脂相比变化不大,且使得蛋白质内部结构趋于稳定的状态;而圆二色的结果进一步表明,脱脂蓝圆鲹鱼粉中的蛋白质内部的α-螺旋、β-转角、β-折叠及无规卷曲含量并未发生明显变化,因此也验证了该提取技术对蓝圆鲹蛋白的二级结构并没有影响。采用碱性蛋白酶对脱脂蓝圆鲹鱼粉进行酶解制备抗氧化肽,通过正交试验优化,得到最佳酶解工艺条件:料液比为1∶25 (w/v),酶解温度为50 ℃,加酶量为8000 U/g·pro时,在此条件下酶解物的DPPH自由基清除率最高,达到89.99%±0.13%。由此可知,利用低温连续相变技术提取蓝圆鲹鱼油后,其萃取残渣的蛋白质结构与活性没被破坏,使残渣得到综合利用,提高蓝圆鲹的加工价值,为进一步研究蓝圆鲹蛋白的结构与其生物活性功能奠定了基础。
