栀子药材不同干燥方法水分动态过程模拟及其对多元活性成分的影响
2019-08-26王小浩朱邵晴巢建国
王小浩,朱邵晴,谷 巍,巢建国,刘 琪,田 荣,周 晨,王 帆
(南京中医药大学药学院,江苏南京 210023)
栀子为茜草科栀子属植物栀子(GardeniajasminoidesEllis.)的干燥成熟果实,栀子药用始载于《神农本草经》,为临床常用中药,有泻火除烦、清热利湿、凉血解毒之功效[1]。具有保肝利胆[2-3]、抗凝血与血栓形成[4]、抗氧化[5]、抗炎镇痛[6]等药理活性。栀子为药食同源品,列于卫生部发布的“既是食品又是药品的物品名单”。栀子采收后的传统干燥方法一般为入水中煮沸3~5 min捞出晒干以及蒸汽蒸3~10 min后晒干[7]。存在干燥耗时较长,易受天气、环境条件影响、没有定性标准、不适合中药材产业化生产,且易致使有效性成分结构破坏,影响其品质等弊端。
近年来,有关栀子的研究多集中在化学成分及药理作用方面,有关干燥领域的研究较少。干燥技术作为中药产地加工的重要细节,直接影响中药材产品的疗效与品质。目前现代干燥设备与技术逐渐运用于中药材的加工生产,且其具有更高效、集约的优势,代表性的干燥方法如微波、红外、真空及冷冻干燥。微波干燥物料内部水分迁移方向与热量传递方向一致,因此干燥物料不易龟裂皱缩[8];中短波红外干燥干燥效率高、能耗较低、其加热过程中脱水与灭酶同步进行[9];远红外干燥穿透力强,物料干燥速度内部略大于外部,表面致密层不易形成[10];真空干燥过程温度梯度、压强梯度、浓度梯度同时作用于物料内部水分的迁移,使干燥物料能在相对较低的温度条件下脱水,其所得干制品品质更高[11]。Weibull分布函数具有适用性广、覆盖性宽的特点,通过分析拟合参数能够掌握干燥过程的水分扩散机制、能量消耗等信息。当前,Weibull分布函数在中药材干燥中的应用也愈加广泛,黄敬[12]、王鹤[13]、朱邵晴[14-15]利用Weibull函数分别对百合、枸杞子、当归、党参的干燥动力学特性进行研究。
鉴于此,本研究开展栀子药材现代干燥加工方法研究,对其干燥过程水分动态变化进行数学拟合,计算栀子干燥过程的有效扩散系数和活化能,并探讨不同加工方法及加工温度对栀子活性成分含量的影响,从水分脱除及有效性成分含量两种角度评价不同干燥方法栀子的品质,以期为新鲜栀子干燥加工的预测、调控、评价提高依据。
1 材料与方法
1.1 材料与仪器
栀子新鲜药材 于2017年11月采自江西省元宝山农业发展有限公司种植基地(江西鄱阳),经南京中医药大学谷巍教授鉴定为茜草科植物栀子GardeniajasminoidesEllis的果实;西红花苷Ⅰ(批号:lw16070301)、西红花苷Ⅱ(批号:lw16030602)、栀子苷(批号:lw16052902)、京尼平-1-β-龙胆二糖苷(批号:lw16021804) 购自南京良纬生物科技有限公司,纯度均大于98%;甲酸 色谱级,上海阿拉丁生化科技股份有限公司;乙腈、甲醇 色谱级,德国Merck公司;超纯水 自制。
e2695高效液相色谱仪 美国Waters公司;2998 PDA光电二级管矩阵检测器 美国Waters公司;FA1104N电子分析天平 上海精密仪器有限公司;3-18k高效冷冻离心机 德国Sigma公司;CG-9160多功能研磨机 中山长柏电器实业有限公司;SAK-W04805隧道式中短波红外干燥机 江苏泰州圣泰科红外科技有限公司;DZF-6050真空干燥箱 上海一恒科学仪器有限公司;DHG-9240电热恒温鼓风干燥箱 上海精宏实验设备有限公司;EPED-10TF超纯水器 南京易普易达科技发展有限公司;KQ250E超声波清洗器 上海沪粤明科学仪器有限公司。
1.2 实验方法
1.2.1 干燥方法 取栀子新鲜药材20 kg,清洗晾干1 d后,混合均匀,平均分成9份,称重,将9份栀子样品分别放入蒸锅,蒸汽杀青10 min后(本实验水分比计算以晾干杀青后原料的水分比为100%计算),开启电热恒温鼓风干燥箱、中短波红外干燥机、真空干燥箱,分别调节温度50、60、70 ℃,真空干燥箱压力设为-20 kPa,待温度稳定后放入物料,记录干燥时间。干燥温度为70 ℃时,每30 min左右取出称重;干燥温度为60 ℃时,每1.5 h左右取出称重,其中,60 ℃真空干燥开始时每1.5 h左右取出称重,干燥20 h后每5 h左右称重;干燥温度为50 ℃时,因干燥时间过长,干燥开始时每2 h取出称重,干燥20 h后每5 h左右称重,干燥30 h后每隔10 h作用称重。记录时间与重量,待湿基含水率降至10%时,停止干燥。具体干燥实验参数见表1。
1.2.2 干燥参数的计算方法 栀子干燥过程中的干燥曲线采用水分比(MR,moisture ratio)随干燥时间变化的曲线表示,MR用于表示一定干燥条件下不同干燥时刻的物料含水量,可以用来反映物料干燥速率的快慢,不同干燥时刻栀子的水分比MR按式(1)计算:
式(1)
式中,M0为初始干基含水率,g/g;Me为干燥至平衡时的干基含水率,g/g;Mt为在任意干燥t时刻的干基含水率,g/g。干基含水率Mt按式(2)计算:
式(2)
式中,Wt为在任意干燥t时刻的总质量,g;G为干物质质量,g。
干燥速率(DR,drying rate)按照式(3)计算:
式(3)
式中,Mt1为t1时刻的干基含水率,g/g;Mt2为t2时刻的干基含水率,g/g。
1.2.3 Weibull函数对干燥曲线的模拟 用于干燥曲线模拟的Weibull分布函数由式(4)表示:
式(4)
式中,α与β为与干燥介质相关的经验常数,分别定义为尺度参数α和形状参数β。利用决定系数R2、均方根误差RMSE、离差平方和χ2来衡量拟合程度,计算公式为:
式(5)
式(6)
式(7)
式中,MRexp,i为干燥实验实测水分比;MRpre,i为利用模型预测水分比;N为实验测得数据得组数;n为函数中参数得个数,其值为2。
如果物料干燥过程属于降速干燥,则干燥过程的水分有效扩散系数Deff(moisture diffusion coefficient)可用Fick第二定律计算,即按式(8)计算:
式(8)
式中,Deff为干燥过程中物料的水分有效扩散系数,m2/s;L为体积等效半径,本研究采用栀子材料品种近球形,其值为6×10-3m;t为干燥时间,s。对L、lnMR与t进行线性回归,由斜率可计算出Deff。
如果物料干燥过程前期存在一个延滞阶段,则可用估算水分有效扩散系数Dcal(calculated moisture diffusion coefficient)代替,计算公式如下:
式(9)
式中,Dcal表示估算水分有效扩散系数,m2/s;L表示栀子体积等效半径,m;α表示尺度参数,min。
估算的水分有效扩散系数Dcal与水分有效扩散系数Deff存在关系式:
式(10)
式中,Rg是一个与几何尺寸相关的系数。
干燥温度对有效扩散系数的影响关系可用Arrhenius关系式表述,计算公式为:
式(11)
式中,D0为Arrhenius方程的指数前因子,为定值,m2/s;Ea为物料的干燥活化能,kJ/mol;R为摩尔气体常数;T为干燥物料的温度, ℃。
将式(9)带入式(10),可得到:
式(12)
1.2.4 有效性化学成分含量测定方法 将9种已经干燥完成的栀子样品投入研磨机中打粉,过80目筛。测定样品中栀子苷、西红花苷Ⅰ、西红花苷Ⅱ、京尼平-1-β-龙胆二糖苷四种活性性成分含量。
1.2.4.1 对照品溶液的制备 精密称取各对照品适量,加50%甲醇溶解,配制成质量浓度分别为0.2532、0.07273、0.05165、0.20253 mg/mL的栀子苷、西红花苷Ⅰ、西红花苷Ⅱ、京尼平-1-β-龙胆二糖苷的混合对照品储备液。对照品溶液在注入液相色谱仪前经0.22 μm的微孔滤膜滤过,混合对照品储备液在-80 ℃条件下贮藏,西红花苷Ⅰ、西红花苷Ⅱ对照品储备液在-80 ℃条件下贮藏,其余对照品储备液均在4 ℃条件下贮藏。制作标准曲线时将混合对照品储备液放入水浴锅中设置温度30 ℃解冻20 min后使用。
1.2.4.2 供试品溶液的制备 精密称取栀子药材粉末(过80目筛)约0.1 g,置具塞锥形瓶中,精密加入50%甲醇25 mL,称定重量,50 ℃超声处理40 min,放置冷却,再用50%甲醇补足失重,摇匀,过滤。取续滤液1 mL于5 mL量瓶中,用50%甲醇稀释并定容至刻度,10000 r/min离心2 min,即得供试品溶液。重复三次进样。
1.2.4.3 色谱条件 YMC-Pack ODS-A色谱柱(250 mm×4.6 mm,5 μm),柱温30 ℃,流速0.8 mL/min,流动相乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~15 min,5%~10% A;15~30 min,10%~15% A;30~37 min,15%~23% A;37~52 min,23%~35% A;52~60 min;35% A~60% A)。检测波长238、440 nm,进样体积10 μL。
1.3 数据处理
上述实验数据均重复三次测定后取平均值,曲线拟合和TOPSIS分析采用SPSS 22.0及DPS 9.50数据处理软件,其余数据分析在OFFICE 2003中完成,绘图采用PHOTOSHOP CS6软件。
2 结果与分析
2.1 不同干燥方法及干燥温度对栀子干燥特性影响
由图1可知,栀子采用热风干燥、真空干燥及红外干燥在不同温度下干燥水分比-时间曲线呈现相似规律,随着干燥温度提高,干燥至目标含水量所需时间减小。其可能原因是升高干燥温度,能量通过干燥介质传递到被加热的物料上,物料内部温度积累快,有利于物料内部水分向外扩散,从而加速水分的蒸发与扩散[16]。红外干燥相对于真空干燥与热风干燥整体干燥时间缩短(在50、60、70 ℃温度下,真空干燥时间分别为92.3、51.6、23.8 h,热风干燥为65.6、30.4、25.3 h,红外干燥为51.2、24.5、20.0 h),可能与红外干燥辐射加热快,栀子果实内部升温快,进入降速阶段较快有关。

图1 不同干燥温度对水分比影响Fig.1 Effect of different temperatures on water content 注:a.热风干燥水分比曲线;b.真空干燥水分比曲线; c.红外干燥水分比曲线。
由图2a与图2b可知,真空干燥与热风干燥干燥速率随时间变化呈先增高后降低的趋势,这可能由于在热风与真空干燥刚开始时,栀子表面与干燥箱内部有较大的温度差,栀子果实表面温度低于干燥箱环境温度,其存在的温度梯度使栀子表面存在的自由水急剧向外扩散,在此过程中,栀子果实表面与内部形成一定程度的湿度梯度,与此同时,干燥环境温度向栀子果实内部传递,栀子内部温度升高,在温度梯度与湿度梯度双向作用下,栀子自由水向外扩散效率达到最大值[17],其干燥速率也达到最大值,因此形成图2a与图2b所示的升速并达到最高干燥速率的阶段。随着干燥过程进行,栀子内部温度与箱内温度趋于一致,温度梯度的作用减小,此时栀子干燥的动力源主要为栀子内部与表面的湿度梯度,而随着干燥进行栀子中自由水减少,湿度梯度也变弱,由此干燥速率也逐渐下降,最终归于零。而图2c显示出,红外干燥属于降速干燥,与真空干燥及热风干燥不同,红外干燥穿透力强,栀子果实内部果实升温快,由于温度梯度与湿度梯度双向作用导致的升速阶段时间较短,甚至在称重间隔30 min难以观测其升速阶段,直接进入降速阶段。

图2 不同干燥温度对干燥速率的影响Fig.2 Effect of different temperatures on drying date注:a.热风干燥速率曲线;b.真空干燥速率曲线; c.红外干燥速率曲线。
2.2 采用Weibull分布函数模拟干燥曲线
Weibull分布函数中的尺度参数α值约等于干燥过程中MR下降至37%时所需的时间,表示干燥过程的速率常数[18],以min表示。随着干燥温度升高,热风干燥法α值由1395.5 min下降至577.44 min;红外干燥法α值由1104.6 min下降至389.5 min;真空干燥法α值由3797.8 min下降至572.1 min。α值受干燥温度影响明显,温度升高,α减小,说明升高温度可以显著缩短干燥时间、提高干燥效率[15]。在相同干燥温度条件下,比较不同干燥方法下的α值,其高低依次为真空干燥>热风干燥>红外干燥,其中在50 ℃干燥温度条件下,红外干燥干燥过程完成63%所花费的时间比真空干燥缩减2693.16 min;60 ℃干燥温度条件下缩减561.78 min;70 ℃干燥温度条件下缩减182.64 min。这说明,当温度提高时,由不同干燥方法导致的α值差异会变小。
形状参数β与物料在传质过程中开始阶段的速率有关,β值在0.3~1时,物料干燥过程由内部水分扩散控制,表现为降速干燥的特点,β值大于1时,表明物料干燥前期存在滞后阶段,即在干燥前期出现干燥速率先增高后下降的情况。
表2显示,红外干燥β值范围为0.710~0.924;真空干燥β值范围为1.113~1.352;热风干燥β值范围为1.063~1.178。形状参数β与干燥方式、物料种类和状态有关,真空干燥与热风干燥β值都大于1,说明这两种干燥方式下栀子干燥前期有滞后阶段,而红外干燥β值小于1,属于降速干燥。其原因与红外辐射加热原理有关,辐射加热传透力强,物料内部温度升温快,传质阻力小,其干燥过程由内部水分扩散控制。以上说明干燥方式对形状参数β有较大影响,而干燥温度对其影响较小。

表2 Weibull分布函数模拟栀子干燥过程模型参数值及R2、RMSE、χ2Table 2 Parameter values of Gardenia jasminoides Ellis drying curves modeled by Weibull distribution function
决定系数R2的取值区间为0.9936~0.9994、均方根误差RMSE取值区间为5.892×10-3~3.047×10-2、离差平方和χ2取值区间为8.05410-6~1.061×10-3。由此可见,Weinull分布函数可准确描述栀子经不同干燥方法及温度处理的干燥曲线。
2.3 栀子干燥过程中有效扩散系数与干燥活化能
干燥过程中的水分有效扩散系数是表征干燥过程特征的重要值,当β属于0.3~1时,采用式(7)计算水分有效扩散系数Deff,当β大于1时,Fick公式不适用,采用式(8)计算估算水分有效扩散系数Dcal。根据表3,栀子药材水分有效扩散系数Deff在1.765×10-10~5.749×10-10m2/s之间变化;估算水分有效扩散系数Dcal在0.632×10-10~6.162×10-10m2/s之间变化。相同干燥方法条件下,栀子药材水分有效扩散系数与估算水分有效扩散系数随着干燥温度升高而增大,其规律与参数α变化规律相似。计算得出栀子药材Rg范围在9.250~12.306。

表3 栀子干燥过程水分有效扩散系数Table 3 Moisture effective diffusion coefficients of Gardenia jasminoides Ellis during drying
干燥活化能表示物料在干燥过程中脱除单位水分所需的能量,通过干燥活化能可反映物料干燥难易程度及能耗。干燥活化能越大,表明其越难干燥,能耗越大。真空干燥与热风干燥因为无法直接计算Deff,,可利用式(11),估算水分有效水分系数的自然对数lnDcal与1/(T+273.15)呈线性关系,其斜率为(-Ea/R),由斜率可计算出干燥活化能Ea,见图3;红外干燥可利用式(10),利用lnDeff与1/(T+273.15)的线性关系,同理求出干燥活化能Ea,见图4。栀子热风干燥、红外干燥、真空干燥的干燥活化能分别为40.74、54.73、87.46 kJ/mol,表明脱出同等量水分热风干燥所需能量最低,真空干燥所需能量最高。干燥活化能是物料的本质属性,与物料的品种、成分与组织有关[19],不同干燥方式干燥活化能不同,可能与不同干燥方式对物料内部组织结构有不同影响有关[20]。此外,图3中两直线交点处的意义为,在该温度下,栀子热风干燥与真空干燥完成63%干燥过程、参数α、Dcal值完全相同,此温度值为68.64 ℃,表明在该温度以下,热风干燥不仅干燥速率大,且干燥活化能比真空干燥小,在该温度以上,真空干燥干燥速率比热风干燥大,干燥活化能也较小。

图4 红外干燥水分有效扩散系数与干燥温度的关系曲线Fig.4 The relation curve between Deffand drying temperture in infrared drying method

图3 真空干燥、热风干燥估算水分有效扩散系数与干燥温度的关系曲线Fig.3 The relation curve between Dcal and drying temperture in vacuum drying and air drying methods
2.4 栀子活性成分含量测定研究
本研究基于高效液相色谱技术,建立了同时测定栀子苷、西红花苷Ⅰ、西红花苷Ⅱ、京尼平-1-β-龙胆二糖苷四种活性成分的分析方法,并对其进行方法学考察,代表性色谱见图5。

图5 栀子及其对照品HPLC图Fig.5 HPLC chromatograms of Gardenia jasminoides Ellis and the standards注:1.京尼平-1-β-龙胆二糖苷;2.栀子苷;3.西红花苷Ⅰ;4.西红花苷Ⅱ;A:混合对照品(238 nm);B:样品(238 nm);C:混合对照品(440 nm);D:样品(440 nm)。
2.4.1 线性范围 将1.2.4.1项下配制的不同浓度的混合对照品,分别稀释50、100、200、500、1000、5000倍。按1.2.4.3项所述色谱条件分别进样10 μL,对照品的浓度为横坐标,峰面积的积分值为纵坐标。绘制标准曲线,结果见表4。

表4 各对照品线性关系及范围Table 4 Linear regression data,determination coefficients and linear ranges of the standard compounds
2.4.2 精密度试验 取1.2.4.1项下配制的不同浓度的混合对照品,按1.2.4.3项所述色谱条件连续进样6次,计算各对照品成分的峰面积的RSD,结果栀子苷、西红花苷Ⅰ、西红花苷Ⅱ和京尼平-1-β-龙胆二糖苷的RSD(n=6)为0.96%、1.5%、0.64%、1.7%。结果说明仪器精密度良好。
2.4.3 重复性试验 精密称取同一样品6份,按1.2.4.2项下配制供试品溶液,按1.2.4.3项色谱条件进样。结果栀子苷、西红花苷Ⅰ、西红花苷Ⅱ和京尼平-1-β-龙胆二糖苷的RSD(n=6)分别为1.3%、0.95%、1.4%、1.6%。说明方法的重复性良好。
2.4.4 稳定性实验 取编号为1的样品,按1.2.4.2项下配制供试品溶液,按1.2.4.3项色谱条件下于0、2、4、8、10、16、24、36 h测定,测得峰面积RSD(n=6)分别为栀子苷 0.8%、西红花苷Ⅰ 0.7%、西红花苷Ⅱ 0.6%、京尼平-1-β-龙胆二糖苷1.3%。表明供试品在36 h内稳定性良好。
2.4.5 加样回收率试验 取已知含量的栀子样品共六份,每份0.1 g,精密称定,分别精密加入一定量的四个对照品,按1.2.4.2项下配制供试品溶液,按1.2.4.3项色谱条件进样。测得样品中栀子苷、西红花苷Ⅰ、西红花苷Ⅱ和京尼平-1-β-龙胆二糖苷的平均回收率(n=6)为98.23%、97.40%、98.25%、97.37%。RSD分别为1.2%、1.7%、0.8%、1.4%。
2.4.6 各样品含量测定 取新鲜样品及九种不同干燥方法及温度条件下干燥完成的栀子样品,磨成粉末后,取各粉末0.1 g,按1.2.4.2项下配制供试品溶液,按1.2.4.3项色谱条件进样,每批平行测定三次。记录峰面积,按回归方程计算各成分质量分数。
从表5可知,新鲜样品中京尼平-1-β-龙胆二糖苷、西红花苷Ⅰ和西红花苷Ⅱ含量较低于干燥后的样品,可能是由于干燥过程中其他物质会转化成这三种成分。随着干燥温度从50 ℃上升至70 ℃,京尼平-1-β-龙胆二糖苷、西红花苷Ⅰ和西红花苷Ⅱ的含量有较明显升高趋势。可能是由于干燥温度升高,抑制了栀子中某些酶的活性,从而起到杀酶保苷作用。另外,红外干燥相对有利于栀子苷、西红花苷Ⅰ和西红花苷Ⅱ三种成分的保留,真空干燥有利于京尼平-1-β-龙胆二糖苷的保留。
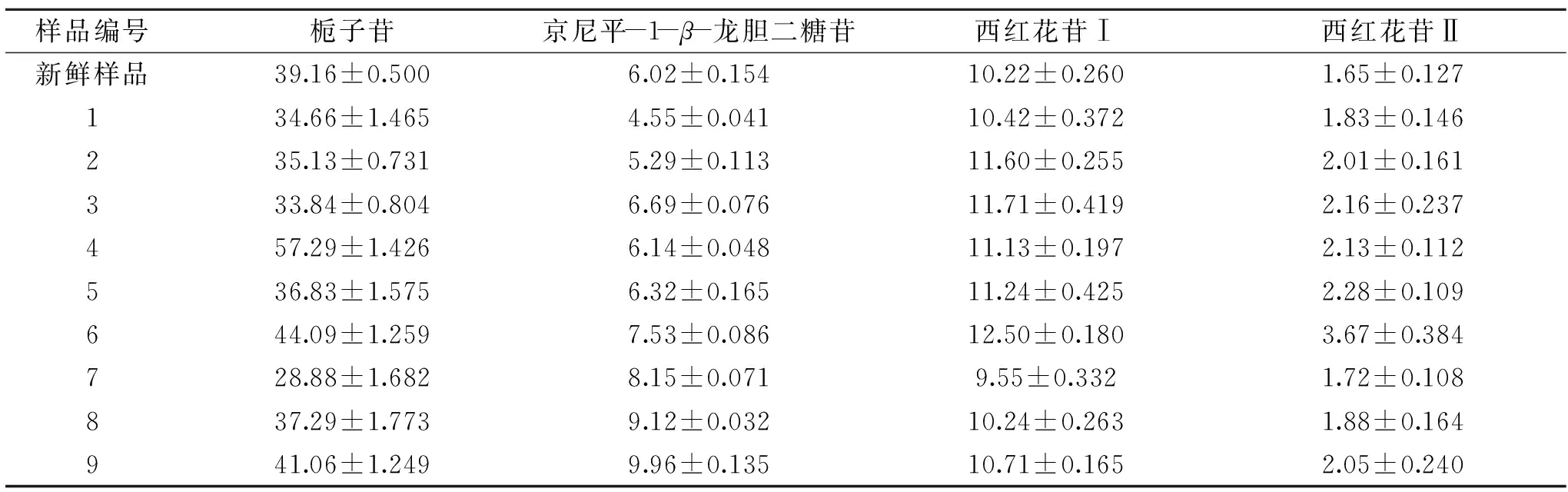
表5 样品测定结果(mg·g-1)Table 5 Determination of contents in samples(mg·g-1)
2.4.7 TOPSIS综合评价 采用TOPSIS综合分析法,该方法通过各干燥方法与理想解之间的加权欧式距离D+与D-,从而得到各干燥方法与理想方案的相对接近度Ci作为评判标准。以四种活性成分作为评价指标,对不同干燥方法及温度下的样品进行评价。结果见表6。

表6 TOPSIS综合评价结果Table 6 Comprehensive evalution results by TOPSIS
由表6综合评价结果可知,50 ℃红外干燥方法得到的栀子样品内在品质最高,其次为70 ℃红外干燥方法所得样品。
3 结论
本研究表明Weinull分布函数可准确描述栀子经不同干燥方法及温度处理的干燥曲线。同时探讨了不同干燥温度与干燥方式对干燥速率、尺度参数α、形状参数β、干燥活化能等描述干燥机理的参数的影响,由结果可知,红外干燥属于降速干燥,计算所得形状参数β值小于1,热风干燥与真空干燥干燥过程先升速后降速,形状参数β值大于1;尺度参数α值随着干燥温度升高而升高,且当干燥温度提高时,由干燥方式导致的α值差距会缩小,说明干燥温度对尺度参数α值的影响占主导作用;干燥活化能计算结果显示,3种干燥方式干燥活化能排序为真空干燥>红外干燥>热风干燥,同时测定九种干燥样品中西红花苷Ⅰ、西红花苷Ⅱ、京尼平-1-β-龙胆二糖苷、栀子苷的含量,并以这四种成分含量作为评价指标,进行TOPSIS评价。结果表明,提高干燥温度(70 ℃)有利于西红花苷Ⅰ、西红花苷Ⅱ、京尼平-1-β-龙胆二糖苷三种成分的保留;干燥过程可能会促使栀子中一些其他成分转化为西红花苷Ⅰ、西红花苷Ⅱ及京尼平-1-β-龙胆二糖苷。基于活性成分综合评价结果显示,50 ℃红外干燥方法得到的样品品质较佳,综合考虑干燥时间与干燥能耗,70 ℃红外干燥方法可作为栀子药材的适宜干燥方法。
