GCMS分析牛樟芝多糖的单糖组成及其抗氧化活性
2019-08-26杨彬君龚业滔吴岩斌吴锦忠吴建国
杨彬君,易 骏,龚业滔,吴岩斌,吴锦忠,吴建国,*
(1.福建中医药大学药学院,福建福州 350122; 2.福建教育学院理科部,福建福州 350001)
牛樟芝(AntrodiacinnamomeaT. T. Chang & W. N. Chou)又名樟芝、樟菇、牛樟菇、红樟芝、血灵芝,属担子菌门菌蔁纲无褶菌目多孔菌科薄孔菌属。牛樟芝是珍贵的药用大型真菌,野生牛樟芝仅生于台湾特有树种牛樟树干腐朽心材内壁[1]。牛樟芝在台湾民间已有200多年的应用历史,主要用于解酒、解食物中毒、止腹泻和止吐作用等。目前已从牛樟芝中分离得到的化学成分逾百种,主要有多糖、三萜、马来酸衍生物、安卓奎诺尔等化学成分[2]。
现代药理学研究表明牛樟芝多糖具有多种生物活性,包括抗肿瘤[3]、抗炎[4]、抑制血管生成[5]、抗感染[6]、改善免疫功能[7]、调节血糖血脂[8]、保肝[9]等多种功效。多糖具有复杂的化学结构及丰富的生物活性,由于多糖结构复杂,通常对提取得到的粗多糖水解为单糖后再进行检测分析[10],常用的方法主要有高效液相色谱法(HPLC),薄层色谱法(TLC),气相色谱法(GC)、高效阴离子交换色谱安培检查法(HPAEC-AED)等方法,其中,TLC法灵敏度低,分离效果较差;HPAEC-AED法价格昂贵,酸水解的多糖降解不彻底影响定量分析,目前,HPLC和GC法应用较为广泛,具分离速度快、分离效果好,重现性好等优点[11]。Su等[12]采用PMP柱前衍生化法,通过HPLC检测结果发现牛樟芝多糖的单糖组成为岩藻糖、半乳糖、葡萄糖、甘露糖、鼠李糖、木糖。目前,尚未发现GC-MS法检测牛樟芝多糖单糖组成的相关报道。
本实验以水提醇沉法提取牛樟芝多糖,利用紫外可见分光光度法测定多糖的总糖含量;首次应用GC-MS分析多糖的单糖组成;最后,评价多糖对DPPH、ABTS和OH自由基的清除能力,旨在为牛樟芝的开发和质量控制提供一定的参考。
1 材料与方法
1.1 材料与仪器
牛樟芝子实体 由汕头市君研生物科技有限公司提供,经吴锦忠教授鉴定为多孔菌科薄孔菌属植物牛樟芝子实体;1,1-二苯基-2-三硝基苯肼(DPPH) 德国ALDRICH公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) Sigma公司;核糖醇(批号:K22F8S29663)、D(+)-岩藻糖(批号:ASIM7L15555) 上海源叶生物科技有限公司;D(-)-阿拉伯糖(批号:15011315)、L-鼠李糖(批号:14102217) 上海士锋生物科技有限公司;D(+)-葡萄糖(批号:D0806AS)、D-甘露糖(批号:M0425AS) 大连美伦生物技术有限公司;半乳糖(批号:100226-201105) 中国食品药品检定研究院;维生素C(VC) 北京鼎国昌盛生物技术有限责任公司;2,6-二叔丁基对甲酚(BHT) 上海华篮化学科技有限公司;三氟乙酸、盐酸羟按、吡啶、乙酸酐、氯仿、甲醇、乙醇、丙酮、硫酸、苯酚、水杨酸钠、过硫化钾、过氧化氢、硫酸亚铁 分析纯,国药集团化学试剂有限公司。
7890B/5977A 型气相色谱-质谱联用仪 美国安捷伦公司;UV-1800紫外可见分光光度计 日本岛津仪器有限公司;RT-04小型高速粉碎机 北京燕山正德机械设备有限公司;AR2310千分之一电子天平 奥豪斯仪器(上海)有限公司;MS105DU万分之一天平 瑞士METTLER TOLEDO公司;DZF-6051真空干燥箱 上海一恒科学仪器有限公司;RE-52系列旋转蒸发仪 上海亚荣生化仪器厂;HH-S型水浴锅 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 多糖的提取 牛樟芝药材切片,干燥后粉碎,过40目筛,60 ℃干燥至恒重。取牛樟芝粉末20 g,400 mL蒸馏水回流提取3次,真空泵抽滤,滤液合并浓缩,加入无水乙醇使乙醇终浓度达80%(V/V),4 ℃静置24 h,室温下离心(3000 r/min,15 min),弃去上清液,以少量无水乙醇、丙酮清洗三遍,60 ℃烘干,称重,计算牛樟芝多糖得率[13]。
多糖得率(%)=粗多糖质量×100/牛樟芝粉末质量
1.2.2 粗多糖的总糖含量测定
1.2.2.1 标准曲线的绘制 精密称取无水葡萄糖10.2 mg,加蒸馏水定容至100 mL,即得浓度为0.102 mg/mL的葡萄糖标准溶液。精密量取上述对照品溶液0.1、0.2、0.3、0.5和1 mL至具塞试管中,加水补至1 mL,空白对照加水1 mL,加入1 mL 5%的苯酚溶液,5 mL的浓硫酸,混匀,于100 ℃水浴加热20 min,取出,冰水浴5 min冷却至室温,取对照品溶液用紫外分光光法在400~600 nm进行扫描,结果显示在488 nm处有最大吸收,因此,本实验以488 nm作为检测波长[14]。
1.2.2.2 总糖含量测定 精密称取牛樟芝多糖粉末10 mg,加水定容至25 mL,即得0.4 mg/mL的供试品溶液。取适量样品溶液,平行三份,按上述的操作方法进行测定粗多糖的总糖含量。
1.2.2.3 方法学考察 精密度:取浓度为0.1 mg/mL的葡萄糖对照品溶液,按上述的方法进行测定,平行六份,计算吸光度的RSD值。
重复性:称取牛樟芝粗多糖六份,配制成0.2 mg/mL的供试品溶液,按上述的方法测定吸光度,计算多糖总糖含量的RSD值。
稳定性:精密量取供试品,按上述的方法测定吸光度,每15 min,测定一次,在2 h内显色稳定,计算吸光度的RSD值。
加样回收率:取已知含量的样品六份,精密加入等量的无水葡萄糖制备成供试品溶液,按上述的方法测定吸光度,计算加样回收率。
1.2.3 多糖单糖组成的GC-MS分析
1.2.3.1 多糖的水解及糖腈乙酸酯衍生化 精密称取牛樟芝多糖10 mg于具塞试管中,加入2 mL的2 mol/L三氟乙酸,密封,于110 ℃水解2 h,水解液挥干,再反复用甲醇溶解蒸干以除去残留三氟乙酸,真空浓缩至干,得牛樟芝多糖的水解物,置于4 ℃冰箱中备用。精密称取鼠李糖1.27 mg、岩藻糖1.36 mg、阿拉伯糖1.24 mg、甘露糖1.30 mg、半乳糖1.6 mg、葡萄糖1.63 mg,加入20 mg盐酸羟胺,加入1.1 mg/mL内标侧金盏花醇的吡啶溶液1 mL,于100 ℃中水浴30 min,取出,冷却后加入1 mL乙酸酐,100 ℃继续反应30 min,取出,挥干,得到糖腈乙酸酯衍生物,氯仿定容至5 mL,0.22 μm滤头过滤,进行GC-MS分析。取牛樟芝多糖水解物按上述方法进行糖腈乙酸酯衍生化和GC-MS分析[15]。
1.2.3.2 GC-MS检测条件 Agilent DB-WAX毛细管柱(30 m×0.250 mm,0.25 μm);载气:高纯氦;体积流量:0.8 mL/min;分流比:20∶1;进样口温度220 ℃;程序升温:起始温度100 ℃,10 ℃/min升至150 ℃,保持1 min;5 ℃/min升至160 ℃,保持1 min;1 ℃/min升至170 ℃,保持1 min;2 ℃/min升至180 ℃,保持1 min;1 ℃/min升至185 ℃,保持1 min;10 ℃/min升至220 ℃,保持5 min;离子源温度230 ℃,前进样口温度250 ℃,扫描质量范围m/z 50~500 amu。
1.2.3.3 方法学考察 精密度:将标准单糖混合溶液进行衍生化后连续进样6次,计算各单糖包括鼠李糖、阿拉伯糖、岩藻糖、半乳糖、葡萄糖、甘露糖峰面积RSD值。
重复性:牛樟芝多糖平行六份进行水解和衍生化后GC-MS测定,计算各单糖含量的RSD值。
稳定性:牛樟芝多糖经水解衍生化后于2、4、6、8、10、12、24 h分别进样,计算半乳糖、葡萄糖、甘露糖峰面积的RSD值。
1.2.3.4 多糖的单糖组成 按下列公式计算多糖中单糖质量,并求得相应单糖的摩尔数。
f=mrAs/msArm0=f(A0×ms)/As
式中,m0、mr、ms分别表示待测单糖、单糖标准品和内标物质的质量;A0、Ar、As分别表示待测单糖、单糖标准品和内标物质的峰面积;f表示相对校正因子。
1.2.4 多糖体外抗氧化活性评价
1.2.4.1 DPPH自由基清除活性 分别取浓度为0.1、0.2、0.4、0.8、1 mg/mL的牛樟芝粗多糖溶液1 mL,加入0.05 mg/mL的DPPH溶液1 mL,混匀,避光反应30 min,以甲醇代替DPPH溶液作样品对照,以甲醇代替样品做空白组,以不同浓度(0.1、0.2、0.4、0.8、1 mg/mL)的2,6-二叔丁基-4-甲基苯酚(BHT)作为阳性对照组,采用分光光度比色法在517 nm处测定吸光度,对DPPH的清除率以下列公式计算[16]:
DPPH自由基清除率(%)=[A0-(A1-A2)]×100/A0
式中,A0为空白吸光度值,A1为样品吸光度值,A2为样品对照吸光度值。
1.2.4.2 ABTS自由基清除活性 取7 mmol的ABTS和2.45 mmol过硫化钾等体积混合,室温下置于暗处放置12~16 h,得到ABTS储备液,使用前将储备液用蒸馏水稀释40~45倍,使该溶液在734 nm下的吸光度值在0.7±0.02。分别取不同浓度(0.5、1、2、3、4 mg/mL)的供试品溶液0.1 mL加入3.9 mL的ABTS溶液,摇匀,室温下放置6 min后再734 nm处测定吸光度。以不同浓度(0.025、0.05、0.1、0.2、0.4 mg/mL)的BHT作阳性对照,以蒸馏水代替样品做空白对照。对ABTS的清除率以下列公式计算[17]:
ABTS自由基清除率(%)=[A0-(A1-A2)]×100/A0
式中,A0为空白吸光度值,A1为样品吸光度值,A2为样品对照吸光度值。
1.2.4.3 OH自由基清除活性 取不同浓度(0.25、0.5、1、2、4 mg/mL)的供试品溶液1 mL,依次加入1.5 mmoL/L的硫酸亚铁1 mL,20 mmoL/L的水杨酸钠0.3 mL,6 mmoL/L的过氧化氢0.7 mL,摇匀,37 ℃水浴30 min,于510 nm处测定吸光度,以水代替样品作空白对照,以水代替水杨酸钠作样品对照,以不同浓度(0.125、0.25、0.5、1、2 mg/mL)的VC作阳性对照,对羟基自由基的清除率以下列公式计算[18]:
OH自由基清除率(%)=[A0-(A1-A2)]×100/A0
式中,A0为空白吸光度值,A1为样品吸光度值,A2为样品对照吸光度值。
1.3 数据处理
实验平行做三次,实验数值均以均值±标准差表示,并采用SPSS 21.0软件计算IC50值。
2 结果与分析
2.1 粗多糖总糖含量测定
2.1.1 线性关系考察 以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得线性回归方程:Y=0.06406X+0.00162,r=0.9998。结果表明,无水葡萄糖在浓度为1.46~14.57 μg/mL内线性关系良好。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
2.1.2 方法学考察及多糖样品测定结果 精密度实验结果显示葡萄糖对照品的吸光度RSD值为2.39%,说明该仪器精密度良好;重复性实验结果显示供试品总糖含量的RSD值为2.71%,说明该方法重复性良好;稳定性结果显示该方法在2 h内稳定,RSD值为0.7%;回收率实验结果显示加样回收率范围95.51%~102.16%,RSD为2.87%。牛樟芝多糖的得率为3.02%,粗多糖中的总糖含量为55.42%±2.13%。
2.2 多糖单糖组成
2.2.1 方法学考察 精密度实验结果显示鼠李糖、阿拉伯糖、岩藻糖、半乳糖、葡萄糖、甘露糖峰面积的RSD值分别为1.38%、0.88%、1.35%、1.29%、1.41%、1.76%,表明仪器精密度良好;重复性实验结果显示半乳糖、葡萄糖、甘露糖含量的RSD值分别为2.2%,3.08%,2.89%,表明该方法重复性良好;稳定性结果显示该方法在24 h内稳定,半乳糖、葡萄糖、甘露糖峰面积RSD值分别为2.38%,1.98%,2.73%,表明各单糖衍生物稳定性良好。
2.2.2 牛樟芝多糖的单糖组成 多糖的单糖组成分析是控制多糖质量标准和提供多糖基本信息的最重要环节,多糖生物活性与其单糖组成及比例等密切相关。本研究首次采用GC-MS分析鉴定了牛樟芝多糖的单糖组成,采用盐酸羟胺肟化和乙酸酐乙酰化衍生法有效克服由于糖的异构化而造成的多峰现象,每种单糖都能获得单一的色谱峰,有利于进行气相色谱的定性和定量分析;牛樟芝多糖经三氟乙酸水解,糖腈乙酸酯衍生化后,进行GC-MS检测。通过比较图2和图3,得知牛樟芝多糖主要由甘露糖、葡萄糖、半乳糖三种单糖组成。其中,葡萄糖含量最大,甘露糖和半乳糖次之,三种单糖的摩尔比为1∶7.14∶0.96。Su等[12]采用PMP衍生化HPLC法测得牛樟芝中含有六种单糖,主要单糖组成为葡萄糖、甘露糖、鼠李糖,摩尔百分比分别为84%、7.2%、2.9%,以葡萄糖含量最高。龚劲松等[19]的实验结果表明多糖的不同提取方法也会影响到单糖的含量分布,不同种类产地的虫草测得其单糖含量差异明显[20]。由此可见,多糖的单糖组成的检测结果可能与样品的来源、多糖的提取分离、衍生化和检测方法有关。

图2 对照品单糖和内标物混合样品的总离子流图Fig.2 Total ion current profile of the mixed samples of each standard monosaccharide and internal standard注:1~7分别为鼠李糖、阿拉伯糖、岩藻糖、 核糖醇、半乳糖、葡萄糖、甘露糖。

图3 牛樟芝多糖水解物及内标物的总离子流图Fig.3 Total ion current profile of the hydrolysate of the polysaccharide from Antrodia cinnamomea, as well as the internal standard注:1~4分别为核糖醇、半乳糖、葡萄糖、甘露糖。
2.3 多糖的抗氧化活性
2.3.1 DPPH自由基清除活性 不同浓度的牛樟芝多糖对DPPH自由基的清除能力测定结果见图4。由图4可知,牛樟芝多糖对DPPH自由基的清除作用与浓度呈正相关,随着浓度的增加清除作用加强,当多糖浓度为1 mg/mL,清除率达到70.62%,多糖对DPPH自由基清除的IC50值为(0.584±0.008) mg/mL,阳性对照BHT的IC50值为(0.283±0.002) mg/mL。Wang等[21]对不同培养方式的牛樟芝的冷水浸提物、甲醇提取物、热水提取物进行体外DPPH自由基清除实验,三者均具一定清除自由基活性,呈明显的剂量依懒性,且与牛樟芝的培养方式和提取方法有关。因此,不同的样品来源和提取方式均可影响牛樟芝提取物的DPPH自由基清除活性。本研究证实牛樟芝多糖具有良好的DPPH自由基清除活性。
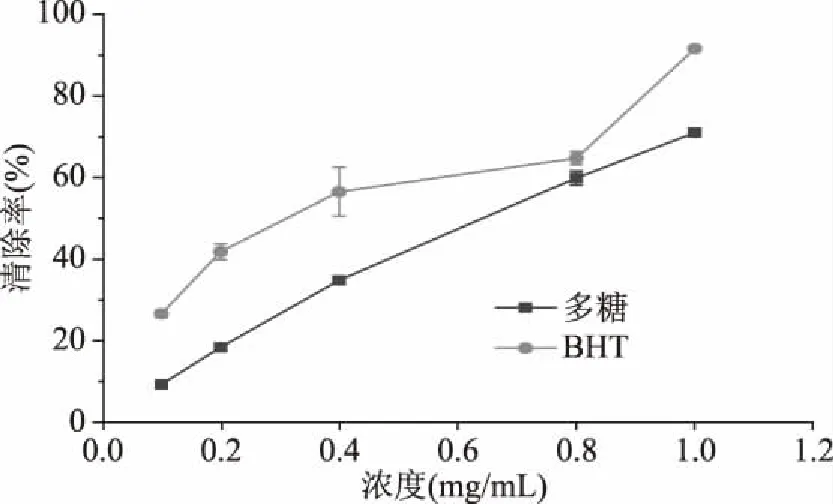
图4 牛樟芝多糖及BHT对DPPH自由基的清除率Fig.4 Scavenging rate of DPPH free radicals by the polysaccharide from Antrodia cinnamomea and BHT
2.3.2 ABTS自由基清除活性 不同浓度的牛樟芝多糖对ABTS自由基的清除能力测定结果见图5。由图5可知,随着牛樟芝多糖增大,对ABTS自由基的清除作用加强,在浓度为4 mg/mL时,清除率高达98.52%,多糖清除ABTS自由基的IC50为(1.182±0.058) mg/mL,阳性对照BHT的IC50为(0.098±0.001) mg/mL。体外抗氧化研究表明不同产地的灵芝多糖ABTS自由基清除的IC50值分别为1.50~3.50 mg/mL[22]。由此可见,牛樟芝多糖对ABTS自由基具有一定的清除作用,其活性要高于灵芝多糖。

图5 牛樟芝多糖及BHT对ABTS自由基的清除率Fig.5 Scavenging rate of ABTS free radicals by the polysaccharide from Antrodia cinnamomea and BHT
2.3.3 OH自由基清除活性 不同浓度的牛樟芝多糖对ABTS自由基的清除能力测定结果见图6,由图6可知,牛樟芝多糖对OH自由基具有一定清除作用,且清除能力随多糖浓度增加而增大,多糖对OH自由基清除的IC50为(1.384±0.133) mg/mL,阳性对照VC清除OH自由基的IC50为(0.774±0.004) mg/mL。因此,牛樟芝多糖对OH自由基也具有较好的清除活性。已有的研究表明采用水提醇沉和膜提取工艺得到的灵芝多糖对OH自由基清除的IC50分别为1.58和1.36 mg/mL[23]。由此可见,牛樟芝多糖和灵芝多糖对OH自由基清除作用相近,但均弱于阳性对照VC。

图6 牛樟芝多糖及VC对OH自由基的清除率Fig.6 Scavenging rate of OH free radicals by the polysaccharide from Antrodia cinnamomea and VC
3 结论
本研究使用苯酚硫酸法测得牛樟芝粗多糖中的总糖含量为55.42%±2.13%。选取核糖醇作为内标物,采用内标法测定多糖的单糖组成,实验结果表明牛樟芝多糖主要由甘露糖、葡萄糖、半乳糖组成,摩尔比为1∶7.14∶0.96。体外抗氧化活性结果证实牛樟芝多糖对DPPH自由基、ABTS自由基、OH自由基三种不同自由基具有较好的清除效果,并表现出明显的量效关系。本研究测定了牛樟芝多糖的含量、单糖组成以及体外抗氧化活性,为牛樟芝的质量控制提供一定的参考依据。
