杜仲黄酮与鸡软骨肽的相互作用对抗氧化活性及荧光特性的影响
2019-08-26任娇艳廖林锋李宇娟林晓玲谢丽平尹西拳袁尔东
任娇艳,廖林锋,李宇娟,林晓玲,谢丽平,梁 明,尹西拳,袁尔东,*
(1.华南理工大学食品科学与工程学院,广东广州 510641; 2.中新国际联合研究院,广东广州 510000; 3.无限极(中国)有限公司,广东广州510665;)
近年来,大分子与小分子的相互作用已经引起研究者们极大兴趣[1-4]。研究发现,小分子化合物与大分子的相互作用可影响化合物的结构、功能及营养特性。Anaid等[5]研究发现油菜蛋白水解物与酚类化合物相互作用后,蛋白水解物在细胞内抗氧化能力得到明显提高。Lidija等[6]研究表明,黄酮与蛋白质的相互作用可影响蛋白质在体外抗氧化活性和消化率,对食品品质与健康性能产生多重影响。Yang等[7]使用多种光谱方法研究芥酸与牛血清白蛋白的相互作用,为芥酸过量摄入提供更多的临床药理信息。由多种原料复合而成的保健食品体系,其原料(特别是功效活性成分)在生产、贮藏中可能发生相互作用,导致产品成分、功效、感官品质等发生变化。因此,研究不同功效成分在不同条件下的相互作用对实际生产具有重要的指导意义。
骨质疏松是一种骨代谢疾病,是由于骨的吸收活跃强度高于骨的形成活动,而导致骨量减少、骨微结构退化。随着我国人口老龄化进程的不断加快,老年人的骨质疏松问题日益严重。因此,预防骨质疏松疾病的发生显得尤为重要。鸡软骨肽,是以鸡软骨为原料,由生物可控酶解获得的食源性活性肽,有助于改善关节软骨健康,对骨质疏松的预防具有积极作用。杜仲是杜仲科植物杜仲(Eucommiaulmoides)的干燥树皮,是我国传统的名贵中草药,是一种传统骨伤科用药,具有增强骨密度、治疗骨质疏松等作用。研究显示,杜仲黄酮是杜仲促进骨细胞增殖、改善骨质疏松症的主要有效成分之一[8-10],其含量是判断杜仲生药及其产品品质的重要指标[11]。
活性氧自由基(Reactive oxygen species,ROS)积累是造成骨质疏松的关键因素[12]。ROS会干扰骨细胞对骨重建的启动作用,还直接参与骨重建效应性细胞的调控,抑制成骨细胞分化,造成骨质疏松[13-14]。因此,ROS过剩造成氧化损伤与骨质疏松密切相关,使得抗氧化作用在防治骨质疏松的研究中越来越受到重视。
本文以杜仲黄酮和鸡软骨肽这两种具有改善骨质疏松功效的物质为研究对象,模拟不同工艺生产和储藏条件,考察不同条件下杜仲黄酮与鸡软骨肽相互作用前后抗氧化活性的变化,并通过荧光光谱对其相互作用机制进行初步的探讨,以期为其在改善骨质疏松类保健食品中的开发和应用提供一定的参考。
1 材料与方法
1.1 材料与仪器
杜仲 四川新荷花中药饮片股份有限公司;2,2-联苯基-1-苦基肼基(2,2-Diphenyl-1-picrylhydrazyl,DPPH) 购于梯希爱(上海)化成工业发展有限公司;芦丁标品 购于国药集团化学试剂有限公司;鸡软骨肽 无限极(中国)有限公司提供。
RE-52A旋转蒸发器 上海亚荣生化仪器厂;SHZ-D(III)循环水式真空泵 巩义市予华仪器有限责任公司;UV754N紫外可见光分光光度计 INESA上海仪电分析仪器有限公司;SCIENTZ-12N冷冻干燥机 宁波新乏生物科技有限公司;BSZ-160F电脑自动部分收集器 上海精科实业有限公司;日立荧光光谱仪 天美(中国)科学仪器有限公司广州分公司。
1.2 实验方法
1.2.1 杜仲黄酮类化合物的提取 将杜仲粉碎过60目筛,按1∶20 (g/mL)的料液比加入70%乙醇,在60 ℃的摇床中恒温浸提3次,时间分别为3、2、1 h,收集并浓缩(于50 ℃恒温旋转蒸发浓缩)滤液至体积50 mL,冷冻干燥,即得杜仲黄酮粗提物[15]。
1.2.2 大孔树脂分离纯化杜仲黄酮 参考文献[16]的方法,稍作修改。将95%乙醇浸泡保存的大孔树脂D-101用蒸馏水冲洗至无醇味,用玻璃层析柱装柱。称取一定质量的杜仲黄酮粗提物,用蒸馏水溶解并经0.22 μm微孔滤膜过滤,得到总黄酮浓度0.8 mg/mL的杜仲黄酮溶液。用胶头滴管上样至层析柱(3.0 cm×20 cm)中,上样体积20 mL。上样后,先用蒸馏水冲洗,使树脂充分吸附黄酮,并同时去除杂质(蛋白、多糖等)。冲洗约两个柱体积后,先后用40%、60%、80%的乙醇进行梯度洗脱,用自动收集器收集,洗脱流速1 mL/min,5 mL/管,每个梯度收集60管。按1.2.3的方法检测每管中的黄酮含量,根据吸光值绘制动态洗脱曲线,并收集峰段的黄酮组分,减压浓缩至合适体积后,冷冻干燥并保存。
1.2.3 总黄酮含量测定 参考文献[17],采用硝酸铝显色法,稍作修改。
标准曲线的绘制:准确称取芦丁标准品0.0500 g,用体积分数30%的乙醇溶解,定容至250 mL,得到质量浓度为C=0.2000 g/L的芦丁标准溶液。精确称取芦丁标准溶液V1=0、0.5、1.0、2.0、2.5、3.0 mL于六只试管中,补加30%乙醇至3 mL,摇匀;各加入0.15 mL 5% NaNO2摇匀,放置5 min;各加入0.3 mL 10% AlCl3·6H2O摇匀,放置6 min;各加入1 mol/L NaOH 2.0 mL,混匀,补加0.55 mL 30%乙醇稀释,总体积为V=6 mL,摇匀,10 min后,于波长510 nm处测定吸光值。参比为空白试剂。做三组平行。分别以标准品浓度及其对应吸光度作为横纵坐标制作标准曲线,得线性回归方程为y=9.6630x+0.0055(R2=0.9999),式中x为芦丁标准品质量浓度(mg/mL),y为510 nm处的吸光值A510 nm。
总黄酮含量的测定:称取一定质量经冷冻干燥处理的杜仲黄酮粗提物,用体积分数30%的乙醇溶解,稀释至合适浓度,按照上述标准曲线的步骤测定吸光值,并将结果代入标准曲线计算得样品中黄酮浓度。
1.2.4 杜仲黄酮与鸡软骨肽相互作用影响体系抗氧化活性的研究 以DPPH自由基清除率作为抗氧化指标,固定相互作用体系中鸡软骨肽浓度为5 mg/mL不变,探究不同物料配比、温度、pH等因素对相互作用体系抗氧化效果的影响:
1.2.4.1 物料配比 固定鸡软骨肽浓度不变,用pH6.0的磷酸盐缓冲液分别配制浓度9、12、15、18、21 μg/mL的杜仲黄酮,在室温25 ℃下反应1 h,比较两单独组分的DPPH自由基清除率数学加和与相互作用后复合物的DPPH自由基清除率的显著性关系,分析其抗氧化作用是否具有协同效果。
1.2.4.2 温度 选择1.2.4.1中具有显著性差异的物料配比,并结合考虑食品在室温贮藏及热杀菌工艺中组分发生相互作用的可能性,在pH6.0条件下,研究在三个温度条件(室温:25 ℃下,反应1 h;低温巴氏杀菌:68~70 ℃下,30 min;高温杀菌:121 ℃下,20 min)处理后,DPPH自由基清除率的变化。
1.2.4.3 pH 参照1.2.4.1中选择的物料配比,配置磷酸盐缓冲液,模拟食品体系中酸碱性,研究在室温下三个pH(5.5、6.0、6.5)下DPPH自由基清除率的变化。
1.2.5 DPPH自由基清除活性的测定 参考文献[18],稍作修改。DPPH自由基浓度为0.2 mmol/L,用无水乙醇溶解,备用。空白调零Ao:用移液枪准确量取2 mL无水乙醇放入试管中,同时加入2 mL蒸馏水,重复三组;样品Ai:用移液器准确量取样品2 mL放入试管中,同时加入预先用无水乙醇配好的0.2 mg/mL的DPPH试剂2 mL,每个测试做2个重复;样品Aj:在试管中先加入2 mL样品,再加入2 mL乙醇,重复三组;对照组Ac:在试管中先加入2 mL乙醇,再加入2 mL DPPH溶液,重复三组。振动10 s,在37 ℃保温30 min后,用分光光度计517 nm处测定吸光值。按照以下公式计算DPPH·清除率:
DPPH自由基清除率(%)=[1-(Ai-Aj)/Ac]×100
1.2.6 荧光光谱检测 参考文献[7, 19-20],并稍作修改。采用荧光光谱法,探究杜仲黄酮与鸡软骨肽的相互作用。其中,杜仲黄酮样品与鸡软骨肽均用磷酸盐缓冲溶液预溶解,固定混合体系中鸡软骨肽浓度为0.2 mg/mL,改变杜仲黄酮浓度并使其在体系中浓度分别为0、0.40、0.80、1.60、3.20 μg/mL,两者复配并在实验温度25 ℃及生理温度37 ℃反应1 h,在激发波长280 nm下记录样品在295~500 nm波长范围内的荧光发射光谱。
1.3 数据处理
所有数据均独立平行测定3次,数据结果以平均值±标准差(mean±SD)的形式表示。以p<0.05为差异具有统计学意义,采用Graphpad prism 6.0软件对数据进行方差分析并作图。
2 结果与分析
2.1 大孔树脂柱层析纯化杜仲黄酮
大孔树脂用于分离纯化黄酮主要是利用黄酮类物质的极性、分子大小、范德华力等物理吸附作用[16]。如图1所示(先后用体积分数分别为40%、60%及80%的乙醇洗脱,各收集60管),40%乙醇洗脱峰相对集中,无明显的拖尾现象。继续增加洗脱液中乙醇体积分数(60%及80%),没有明显洗脱峰出现,可认为洗脱已基本完成。收集40%乙醇的洗脱组分,并真空浓缩至合适体积,冷冻干燥得到杜仲黄酮。
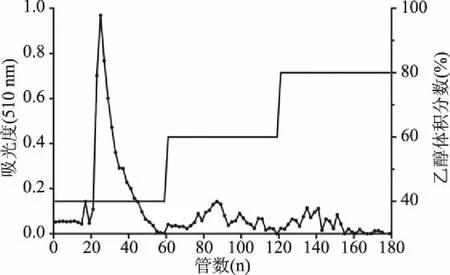
图1 D-101树脂柱层析动态洗脱杜仲黄酮曲线图Fig.1 Dynamic elution of Eucommia ulmoides flavonoids by D-101 resin column chromatography
2.2 杜仲黄酮与鸡软骨肽相互作用对抗氧化活性的影响
ROS过剩造成的氧化损伤与骨质疏松密切相关,通过杜仲黄酮与鸡软骨肽交互作用对其抗氧化活性的影响,可一定程度上反映其在改善骨质疏松方面的功效变化情况。
2.2.1 物料配比对体系抗氧化活性的影响 实验固定鸡软骨肽浓度5 mg/mL不变,梯度改变杜仲黄酮浓度,以探究不同物料配比对体系抗氧化活性的影响。由图2可知,在不同物料配比下,鸡软骨肽与杜仲黄酮复合物的DPPH·清除活性显著高于同浓度下两者独立体系清除活性的数学加和(p<0.01),说明复合体系中两组分之间发生了相互作用,导致复合体系的抗氧化活性的升高,因此鸡软骨肽与杜仲黄酮复合体系的抗氧化活性具有协同增效的作用。在杜仲黄酮浓度小于15 μg/mL时,复合物的自由基清除活性随着复合体系黄酮浓度的升高而显著增大(p<0.05);而在杜仲黄酮浓度大于15 μg/mL时,随着复合体系黄酮浓度的升高,复合物的自由基清除活性却无明显变化。
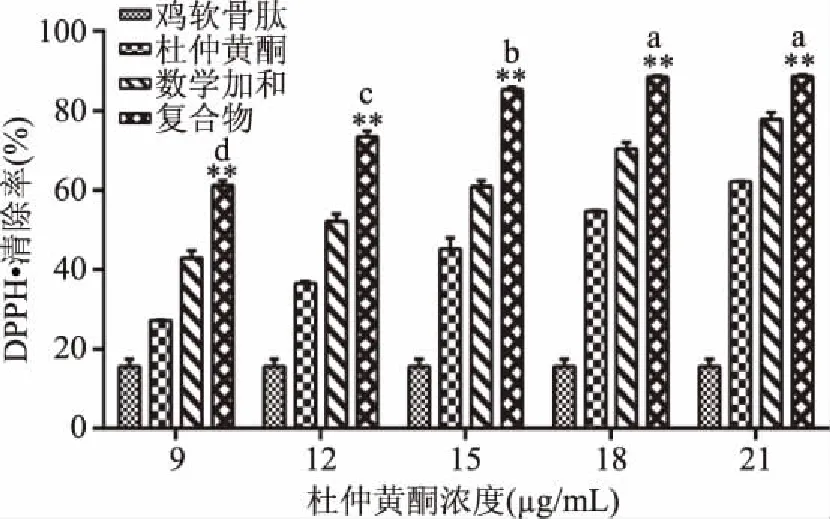
图2 不同物料配比条件下鸡软骨肽-杜仲黄酮复合体系的抗氧化活性Fig.2 Effect of different material ratios on antioxidant activity注:**复合物与数学加和相比具有显著性差异(p<0.01);不同小写字母表示不同黄酮浓度下复合物差异显著(p<0.05)。
杜仲中黄酮类成分主要是槲皮素和山柰酚[21],其良好的抗氧化活性,一方面是由于结构上是一种酚羟基化合物,其酚羟基可通过供氢并与自由基反应而生成酚氧自由基,该酚氧自由基可与芳环形成共轭体系并稳定存在,从而终止自由基链式反应[22];另一方面,活泼的酚羟基容易被氧化形成醌。多肽的抗氧化能力与组成该多肽的氨基酸种类、数量及排列方式相关。Lin等[23]从鸡软骨水解物中鉴定出5种新型多肽,由于组成上含有Tyr、Lys及Pro三种抗氧化性氨基酸,鸡软骨肽具有较强的抗氧化能力。多肽与黄酮的作用主要是非共价疏水相互作用,非共价力通常包括氢键、疏水键、范德华力,而肽-黄酮复合物的产生是氢键和疏水键形成的结果[5-6]。鸡软骨肽在一定浓度下,随着加入杜仲黄酮浓度的增加,肽与黄酮相互作用效果增强,因此复合体系中抗氧化活性明显增强,呈现明显的剂量效应关系。但当黄酮数量增加到一定程度后,其与肽的相互作用逐渐趋向饱和,因此复合体系的抗氧化活性逐渐趋向于稳定,不再发生显著性变化。
2.2.2 温度及pH对复合体系抗氧化活性的影响 固定体系中鸡软骨肽与杜仲黄酮浓度分别为5 mg/mL和15 μg/mL不变,探究实际工艺生产中温度及pH对相互作用的影响。
如图3a所示,杜仲黄酮的DPPH自由基清除活性对温度不敏感,在结构上相对稳定。但是,温度可能影响多肽的空间结构,在高温环境下肽链得以伸展,抗氧化性氨基酸残基暴露,与巴氏杀菌相比,在121 ℃下20 min后鸡软骨肽的DPPH自由基清除活性显著增强,但在巴氏杀菌温度条件下却相对稳定。鸡软骨肽-杜仲黄酮复合物在巴氏杀菌温度条件下也相对稳定,其DPPH自由基清除活性没有发生显著性变化,但在高温杀菌温度条件下的DPPH自由基清除活性显著升高(p<0.01)。其原因可能在于,温度会影响氢键和疏水键的形成,多肽链伸展,疏水基团暴露,有利于增加多肽与黄酮的疏水性相互作用[24-25]。高温长时杀菌,一方面可以明显增加相互作用产物的抗氧化活性,另一方面对延长食品货架期也有一定的帮助。

图3 不同温度(a)及pH(b)对鸡软骨肽-杜仲黄酮相互作用的影响Fig.3 Effect of different temperatures (a)and pH(b)on interaction注:a与25 ℃组相比具有显著性差异,**p<0.01;与68 ℃组相比具有显著性差异,##p<0.01;b与pH5.5组相比具有显著性差异,**p<0.01; 与pH6.0组相比具有显著性差异,##p<0.01。
由图3b可知,鸡软骨肽的DPPH自由基清除活性对pH反应不敏感,随pH的改变没有显著性变化;杜仲黄酮在pH6.5时的DPPH自由基清除活性较pH6.0时显著下降(p<0.01),而与pH5.5时的DPPH自由基清除活性没有显著性差异;肽-黄酮复合物在5.5、6.0两个pH条件下的DPPH·清除活性显著高于pH6.5时的DPPH自由基清除活性(p<0.01)。可能是由于黄酮本身是一种酚羟基化合物,其酚羟基在正常条件下能发生解离而生成酚氧阴离子及氢离子,故呈现出一定的酸性。低pH可在一定程度上抑制酚羟基的解离,并且不利于酚羟基供氢参与自由基反应,由此导致黄酮抗氧化能力降低[26]。在较低pH条件下,肽由于氨基酸的解离而拥有更多的结合位点,肽与黄酮通过疏水相互作用结合的几率增加,利于两者的络合[27]。因此,在食品酸性体系中,合适的pH环境有利于增强鸡软骨肽-杜仲黄酮复合体系的抗氧化活性。
2.3 杜仲黄酮对鸡软骨肽的荧光特性的影响
荧光光谱法是研究生物大分子与小分子、离子相互作用的重要手段[28]。蛋白质的色氨酸、酪氨酸及苯丙氨酸残基,可在一定激发波长下产生荧光效应。在蛋白质溶液中加入黄酮等小分子物质后,可能引起蛋白内源性荧光强度的降低,造成荧光猝灭的现象。因此,通过检测杜仲黄酮与鸡软骨肽相互作用前后荧光特性的变化情况,可以进一步探究杜仲黄酮对鸡软骨肽的作用。
固定鸡软骨肽浓度为0.2 mg/mL,探究不同浓度的杜仲黄酮对鸡软骨肽荧光发射光谱的影响。如图4a和4b所示,杜仲黄酮的加入可使鸡软骨肽的荧光强度明显下降,并且随着黄酮浓度的增加(图中箭头所示方向),效果越明显。说明,杜仲黄酮对鸡软骨肽的内源荧光有明显的猝灭作用,并且随黄酮浓度的增加,荧光猝灭效果越明显。温度变化并未引起复合物发射峰峰形的改变,说明黄酮对多肽的荧光猝灭方式可能表现为静态猝灭。同时,随着杜仲黄酮添加量的增加,肽的荧光最大发射峰出现了明显的红移。说明,杜仲黄酮与鸡软骨肽发生相互作用形成复合物,可能是两者间氢键和疏水键形成的结果[6,24],从而导致其荧光性质的改变。
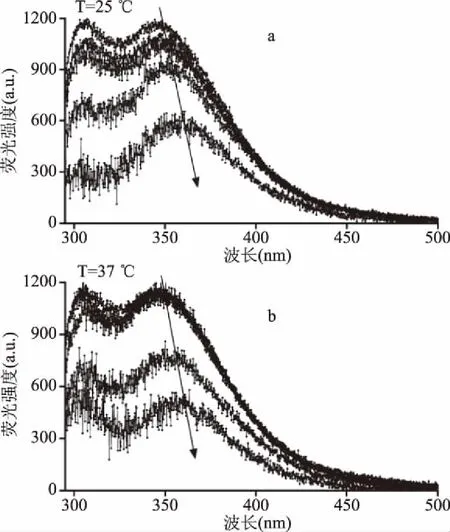
图4 杜仲黄酮对鸡软骨肽荧光光谱的影响Fig.4 Effect of Eucommia ulmoides flavonoids on fluorescence spectra of chicken cartilage peptides注:箭头方向表示杜仲黄酮浓度逐渐增加,依次为0、0.40、0.80、1.60、3.20 μg/mL。
3 结论
杜仲黄酮可与鸡软骨肽发生相互作用,使复合体系的抗氧化活性得到明显增强,并且在一定的物料配比范围内呈现明显的剂量效应关系。温度和pH对鸡软骨肽-杜仲黄酮的相互作用会产生明显的影响。在巴氏杀菌条件下复合体系的抗氧化活性并无明显变化,但在121 ℃下20 min后复合体系的抗氧化活性呈现明显的协同增效作用。环境pH的升高不利于复合体系抗氧化活性,在pH6.0条件下肽-黄酮复合体系的抗氧化活性增强。杜仲黄酮能猝灭鸡软骨肽的内源性荧光,并使其最大荧光发射峰出现明显红移,说明两者发生明显的相互作用。本研究为杜仲黄酮和鸡软骨肽在改善骨质疏松保健食品中的开发和应用提供一定的参考,对不同食品组分相互作用的研究也具有一定的参考价值。
