双酶水解螺旋藻藻胆蛋白制备ACE抑制肽的工艺优化
2019-08-26胡志和周宝宏贾蕴琴王丽娟吴子健
马 莹,胡志和,2,薛 璐,2,*,潘 颖,周宝宏,贾蕴琴,王丽娟,2,吴子健,2
(1.天津商业大学生物技术与食品科学学院,天津 300134; 2.天津市食品生物技术重点实验室,天津 300134)
血管紧张素转化酶(Angiotensin-Converting Enzyme,ACE)是一种羧二肽酶,能使血管紧张素Ⅰ转变成血管紧张素Ⅱ,血管紧张素Ⅱ具有血管收缩调节功能,同时ACE能水解缓激肽,使之失去活性,使人体血压升高[1-2]。ACE抑制肽是一类从食物中提取的具有降血压的活性多肽[3]。ACE抑制剂的研究与开发对治疗高血压意义重大[4]。
2015年我国高血压患者超过3亿人,预防和治疗高血压已经成为了全世界医学领域的一项重要任务。治疗高血压的化学合成药物有卡托普利、阿拉普利等。但这些药物会产生一定的副作用,如咳嗽、味觉紊乱、皮疹、不能停止服药等,在治疗高血压方面就会受到一定的限制[5-6]。因此寻求更高效更安全的降压药物变得尤其重要。从食源蛋白质中得到的降血压肽既能使动物体血压适当降低[7-8],又能保证其安全性,同时对血压正常的动物体没有降压作用,弥补了常见降压药物使血压过度下降易诱发心脏病突发提高死亡率的不足[9]。1965年Ferreira[10]首次从南美洲蝮蛇(Bothropsjararaca)的毒液中发现血管紧张素转化酶抑制剂。1971年Ondetti等[11]从蝮蛇中分离出1个九肽片段,并经过体内外实验表明具有抗高血压作用。后来人们陆续从各种食物蛋白中发现分离出多种ACE抑制肽,诸如乳及乳制品[12-14]、发酵食品[15-16]、植物[17-19]、水产品[20-21]、明胶[22]、海洋藻类[23]等。本课题组胡志和等[24]利用胃蛋白酶和胰蛋白酶对牛乳酪蛋白进行水解,再通过超滤和Sephadex G-15凝胶色谱法将水解产物纯化,最终确定了一种新的ACE抑制肽YQKFPQYLQY。Lu等[25]通过实验证实,自发性高血压大鼠灌胃YQKFPQYLQY后,其收缩压显著降低。
螺旋藻营养价值很高,优质蛋白质、螺旋藻多糖、人体必需微量元素以及多种维生素都是螺旋藻的重要组成成分。其蛋白质含量高达60%~70%,是自然界中具有重大开发价值的食用和饵料蛋白资源,被形象的称为“超级微型营养库”。由于其细胞壁中几乎不含纤维素,故人体消化吸收十分容易,经过实验测定螺旋藻的消化吸收率在90%以上,并且蛋白的消化率达75%,在当今的社会中,蛋白质的资源严重不足,螺旋藻是一种纯天然品质优良的蛋白质。
目前制备ACE抑制肽多为单一蛋白酶水解,很少模拟胃肠道系统的酶解过程。而经其他酶水解得到的ACE抑制肽在人体消化吸收过程中,由于胃蛋白酶和胰蛋白酶的作用,其氨基酸序列有可能会发生变化,进而导致ACE抑制能力的变化。因此,本研究在课题组前期研究工作的基础上,以螺旋藻藻胆蛋白为原料,采用胃蛋白酶、胰蛋白酶先后对螺旋藻藻胆蛋白进行水解来制备ACE抑制肽。通过双酶组合酶解产物在模拟胃肠道消化系统中的效果,得到有消化稳定性的ACE 抑制肽。为今后抗高血压类功能性食品研发提供新原料,并为ACE抑制肽的构效关系研究打下基础。
1 材料与方法
1.1 材料与仪器
钝顶螺旋藻粉 内蒙怡健生物制品有限公司;胃蛋白酶(≥ 250 U/mg)、N-Hippuryl-His-Leu hydrate(HHL)、血管紧张素转化酶(ACE)、马尿酰组胺酰亮氨酸(hippuryl-histidyl-leucine,HHL)、胰蛋白酶(≥250 U/mg) 美国Sigma公司;十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、丙烯酰胺、N,N-亚甲叉双丙烯酰胺 美国Bio-Rad公司;甘氨酸 中国医药集团上海化学试剂公司;Tris-碱 德国Roche公司;无水甲醇、无水乙醇、福林酚等 均为国产分析纯。
MODUL YOD-230型冷冻干燥机 Thermo公司;UV-2100型分光光度计 Unico公司;FA1104N电子天平 上海精密科学仪器有限公司;KDC-160HR型高速冷冻离心机 科大创新股份有限公司中佳分公司;Amicon Ultra-10kDa超滤离心管、Amicon Ultra-3kDa Millipore超滤离心管 上海必泰生物科技有限公司;HL-2型恒流泵 上海沪西分析仪器厂;;电泳仪 北京市六一仪器厂。
1.2 实验方法
1.2.1 反复冻融法和超声波解冻结合法提取藻胆蛋白 准确称取螺旋藻粉400 g,溶于10 L的去离子水中,即料液比为1∶25 (m/v)之后将螺旋藻溶液均匀的分到6个2 L溶剂瓶中,在-80 ℃的冰箱中进行冷冻,待螺旋藻溶液充分冷冻后取出放置于40 ℃的水浴槽中,将超声功率固定在650 W,进行超声波辅助解冻。瓶子编号分别是1、2、3、4、5、6,编号1的冻融一次,编号2的冻融两次,依次类推,在每解冻后取500 mL解冻液进行离心,取离心的上清液,之后进行螺旋藻粉藻胆蛋白含量的测定,蛋白质含量测定采用凯氏定氮法[27],计算蛋白质溶出率。
蛋白质溶出率(%)=上清液蛋白质含量×100/螺旋藻粉中蛋白质含量
1.2.2 等电点法分离蛋白 根据1.2.1反复冻融法和超声波解冻结合法提取藻胆蛋白,收集冻融5次条件下螺旋藻粉解冻液的上清液6000 mL,上清液均匀地分装到6个烧杯中,将0.1 mol/L浓度的稀盐酸加入上清液中,边滴加边搅拌混匀,分别调节pH至3.50、3.75、4.00、4.25、4.50、4.75,静置2 h后,温度控制在10 ℃,以4000 r/min离心20 min,收集蛋白沉淀冷冻干燥得到粗蛋白粉末,称量得到的粗蛋白粉末的重量。用分光光度计测量650 nm处残余蛋白的吸光度值。吸光度值越低证明蛋白质沉淀效果越好。
1.2.3 采用SDS-PAGE凝胶电泳法分析提取蛋白的种类 根据所测蛋白质的带电密度及所分离蛋白样品的相对分子质量大小来设计不同浓度的胶,通过预实验得出分离胶及浓缩胶配方如表1。
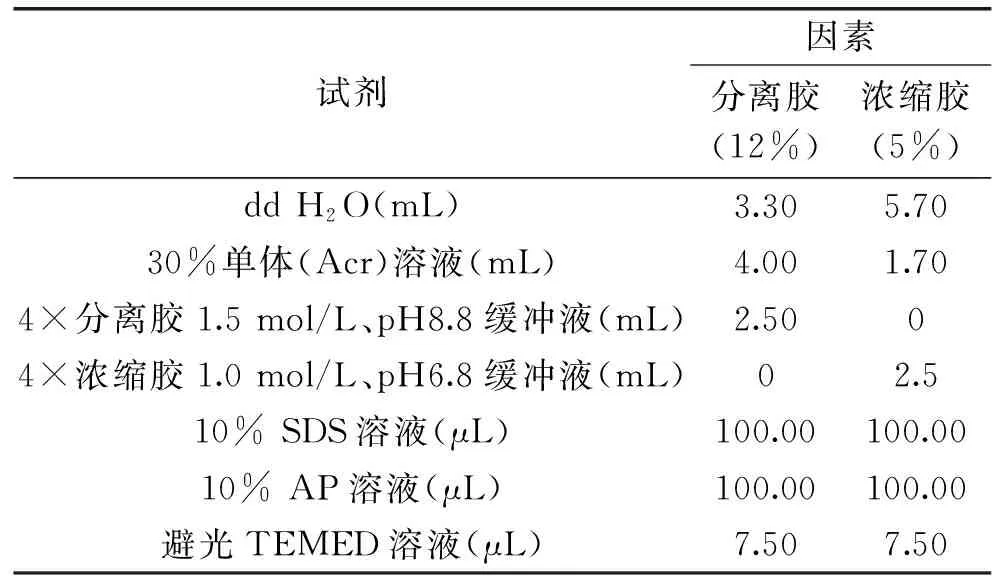
表1 分离胶及浓缩胶配方Table 1 Separation and concentrate formulas
1.2.4 胃蛋白酶水解藻胆蛋白
1.2.4.1 水解工艺 称取一定量的螺旋藻藻胆蛋白,以蒸馏水配成一定浓度溶液,水浴搅拌,待温度达到所需温度后,调节pH,按一定的酶底比加入胃蛋白酶,开始水解。在搅拌状态下,不断加入浓度为1 mol/L的HCl,以使pH始终维持在试验规定范围内。水解结束后,沸水浴灭酶15 min。冷却后以转速6000 r/min离心30 min,取上清液冷冻干燥,-80 ℃贮藏,备用。
1.2.4.2 温度对胃蛋白酶水解藻胆蛋白 ACE 抑制率的影响 在酶与底物比为2610 U/g,底物质量分数为6%的条件下,水解温度分别控制在27、32、37、42、47 ℃,并分别测定藻胆蛋白的ACE抑制率。
1.2.4.3 酶与底物比对胃蛋白酶水解藻胆蛋白ACE抑制率的影响 在温度为37 ℃,底物质量分数为6%的条件下,酶与底物比分别控制在1044、1305、1740、2610、5220 U/g,并分别测定藻胆蛋白的ACE抑制率。
1.2.4.4 底物质量分数对胃蛋白酶水解藻胆蛋白ACE抑制率的影响 在温度为37 ℃,酶与底物比为2610 U/g的条件下,底物质量分数分别控制在2%、4%、6%、8%、10%,并分别测定藻胆蛋白的ACE抑制率。
1.2.5 胃蛋白酶水解正交试验 根据单因素实验的结果,选择测得的ACE抑制率最高的试样,将所得的底物浓度、酶与底物比、水解温度值前后选择两个数值,以底物浓度、酶与底物比、水解温度为影响因素,以ACE抑制率为考察指标,进行L9(34)正交实验,因素水平见表2。将9组实验组按照1.2.4.1方法操作,所得干燥粉于-80 ℃条件下贮藏备用。
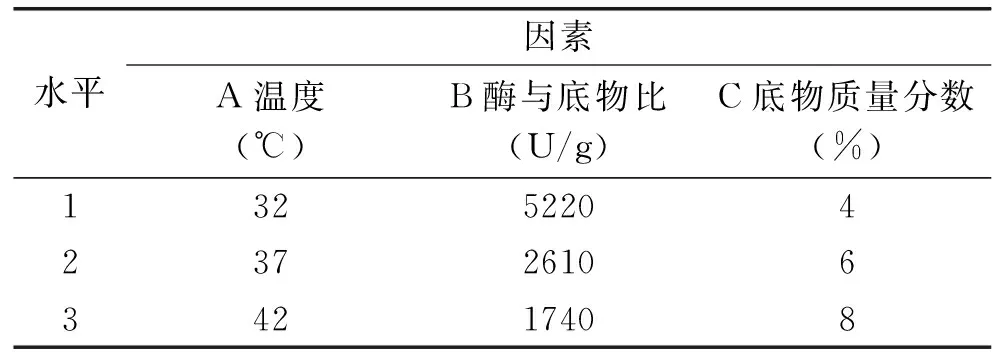
表2 胃蛋白酶水解藻胆蛋白正交实验因素水平表Table 2 Factors and levels pepsin hydrolysis spirulina phycobiliprotein orthogonal experiment
1.2.6 胰蛋白酶水解单因素实验
1.2.6.1 水解工艺 称取一定量的经胃蛋白酶水解后螺旋藻藻胆蛋白,以蒸馏水配成一定浓度溶液,水浴搅拌,待温度达到所需温度后,调节pH,按一定的酶底比加入胰蛋白酶,开始水解。在搅拌状态下,不断加入浓度为1 mol/L的NaOH,以使pH始终维持在试验规定范围内。水解结束后,沸水浴灭酶15 min。冷却后以转速6000 r/min离心30 min,取上清液冷冻干燥,-80 ℃贮藏,备用。
1.2.6.2 温度对胰蛋白酶水解藻胆蛋白 ACE 抑制率的影响 在酶与底物比为2610 U/g,底物质量分数为6%的条件下,水解温度分别控制在37、40、42、45、48、50 ℃,并分别测定藻胆蛋白的ACE抑制率。
1.2.6.3 酶与底物比对胰蛋白酶水解藻胆蛋白ACE抑制率的影响 在温度为42 ℃,底物质量分数为6%的条件下,酶与底物比分别控制在1044、1305、1740、2610、5220、13050 U/g并分别测定藻胆蛋白的ACE抑制率。
1.2.6.4 底物质量分数对胰蛋白酶水解藻胆蛋白ACE抑制率的影响 在温度为42 ℃,酶与底物比为2610 U/g的条件下,底物质量分数分别控制在2%、3%、4%、5%、6%、7%,并分别测定藻胆蛋白的ACE抑制率。
1.2.7 胰蛋白酶水解正交试验 根据单因素实验的结果,选择测得的ACE抑制率最高的试样,将所得的底物浓度、酶与底物比、水解温度值前后选择两个数值,以底物浓度、酶与底物比、水解温度为影响因素,以ACE抑制率为考察指标,进行L9(34)正交实验,因素水平见表3。将9组实验组按照1.2.6.1方法操作,所得干燥粉于-80 ℃条件下贮藏备用。
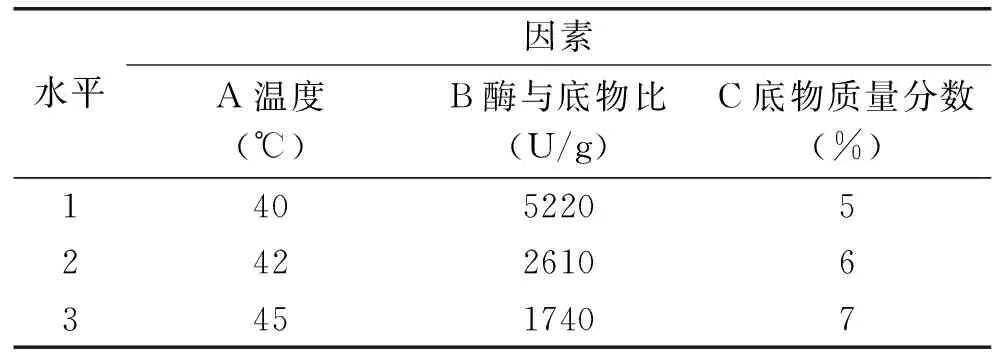
表3 胰蛋白酶水解螺旋藻藻胆蛋白正交试验因素水平表Table 3 Factors and levels trypsin hydrolysis spirulina phycobiliprotein orthogonal test
1.2.8 水解液的超滤 将最优条件下水解的水解液先用截留分子质量10 kDa超滤离心管进行超滤,超滤液再用截留分子质量为3 kDa的超滤膜进行超滤,最后分别将分子质量大于10 kDa、小于10 kDa且大于3 kDa和小于3 kDa的超滤液分别冷冻干燥后配成1 mg/mL的浓度进行ACE抑制活性的检测。
1.2.9 ACE抑制肽体外活性检测方法 采用紫外分光光度法测定乳清蛋白水解ACE抑制肽的体外活性,具体实验条件如下表4所示。

表4 ACE抑制率体外检测方法Table 4 The detection method of ACE inhibition ratio in vitro
按表4所示,将所有试剂依次加入到5 mL离心管中振荡混和均匀,待反应结束后加入1.7 mL乙酸乙酯(4 ℃),旋涡振荡20 s,萃取反应中产生的马尿酸,混匀后放入于4 ℃下预冷过的离心机离心(4000 r/min,15 min,4 ℃),吸取1.0 mL乙酸乙酯上层液至玻璃试管中,在120 ℃的恒温烘箱中烘干30 min,取出待试管冷却后加入3 mL超纯水溶解,旋涡振荡20 s,用紫外分光光度计测定复溶液在228 nm处的吸光度,每组实验做三个平行,具体计算公式如下:
式中:A代表反应体系中加入ACE抑制剂时的吸光度;B代表反应体系中仅有ACE与HHL反应时的吸光度,即对照;C代表空白反应的吸光度,即空白。
1.3 数据处理
用origin 8.5和Excel进行图表处理。
2 结果与讨论
2.1 螺旋藻粉蛋白中含量测定
通过凯氏定氮法测得螺旋藻粉中粗蛋白质的含量为65%±2.6%,为后续的藻胆蛋白的提取和分离提供基础。
2.2 反复冻融法和超声波解冻结合法提取螺旋藻藻胆蛋白
由图1可知,反复冻融5次的粗蛋白的溶出率为最高,为64.87%,5次之后粗蛋白的溶出率并没有再提高,并且有下降的趋势。
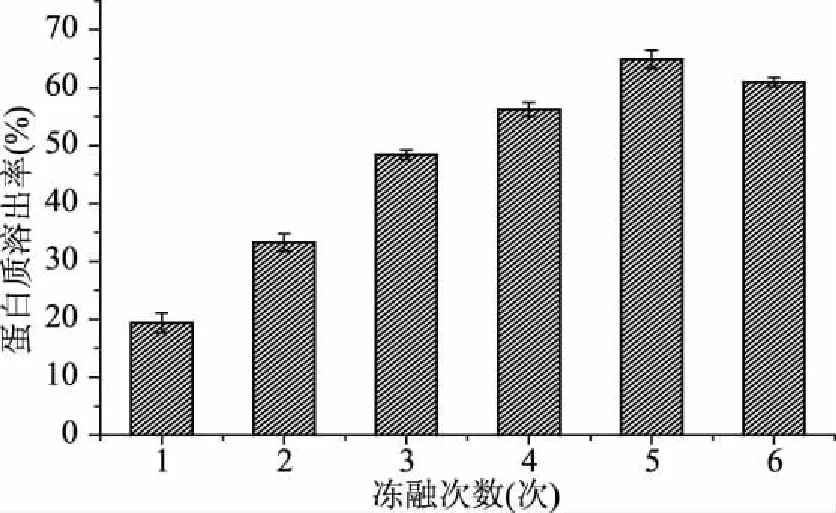
图1 不同冻融次数螺旋藻藻胆蛋白溶出率Fig.1 Dissolution rate of spirulina protein with different freezing and thawing times
2.3 等电点法分离蛋白
通过图2可知,pH由3.50到4.75,粗蛋白的提取量的趋势为是先增长后减少,其中最低为9.26 g。其中当pH为4.25时提取量达到最高,达到14.36 g。图3中,当pH逐渐增大,所测得上清液蛋白的吸光度值的趋势则恰恰相反,先减小又增大,并且在pH为4.25时,所测得吸光度值为最低,为1.306,证明此时蛋白沉淀效果最好。故综合以上图示可知,当pH为4.25时等电点沉淀的效果为最好。
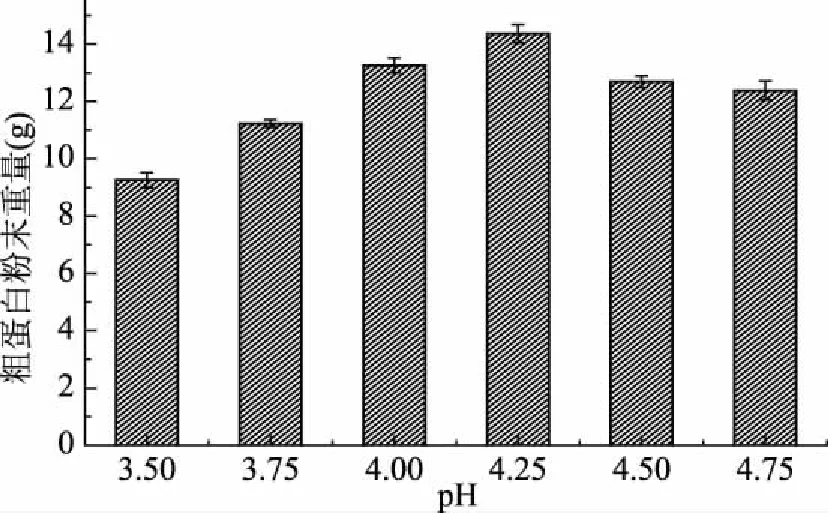
图2 不同pH下粗蛋白提取量Fig.2 Crude protein extraction at different pH values
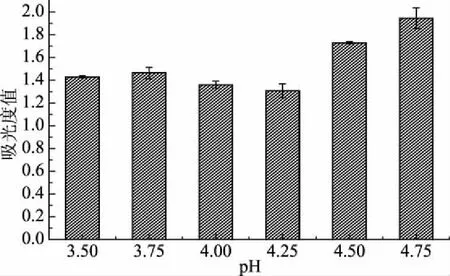
图3 不同pH下上清液吸光度值测定Fig.3 Determination of absorbance of supernatant at different pH
2.4 SDS-PAGE凝胶电泳法分析提取蛋白的种类
螺旋藻藻胆蛋白分为2大类,分别是藻蓝蛋白、藻和别藻蓝蛋白。由图4可以看出四种分子量的蛋白质,分别为110、49、24和18 kDa。Qin等[28]发现β-APC(别藻蓝蛋白β亚基)的分子量为18 kDa,所以图4集中在18 kDa的条带应该是β-APC。其他三种分子量的蛋白猜测是不同种类的藻蓝蛋白。

图4 SDS-PAGE凝胶电泳图Fig.4 SDS-PAGE gel electrophoresis注:泳道1为浓度0.5 mg/mL藻胆蛋白,泳道2为标准蛋白。
2.5 胃蛋白酶水解螺旋藻藻胆蛋白单因素实验
2.5.1 底物质量分数对水解产物ACE抑制率的影响 由图5可知,随着底物质量分数的升高,水解产物ACE抑制率也在升高,当底物质量分数达到6%时,ACE抑制率达到最高,为85.27%,之后随着底物质量分数的升高,ACE抑制率下降。因此最佳底物浓度条件为6%。
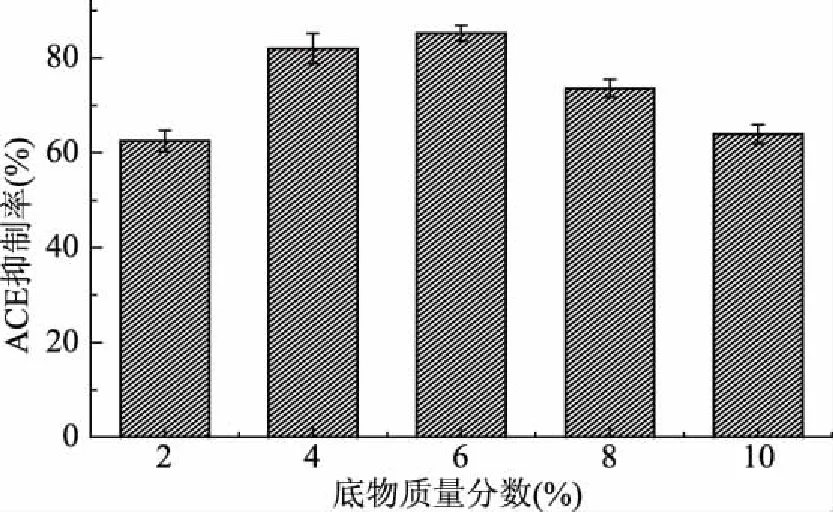
图5 不同底物质量分数条件下水解产物的ACE抑制率Fig.5 ACE inhibition rate of hydrolysate under different substrate mass fractions
2.5.2 酶与底物比对水解产物ACE抑制率的影响 由图6可见,随着酶与底物之比的升高,水解产物ACE抑制率也在升高,当酶底比达到2610 U/g时,ACE抑制率达到最高,之后随着底物浓度的升高,ACE抑制率逐渐下降。所以当酶底比达到2610 U/g时,水解产物的抑制率最高,为83.33%。即最佳酶底比为2610 U/g。
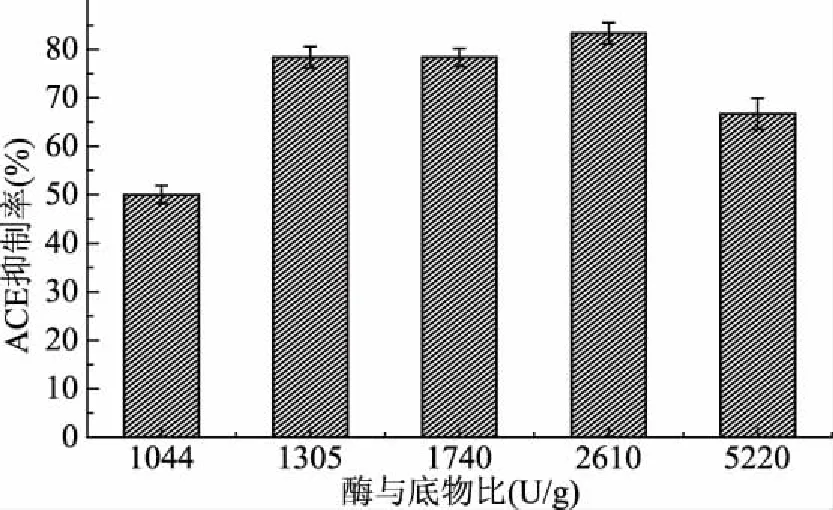
图6 不同酶底比条件下水解产物的ACE抑制率Fig.6 ACE inhibition rate of hydrolysate under different enzyme bottom ratio conditions
2.5.3 水解温度对水解产物ACE抑制率的影响 由图7可见,随着水解温度的升高,水解产物ACE抑制率先维持稳定,当水解温度达到37 ℃时,抑制率达到最高,为83.33%,之后随着水解温度的升高,抑制率逐渐下降,因此最佳水解温度为37 ℃。
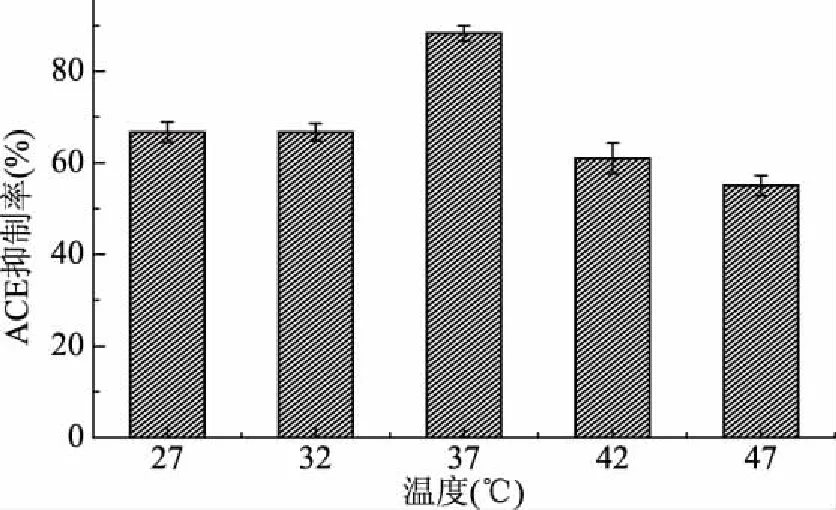
图7 不同水解温度条件下水解产物的ACE抑制率Fig.7 ACE inhibition rate of hydrolysate under different hydrolysis temperature conditions
2.6 胃蛋白酶水解螺旋藻藻胆蛋白正交实验条件
由表5可以看出,水解温度、酶底比、底物质量分数这三个不同的因素对ACE抑制率的大小都会产生一定的影响,结果影响大小排列是A>B>C,分别代表水解温度>酶和底物比值>底物质量分数,通过K值越大,实验方案可能越优的原则,选择两组A2B1C1和A2B1C3进行实验,A2B1C1组合条件下得到的ACE抑制率为80.26%,A2B1C3条件下得到的ACE抑制率为76.27%,与方案A2B1C2条件下得到的ACE抑制率进行对比,结果显示A2B1C2的条件下的ACE抑制率最高,所以最好的实验方案为A2、B1、C2,即水解温度是 37 ℃,底物质量分数6%,酶和底物的比值是5220 U/g,在这个条件下得到的ACE抑制率为82.07%。
2.7 胰蛋白酶水解藻胆蛋白的单因素试验
2.7.1 底物质量分数对水解产物的ACE抑制率的影响 由8可知,随着底物质量分数的升高,水解产物ACE抑制率也在升高,当底物质量分数达到6%时,ACE抑制率达到最高,为68.42%,之后随着底物质量分数的升高,ACE抑制率下降。因此最佳底物浓度条件为6%。

图8 不同底物质量分数的酶解产物对ACE抑制活性的影响Fig.8 Effect of ACE inhibitory activity by enzymatic hydrolysates of different substrate mass fractions
2.7.2 酶与底物比对水解产物的ACE抑制率的影响 由图9可见,随着酶与底物之比的升高,水解产物ACE抑制率也在升高,当酶底比达到2610 U/g时,ACE抑制率达到最高,之后随着底物浓度的升高,ACE抑制率维持平稳后下降。所以当酶底比达到2610 U/g时,水解产物的抑制率最高,为68.42%。即最佳酶底比为2610 U/g。
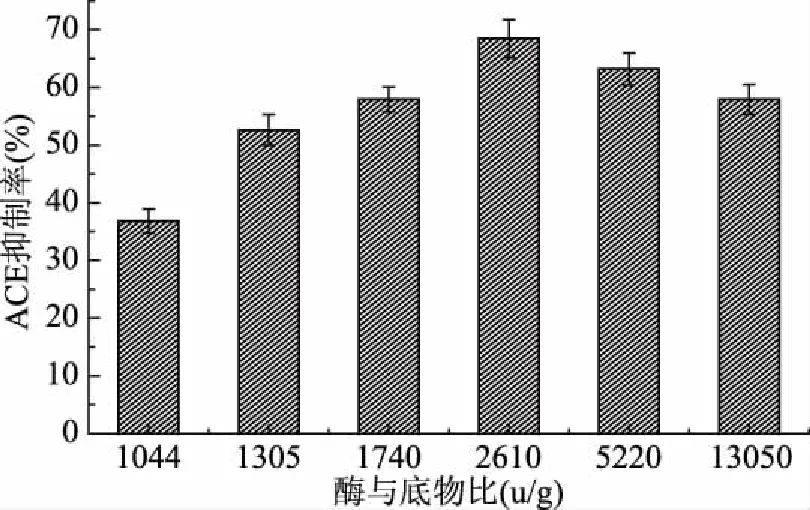
图9 不同酶与底物比的酶解产物对ACE抑制活性的影响Fig.9 Effect of ACE inhibitory activity of enzymatic hydrolysates of different enzymes to substrates
2.7.3 温度对水解产物ACE抑制率的影响 由图10可见,随着水解温度的升高,水解产物ACE抑制率逐渐升高,当水解温度达到42 ℃时,抑制率达到最高,之后随着水解温度的升高,抑制率逐渐下降。所以当水解温度达到42 ℃时,水解产物的抑制率最高,为68.42%。即最佳水解温度为42 ℃。
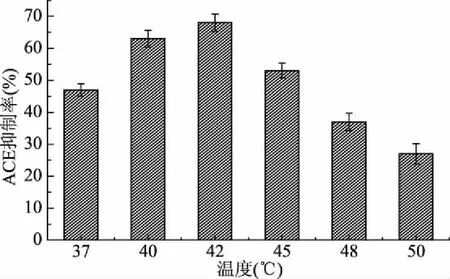
图10 不同酶解温度的酶解产物对ACE抑制活性的影响Fig.10 Effect of ACE inhibitory activity of enzymatic hydrolysate at different enzymatic temperatures
2.8 胰蛋白酶水解藻胆蛋白螺旋藻正交试验
由表6可以看出,水解温度,酶底比,底物质量分数这三个不同的因素对ACE抑制率的大小都会产生一定的影响。结果影响大小排列是A>B>C,分别代表水解温度>酶和底物比值>底物质量分数,通过K值越大,实验方案可能越优的原则,也可以得到A2B1C2组合下实验方案最好,即水解温度是42 ℃,底物质量分数6%,酶和底物的比值是5220 U/g,pH为8.0时,在这个条件下得到的ACE抑制率为80.35%。

表6 胰蛋白酶水解螺旋藻藻胆蛋白正交试验结果与分析Table 6 Results and analysis of orthogonal test of trypsin hydrolyzed spirulina phycobiliprotein
2.9 螺旋藻藻胆蛋白ACE抑制肽的超滤分离
螺旋藻藻胆蛋白酶解液经超滤分离得到3个组分,它们的ACE抑制活性如图11所示。A3组分的ACE抑制率高于其他组分,其中,A3组分的ACE抑制率为94.30%。
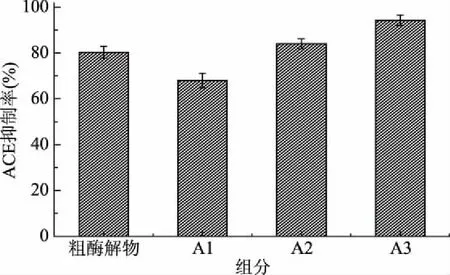
图11 酶解物不同组分的ACE抑制活性Fig.11 ACE inhibitory activity of different molecular mass hydrolysates注:A1:>10 kDa、A2:3~10 kDa和A3:<3 kDa。
3 结论
本研究以螺旋藻为原料,首先通过反复冻融法和超声波解冻结合法提取螺旋藻藻胆蛋白,反复冻融5次最佳,在反复冻融之后运用等电点沉淀法沉淀粗蛋白,经过pH梯度实验,确定了最佳沉淀pH为4.25。再通过单因素实验以及正交实验证明,利用胃蛋白酶水解螺旋藻藻胆蛋白制备有活性的ACE抑制肽时,当水解温度为37 ℃,酶与底物比为5220 U/g,底物浓度为6%时,胃蛋白酶水解螺旋藻藻胆蛋白制备所得的ACE抑制肽对ACE的抑制率最高,ACE抑制率为82.07%。利用胰蛋白酶水解螺旋藻藻胆蛋白制备有活性的ACE抑制肽时,当水解温度是 42 ℃,底物质量分数6%,酶和底物的比值是5220 U/g时,胰蛋白酶水解螺旋藻藻胆蛋白制备所得的ACE抑制肽对ACE的抑制率最高,ACE抑制率为80.35%。经过超滤得到分子量小于3 kDa的藻胆蛋白酶解液,ACE抑制率为94.30%。具有较高的活性。另一方面,本研究利用胃蛋白酶和胰蛋白酶双酶进行酶解,可以侧面反映ACE抑制肽进入人体后,不会因为人体内的胃蛋白酶和胰蛋白酶酶解导致ACE抑制率发生大幅变化。研究结果有助于深入研究螺旋藻藻胆蛋白在消化道内的消化代谢过程,并为藻胆蛋白ACE抑制肽的开发提供理论基础。
