藻蓝蛋白对非小细胞肺癌H1299生长、迁移和凋亡的功能影响
2019-08-26吴婷婷王成涛
李 爽,郝 帅,王 静,闫 燕,赵 磊,吴婷婷,王成涛
(北京工商大学食品学院,北京食品营养与人类健康高精尖创新中心, 北京市食品添加剂工程技术研究中心,北京 100048)
肺癌是全球发病率较高的一类恶性肿瘤,在肿瘤引起的死亡中占据首位,尤其在欧美一些发达国家男性恶性肿瘤中,肺癌的发生率更是长年维持在较高的水平[1]。在我国,肺癌也是发病率和死亡率最高的恶性肿瘤之一。随着工业化速度加快、环境污染加重、人口老龄化加剧,包括肺癌在内的肿瘤负担日益加重[2]。由于传统的肿瘤治疗手段例如化学疗法、放射性疗法均存在潜在的健康风险,寻找一种具有抗癌功效的安全性天然物质已经成为研究热点,其中藻蓝蛋白近年来越来越受到研究人员的关注。
藻蓝蛋白(C-phycocyanin,C-PC)源于螺旋藻、蓝藻等海洋生物,是一种具有抗氧化、抗炎和抗肿瘤活性的色素蛋白复合物[3],由开链四吡咯化合物和脱辅蛋白通过硫链键结合形成,在藻体中担任能量的传递和贮存功能[4-5]。在2014年我国发布的《GB2760-2014食品安全国家标准食品添加剂使用标准》中,已经明确了藻蓝蛋白可以作为天然食品着色剂运用于饮料、糖果、糕点等多种食品行业中。除此之外,藻蓝蛋白还具有非常优良的生物学活性,包括抗炎、抗氧化、保肝、抗肿瘤等。因此,对藻蓝蛋白功能特性的探索已经成为目前研究的热点之一[6]。
藻蓝蛋白的抗肿瘤功能在结肠癌[7]、乳腺癌[8-9]、胰腺癌[10-11]、宫颈癌[12]、卵巢癌[13]、喉癌[14]、白血病[15]、肝癌[16]等细胞系中已得到验证,但对于其在肺癌中的报道并不多。肺癌病理分型按组织学可分为非小细胞肺癌(non-small cell carcinoma,NSCLC)和小细胞肺癌(Small cell carcinoma,SCLC)两大类。非小细胞肺癌约占临床诊断的85%,且转移率高、治愈率极低。因此,探究藻蓝蛋白对非小细胞肺癌的抗癌功能和潜在机制有着重要意义。Li[17]、Bingula[18]等人研究了藻蓝蛋白和其他功能物质协同作用肺癌A549细胞并探究了其对细胞增殖凋亡的影响。本研究团队前期也证实了藻蓝蛋白能够显著抑制A549细胞的体外增殖和迁移能力[19]。为了更加深入和全面地了解藻蓝蛋白在多种非小细胞肺癌中的功能,本研究以一株典型肺癌细胞系H1299为模型,对藻蓝蛋白处理后的H1299细胞进行了体外增殖、迁移、细胞凋亡和细胞周期等方面的研究,以期为进一步开发功能食品奠定理论基础。
1 材料与方法
1.1 材料与仪器
人类非小细胞肺癌H1299细胞系 由本实验室自主保存;纯品藻蓝蛋白 由内蒙古农业大学惠赠;1%青霉素-链霉素、吉姆萨染液 美国Corning公司;DMEM细胞培养基、培养皿、96孔板、6孔板 美国Gibco公司;特级胎牛血清 天津康源生物技术公司;AnnexinV/7-AAD染色试剂盒、脱脂奶粉 美国BD公司;RT-PCR相关试剂 天根生物技术有限公司;兔抗Bax单克隆抗体、兔抗Bad单克隆抗体、兔抗Bcl-2单克隆抗体、小鼠抗Bcl-xL单克隆抗体、小鼠抗β-Actin单克隆抗体 美国Cell Signaling Technology公司;RIPA细胞裂解液、PMSF蛋白酶抑制剂、杂交袋 北京鼎国昌盛生物技术有限公司;Western Blot化学发光液、聚偏二氟乙烯(PVDF)膜 美国Millipore公司。
BioSpectrum型化学发光成像仪 美国UVP公司;超净工作台 上海博讯医疗生物仪器股份有限公司;涡旋振荡器 德国IKA公司;BSLTEP-A-224S型数字电子天平 Sartorius公司;CFX96Touch型荧光定量PCR检测系统 美国Bio-Rad公司;SpectraMaxi3型连续波长多功能酶标仪 美国MD公司;FACSJAZZ型流式细胞仪 美国BD公司;Galaxy 170S恒温CO2细胞培养箱 德国Heraeus公司。
1.2 实验方法
1.2.1 细胞培养 人类肺癌H1299细胞采用10%胎牛血清、1%青霉素-链霉素DMEM培养基培养。细胞培养箱环境为37 ℃、5% CO2。使细胞贴壁生长,每隔2~3 d传代,确保实验的细胞处于对数生长期。
1.2.2 MTT法测定细胞活力 收集处于对数生长期的细胞,胰酶消化,以每孔5000个细胞量铺于96孔板中,放置37 ℃恒温恒湿培养箱中培养12 h,分别加入终浓度为0、0.6、1.2、2.4、4.8、9.6 μmol/L(质量浓度分别为0、20、40、80、160、320 mg/L)的纯品藻蓝蛋白,继续放置培养箱分别培养48、72 h后,加入10 μL MTT溶液(储备液浓度为5 mg/mL)孵育4 h,加入100 μL SDS-HCl 裂解液(10% SDS-浓HCl 裂解液)继续孵育12 h,检测570 nm波长处吸光度A,统计数据并根据下式计算藻蓝蛋白作用细胞48、72 h的细胞存活率R,其中0 μmol/L藻蓝蛋白添加孔设置为对照组,存活率计算公式如下:
细胞存活率R(%)=[(A实验组-A对照组)/A对照组]×100
1.2.3 细胞生长曲线测定 将处于对数生长期的细胞接种于96孔板(5×104/孔)12~16 h,细胞贴壁生长后分别添加终浓度为0、4.8 μmol/L藻蓝蛋白处理,并加入10 μL的MTT(储备液浓度为5 mg/mL),4~6 h后加入100 μL的SDS-HCl裂解液(10% SDS-0.01N HCl 裂解液),12 h后测量570 nm波长处吸光度,其中0 μmol/L藻蓝蛋白添加孔设置为对照组。连续测定7 d,以时间为横坐标,吸光度值为纵坐标绘制细胞生长曲线。
1.2.4 克隆形成实验检测细胞集落形成能力 取对数期细胞接种于6孔板(2×102/孔),置于37 ℃、5% CO2培养箱中培养24 h待细胞完全贴壁,随后分别采用浓度为0、2.4和4.8 μmol/L的藻蓝蛋白处理细胞。培养2~3周,当6孔板中形成大约50个克隆数时终止培养,并用吉姆萨染液染色计算克隆数。其中0 μmol/L藻蓝蛋白处理组为对照组。
1.2.5 流式细胞术测定H1299细胞周期分布及其相关基因检测 取对数生长期细胞接种在T25的培养瓶中37 ℃过夜培养12~16 h。第2 d给细胞换液,加入藻蓝蛋白使其终浓度分别为0、2.4和4.8 μmol/L,置于37 ℃、5% CO2的培养箱中培养48 h。胰酶消化1000 r/min室温离心10 min收集细胞沉淀,PBS洗两次,用200 μL PBS重悬细胞,用1 mL注射器将细胞均匀缓慢的打到4 ℃预冷的70%乙醇中,尽量使细胞单个分散,4 ℃固定24 h以上。收集固定的细胞,用4 ℃预冷的PBS洗细胞两次,洗净残留的70%乙醇然后用500 μL PBS重悬细胞并转移到1.5 mL离心管中,在每个样品中添加终浓度为50 μg/mL的RNA酶,37 ℃消化40 min,之后加入碘化丙啶(PI)4 ℃避光染色30 min上机检测各个细胞周期时相的变化情况。其中0 μmol/L藻蓝蛋白处理组为对照组。
1.2.6 流式细胞仪检测肺癌H1299细胞的早期、晚期凋亡 取生长状态良好的细胞接种在T25培养瓶中培养24 h,分别加入0、2.4和4.8 μmol/L的藻蓝蛋白处理72 h,胰酶消化后在室温1000 r/min心10 min,用100 μL双染孵育液将洗干净的细胞沉淀重悬,加入5 μL AnnexinV-FITC染液,再加入5 μL 7-AAD染液,冰上20 min避光染色。充分混匀后上机检测细胞的凋亡情况,统计早期凋亡、晚期凋亡的细胞比例。其中0 μmol/L藻蓝蛋白处理组为对照组。
1.2.7 划痕修复实验检测细胞的迁移率 将对数期细胞接种于培养皿中,底部预先用记号笔画出三条平行线作为参考坐标,37 ℃、5% CO2培养至几乎100%汇合度。用吸头快速垂直于培养皿底部划出一道直线,用培养基轻轻冲洗除去细胞碎片,加入含有0、2.4和4.8 μmol/L藻蓝蛋白的新鲜培养基培养。分别在0、24和48 h在固定的划痕位置进行拍照,测量划痕区的宽度H并计算细胞的迁移率I,其中0 μmol/L藻蓝蛋白处理组为对照组,迁移率计算公式如下:
I(%)=[(H实验组-H对照组)/H对照组]×100
1.2.8 qRT-PCR检测细胞周期、凋亡相关基因表达 将H1299细胞接种在60 mm的培养皿中,37℃恒温恒湿培养箱过夜12 h使细胞贴壁生长,第2 d加入藻蓝蛋白处理48 h,收集细胞。利用TRIZOL法提取细胞总RNA并使用NanoDrop测定 RNA 浓度,利用反转录试剂盒进行 cDNA 合成。荧光定量PCR采用三步法。所使用的扩增引物序列如表1所示。

表1 用于qRT-PCR分析的引物序列Table 1 Primer sequences used for qRT-PCR
1.2.9 Western blot检测蛋白表达 将对数期细胞接种在培养皿中,培养24 h使细胞贴壁生长,第2 d加入藻蓝蛋白处理48 h,收集细胞。利用RIPA裂解液提取细胞全蛋白,利用Bradford法测定蛋白浓度。取50 μg等质量蛋白上样,通过12%的SDS-PAGE对蛋白进行分离,浓缩胶采用80 V电压,30 min电泳条件,分离胶采用120 v,1.5 h电泳条件,直至溴酚蓝跑至分离胶前沿时停止,取出分离胶进行转膜,350 mA 恒流转膜1.5 h,对目的蛋白条带切割,室温条件下采用5%的脱脂奶粉封闭1.5 h,加入一抗(稀释比例为1∶1000)4 ℃孵育12~16 h,随后37 ℃孵育二抗(稀释比例为1∶5000)1 h,最后对蛋白条带孵育发光液,收集化学发光信号进行曝光得到结果。
1.3 数据处理
柱状图和折线图中的实验数据均以平均数±标准差(Mean±Standard deviation)表示,采用SPSS 11.0 软件进行单因素方差分析,其中p<0.05为显著性差异(*);p<0.01为极显著差异(**)。
2 结果与分析
2.1 藻蓝蛋白对H1299细胞生长的影响
2.1.1 H1299细胞存活率和生长曲线的测定 图1显示,用不同剂量藻蓝蛋白分别处理肺癌H1299细胞48和72 h,细胞存活率均出现了显著或极显著降低(p<0.05或p<0.01);同时,在同一作用时间下,随着藻蓝蛋白浓度的提高,细胞存活率也显著下降(p<0.05或p<0.01)。在MTT法检测细胞存活力实验中,由于需要观察不同浓度梯度下的存活率,选择了多个浓度进行试验(0、0.6、1.2、2.4、4.8、9.6 μmol/L),而生长曲线是对存活率的进一步验证,因此挑选了一个具有代表性的浓度(4.8 μmol/L)进行了实验,进一步检测藻蓝蛋白对H1299细胞生长的影响。由图2可知,实验组从第3 d开始生长受到显著抑制,第4 d以后受到极显著抑制,细胞数量极显著低于对照组(p<0.01)。以上结果表明,藻蓝蛋白对肺癌H1299细胞的生长在一定程度上有抑制作用。
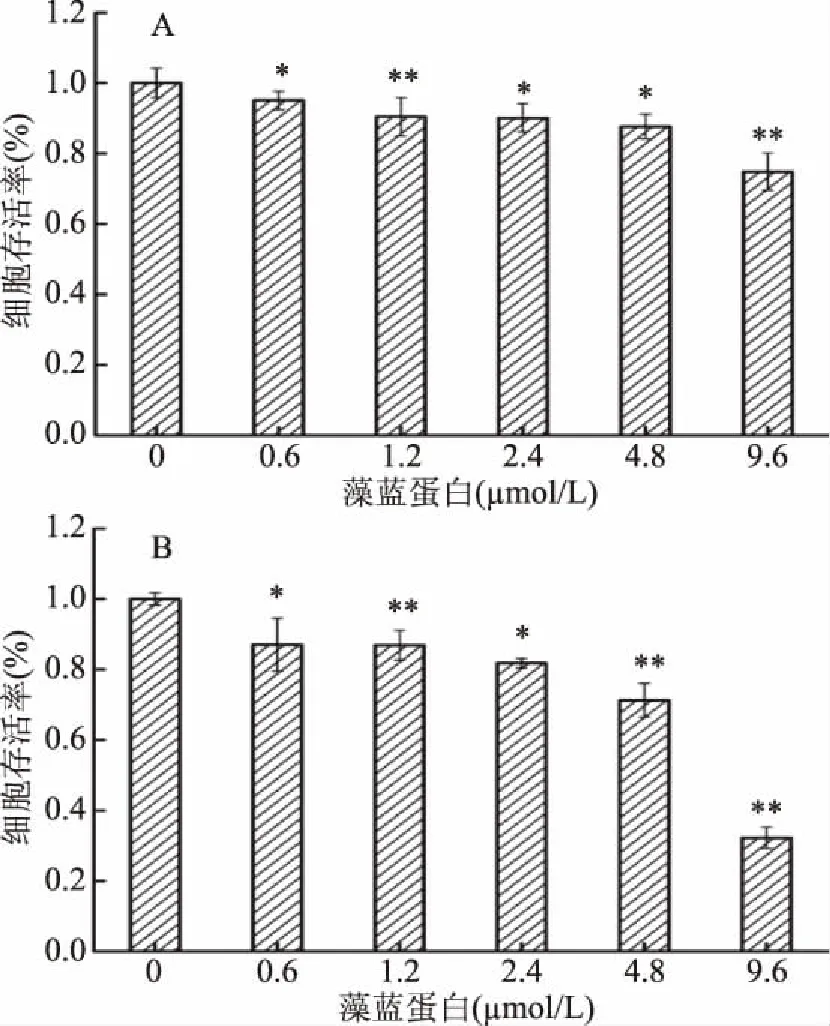
图1 藻蓝蛋白对肺癌H1299细胞活力的影响Fig.1 Effect of C-phycocyanin on the viability of lung cancer H1299 cells注:* 与对照组相比差异显著(p<0.05);** 与对照组相比差异极显著(p<0.01);A:48 h;B:72 h;图2~图4同。

图2 藻蓝蛋白对肺癌H1299细胞生长的影响Fig.2 Effects of C-phycocyanin on the proliferation of lung cancer H1299 cells
2.1.2 藻蓝蛋白对H1299细胞集落形成能力的影响 细胞周期、细胞凋亡、细胞集落实验、细胞迁移实验中我们均统一调整成了三个具有代表性的浓度(0、2.4、4.8 μmol/L)进行实验,从图3可知,随着藻蓝蛋白浓度的增加,细胞集落个数越来越少,与对照组相比出现显著性差异(p<0.05)。由此可知,藻蓝蛋白对H1299细胞集落形成能力有显著抑制作用。

图3 藻蓝蛋白对H1299细胞集落形成能力的影响Fig.3 Effect of C-phycocyanin on colony forming ability of lung cancer H1299 cells
2.1.3 H1299细胞的周期分布及其相关基因的检测 采用流式细胞术研究了藻蓝蛋白处理对细胞周期的影响。由图4可知,与对照组相比,藻蓝蛋白处理组G1期细胞数量极显著减少(p<0.01),S期细胞数量极显著增加(p<0.01),表明细胞周期阻滞在了S期。随后利用荧光定量PCR进一步检测了周期相关基因的表达。周期蛋白家族和周期蛋白依赖激酶(cyclin-dependent kinase,Cdk)家族在周期运转调控中起重要作用。Cdk与周期蛋白结合形成异源二聚体的复合物,具有蛋白激酶活性[20]。CyclinA与CDK2结合共同调控细胞S期向G2期的转换,同时周期抑制因子P21、P27作用于CDKs,使细胞阻滞在S期[21]。流式细胞术结果显示0、2.4、4.8 μmol/L浓度的藻蓝蛋白使H1299细胞周期阻滞在S期,为了进一步验证藻蓝蛋白对周期基因的调控,我们进一步选取阻滞效果最好的4.8 μmol/L浓度藻蓝蛋白作用的细胞进行定量PCR的检测。图5结果显示,与对照组相比,实验组细胞中p27、cdk2显著下调(p<0.05),cyclinA极显著下调(p<0.01),同时周期抑制因子p21极显著上调(p<0.01),这些基因的改变可能使得细胞无法正常进入G2期,这与细胞周期的结果是一致的。
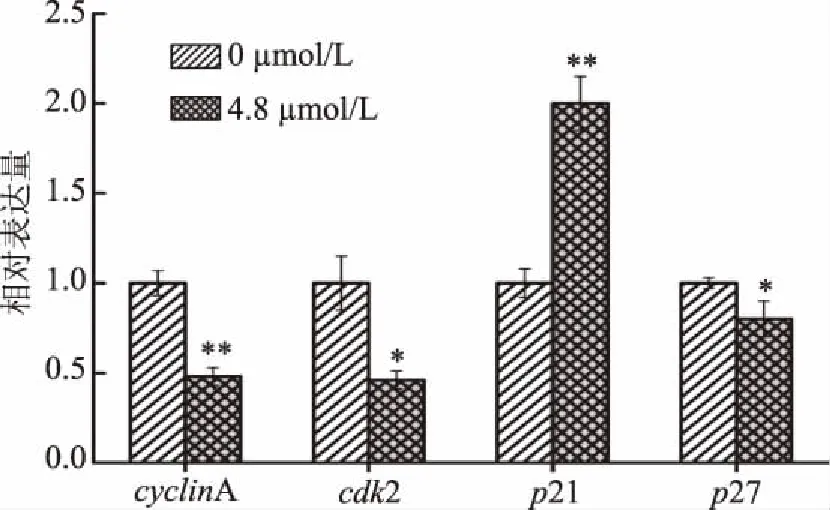
图5 藻蓝蛋白影响肺癌H1299细胞周期相关基因表达Fig.5 Effect of C-phycocyanin on the expression of cell cycle related genes in H1299 cells
2.2 藻蓝蛋白对H1299细胞凋亡的影响
采用流式细胞术对藻蓝蛋白处理后的H1299细胞的凋亡程度进行了检测。细胞在凋亡启动早期阶段时,细胞中的磷脂酰丝氨酸会由细胞内向细胞外发生翻转,能够与Annexin-V特异性地结合,但细胞膜并没有发生破裂,因此FITC荧光出现阳性信号,7-AAD出现阴性信号;而细胞在晚期凋亡时,细胞膜发生裂解,7-AAD能够进入细胞与DNA结合,因此FITC和7-AAD均出现阳性信号。由图6可知,与对照组相比,2.4 μmol/L藻蓝蛋白浓度处理的细胞早期凋亡比例(2.01%±0.36%)和晚期凋亡比例(4.53%±0.21%)均出现显著或极显著增加(p<0.05或p<0.01);随着处理浓度的增加,4.8 μmol/L藻蓝蛋白处理后,早期(2.55%±0.32%)和晚期(11.3%±0.16%)凋亡细胞的比例也出现显著或极显著增多(p<0.05或p<0.01)。以上实验结果表明藻蓝蛋白对肺癌H1299细胞有促凋亡作用。

图6 藻蓝蛋白对肺癌H1299细胞凋亡的影响Fig.6 Effect of phycocyanin on the apoptosis of lung cancer H1299 cells
流式细胞术结果显示0、2.4、4.8 μmol/L浓度的藻蓝蛋白使H1299细胞出现浓度依赖性凋亡,为了进一步验证藻蓝蛋白对促、抑凋亡基因和蛋白的调控,我们进一步选取凋亡效果最好的4.8 μmol/L浓度藻蓝蛋白作用的细胞进行定量PCR和Western Blot的检测。采用4.8 μmol/L藻蓝蛋白浓度处理细胞后,对凋亡相关基因和蛋白分别进行了定量PCR和Western Blot检测。图7和图8结果显示,藻蓝蛋白处理后,促凋亡基因bcl-w、bad、bax以及bid的转录和蛋白水平显著上调(p<0.05),bak、bim极显著上调(p<0.01),抑凋亡基因bcl-xL则出现显著下调(p<0.05),bcl-2极显著下调(p<0.01)。此结果与流式细胞术的凋亡实验相一致。

图7 藻蓝蛋白影响肺癌H1299细胞凋亡相关基因的表达Fig.7 Effect of phycocyanin on the expression of apoptosis-related genes in lung cancer H1299 cells
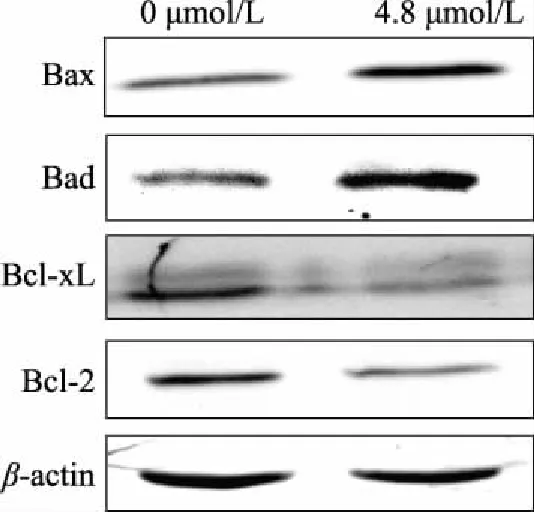
图8 藻蓝蛋白影响肺癌H1299细胞凋亡相关蛋白的表达Fig.8 Effect of C-phycocyanin on the expression of apoptosis-related proteins in H1299 cells
2.3 藻蓝蛋白对H1299体外迁移能力的影响
采用体外划痕修复实验研究了藻蓝蛋白对肺癌H1299细胞体外迁移的影响。由图9可知,随着处理浓度的增加,细胞迁移率逐渐降低。藻蓝蛋白作用48 h时,2.4和4.8 μmol/L处理量下的细胞迁移率分别为56.3%±2.35%与33.5%±1.22%。此结果表明,藻蓝蛋白能够显著抑制H1299细胞的体迁移能力。
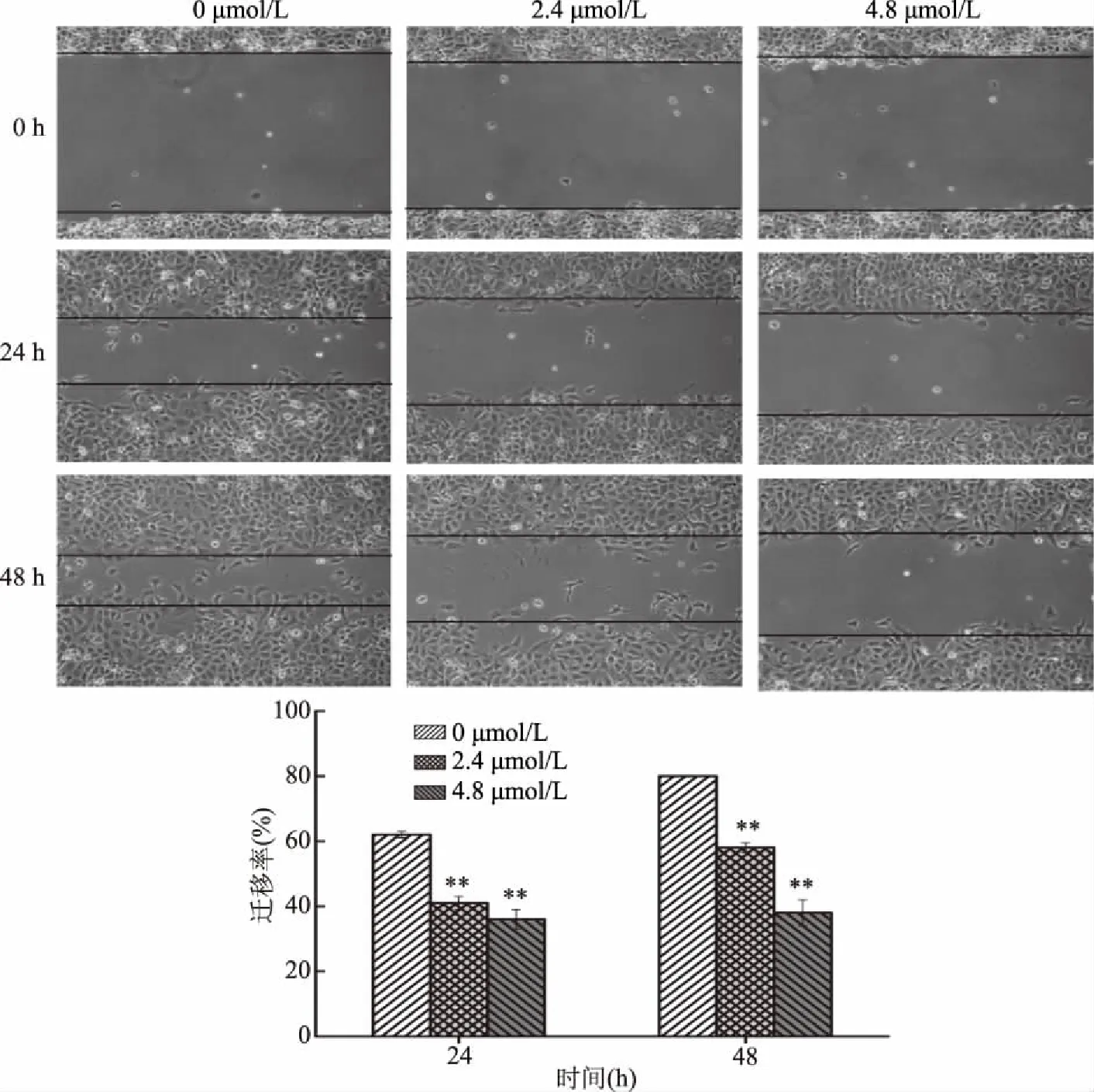
图9 藻蓝蛋白对肺癌H1299体外迁移能力的影响Fig.9 Effect of C-phycocyanin on the in vitro migration of lung cancer H1299 cells
随后利用Western Blot检测了4.8 μmol/L藻蓝蛋白处理后的H1299细胞内基质金属蛋白酶MMP-2和MMP-9的水平。基质金属蛋白酶(matrix metalloproteinases,MMPs)是细胞迁移过程中重要的蛋白酶,是调节细胞外基质生长的重要系统,细胞外基质主要成分是血管,血管形成是肿瘤转移的重要因素,MMP-2,MMP-9均属明胶酶类,是能够降解IV型胶原的主要基质水解酶,其中MMP-9是MMPs系统中最大的酶、MMP-2能降解I型胶原纤维,均与细胞迁移密切相关,并在恶性肿瘤中都有过度的表达[22-25]。结果显示,藻蓝蛋白处理后,细胞中MMP-2、MMP-9蛋白水平的表达均有所下调(图10)。结果与体外划痕修复实验一致。
3 结论
本论文以非小细胞肺癌H1299细胞模型为基础,系统研究了藻蓝蛋白对H1299细胞增殖、凋亡和迁移的影响。研究表明藻蓝蛋白能够通过影响细胞周期基因cyclinA,cdk2和p21的表达使细胞阻滞在S期,进而降低细胞活力,抑制细胞的生长和克隆形成能力;同时,藻蓝蛋白能够通过调控凋亡相关基因和蛋白的表达诱导H1299细胞发生凋亡;此外,藻蓝蛋白也能通过降低MMP-2和MMP-9蛋白的表达水平而抑制H1299细胞的体外迁移能力。本研究充分证实了藻蓝蛋白对非小细胞H1299细胞的抑制作用,为开发新型的具有抗肺癌功能的功能食品以及肺癌的治疗提供了重要的理论依据和实验基础。
