余甘子果渣多酚提取工艺优化及其抗氧化活性分析
2019-08-26甘瑾,何钊,张弘,冯颖
甘 瑾,何 钊,张 弘,冯 颖
(中国林业科学研究院资源昆虫研究所,云南昆明 650213)
余甘子(PhyllanthusemblicaL.)是一种热带、亚热带落叶灌木或小乔木,属大戟科(Euphorbiaceae)叶下球属(Phyllanthus),野生果在中国分布面积大、产量高,资源十分丰富,是我国重要的经济林果。现代大量研究证实余甘果具有预防肿瘤、降血脂、降血糖、提高免疫力、保肝等多种特殊生理功效[1-4]。针对余甘子显著的营养保健价值,已有许多研究者及加工企业对其进行了开发利用。但目前对余甘子的开发主要是对果实进行榨汁,然后加工成饮料、精粉及含片等产品。余甘子果实榨汁后,剩余果渣占原果重的65%左右,大量果渣作为废弃物堆放,会很快发酵和滋生各种霉菌,对环境造成较大的污染。多酚类物质是余甘子多种特殊生理功能的基础[1,5-7],我们的前期工作已对榨汁后得到的原汁中的多酚进行了分离纯化及抗氧化活性等方面的研究,发现余甘子果渣中残留了大量的多酚类物质[8]。如果对果渣中的多酚类物质也进行系统的开发研究,对于减少余甘子生产中对环境造成的污染、提高资源利用率、促进余甘子产业的发展都有积极的作用。
多酚提取方法主要包括溶剂萃取法、超声和微波辅助提取法、超临界萃取法及高压快速提取法等。溶剂提取法因不容易破坏多酚结构和活性、设备成本低、操作简便及较适应工业化生产等特点而应用较多[9]。因此本文拟采用溶剂提取法,通过单因素试验、响应曲面试验分析,优化出最佳的余甘子果渣多酚提取工艺,并从抗氧化能力指数、离子还原能力、自由基清除能力和脂质过氧化抑制能力等方面对提取物的抗氧化活性进行评价,为余甘子果渣多酚的进一步研究奠定试验基础。
1 材料与方法
1.1 材料与仪器
余甘子果渣 余甘子果实经压榨后而剩余的残渣,自然干燥,粉碎过40目,水分含量为4.12%,-4 ℃贮藏,由云南天启生物技术有限公司提供;没食子酸标准品、AAPH、FL、Tolox、TPTZ、ABTS、β-胡萝卜素、亚油酸等生化试剂 购于昆明庭汇科技有限公司;其余试剂 均为国产分析纯。
AB204-S型电子分析天秤 瑞士梅特勒托利多仪器有限公司;N1000型旋转蒸发仪 日本东京理化仪器有限公司;ALPHA1-2LD plus真空冷冻干燥机 德国Martin Christ公司;HH-6型水浴锅 常州澳华仪器有限公司;Thermol Varioskan Flash全波长多功能酶标仪 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 多酚提取工艺 采用水浴加热、溶剂提取的方法,在一定乙醇体积分数、一定提取温度、一定提取时间、一定料液比的条件下,对余甘子果渣中的多酚进行提取,每个样品提取3次,合并滤液,得到提取液,分析提取液多酚含量,计算多酚提取量。
1.2.2 单因素实验 在料液比为1∶25 g/mL,提取温度为60 ℃,提取时间为2 h的条件下,考察不同乙醇溶液体积分数(40%、50%、60%、70%、80%、90%)对多酚提取量的影响;在料液比为1∶25 g/mL,乙醇溶液体积分数为60%,提取时间为2 h的条件下,考察不同提取温度(40、50、60、70、80、90 ℃)对多酚提取量的影响;在料液比为1∶25 g/mL,乙醇溶液体积分数为60%,提取温度为60 ℃的条件下,考察不同提取时间(1、2、3、4、5 h)对多酚提取量的影响;在乙醇溶液体积分数为60%,提取温度为60 ℃,提取时间为2 h的条件下,考察不同料比(1∶15、1∶20、1∶25、1∶30、1∶35、1∶40 g/mL)对多酚提取量的影响。
1.2.3 响应曲面优化试验 根据单因素试验结果,选择乙醇体积分数、提取时间、料液比3个因素,以多酚提取量为响应值,采用3因素3水平的Box-Behnken响应面分析法,对提取条件进行优化分析,得到二次回归方程,并确定最佳工艺参数。试验因素及水平表见1。
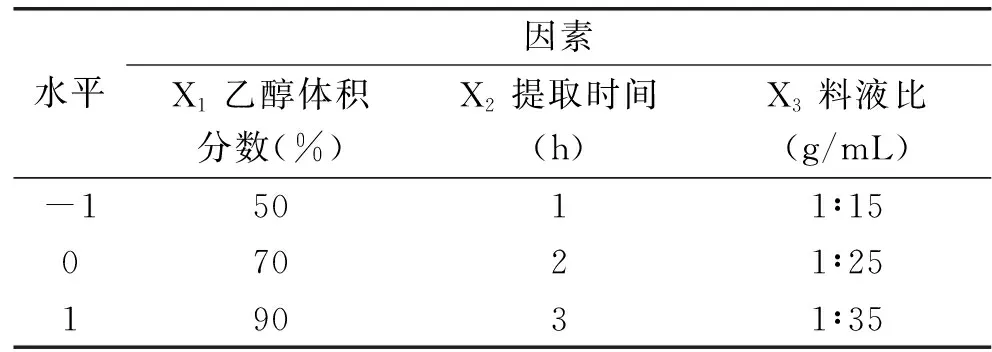
表1 响应曲面因素及水平Table 1 Factors and levels of response surface methodology
1.2.4 多酚含量测定 参考Gan等[10]的方法,吸取浓度为100 μg/mL的没食子酸标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL,分别加入FC显色剂1 mL,10%碳酸钠溶液3 mL,定容至10 mL,在30 ℃水浴中反应2 h,于多酚显色物最大吸收波长765 nm处测定吸光度,以标准品浓度为横坐标,吸光度为纵坐标建立标准曲线,回归方程为Y=0.0076X+0.0491,线性相关系数R2为0.9973。取经过稀释的提取溶液0.5 mL,每个提取液做3个平行,重复上述步骤,于765 nm处测定吸光度,根据标准曲线计算提取液多酚含量,多酚提取量根据公式(1)进行计算:

式(1)
式中:C为由标准曲线计算得到的浓度(mg/mL);T为提取液的稀释倍数;V为提取液的总体积(mL);M为用于提取的样品量(g)。
1.2.5 提取物体外抗氧化活性分析 余甘子果渣提取液经35 ℃真空浓缩、冷冻干燥,得到果渣多酚提取物,贮藏于-18 ℃,用于抗氧化活性分析。
1.2.5.1 抗氧化能力指数(ORAC)分析 参考Chirions等[11]的方法,并进行了适当调整,即样品、对照品及所用试剂均用pH7.4的75 mmol/L磷酸缓冲液稀释到一定浓度,然后在96微孔板的空白孔加入25 μL pH7.4的75 mmol/L磷酸缓冲液、标准品孔加入25 μL不同浓度(3.125、6.25、12.5、25、50 μmol/L)的Trolox溶液、样品孔加入25 μL样品溶液、阳性对照孔加入25 μL VC溶液、自由基AAPH孔加入25 μL 75 mmol/L磷酸缓冲液,并重复3次。并在上述微孔加入150 μL 8.16×10-5mmol/L的荧光素(FL)溶液,摇均,37 ℃加热10 min,再加入25 μL 153 mmol/L的AAPH溶液(空白孔不加),摇均。然后每2 min测定1次各孔荧光强度,测定时间设置到荧光强度衰减到基线为止,共测定30次,激发波长为485 nm,发射波长为538 nm。
各微孔不同时间点的绝对荧光强度读数与对应时间的空白孔的荧光强度相比,得到不同时间点的相对荧光强度fn,用公式(2)计算各微孔中样品荧光衰退的曲线下面积(AUC),按公式(3)计算曲线的延缓部分面积(NetAUC),以Trolox的不同浓度为横坐标,对应的NetAUC为纵坐标,绘制标准曲线,得到回归方程Y=0.2324X+0.0487,R2为0.9799,根据样品、阳性对照的NetAUC计算出一定量样品相当于μmol Trolox的值,即ORAC指数,以μmol Trolox/μg表示。
曲线下面积(AUC)=2×(f0+f1……+fn-1+fn)-f0-fn
式(2)
式中:f0、f1、fn-1、fn为对应测定点的相对荧光强度。
曲线的延缓部分面积(NetAUC)=AUC样品、对照品、标准品-AUCAAPH
式(3)
1.2.5.2 铁离子还原能力(FRAP)分析 参考Benzie等[12]的方法,并做适当调整,分别吸取0、0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16 mL的1 mmol/L FeSO4溶液,加蒸馏水补充至0.2 mL,再分别加入3.8 mL FRAP试剂,混匀后在37 ℃下反应10 min,测定593 nm波长处吸光度。以吸光度为纵坐标,FeSO4浓度为横坐标,绘制标准曲线,回归方程为Y=2.1599X+0.1753,R2为0.9925。取浓度为0.15 mg/mL的样品溶液重复上述步骤,每个样品做3个平行,根据标准曲线计算FeSO4的浓度,样品的还原能力以达到同样吸光度所需的FeSO4的浓度表示,以VC为阳性对照。
1.2.5.3 ABTS自由基清除能力的测定 按照参考文献[13]的方法,并做适当调整,将等体积的7 mmol/L ABTS溶液与2.45 mmol/L K2S2O8溶液混合并置于暗处12~16 h,以制备ABTS+·溶液。用蒸馏水将ABTS+·溶液稀释至其在734 nm波长处吸光度为0.07±0.02。在比色管中加入0.3 mL样品稀释液和3 mL ABTS+·稀释溶液,6 min后测定其在734 nm 波长处的吸光度,按公式(4)计算清除率。
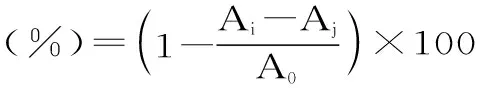
式(4)
式中:Ai为样品与ABTS+·自由基反应后体系的吸光度;Aj为样品本身吸光度(以蒸馏水替代ABTS+·溶液);A0为未加样品空白值(以蒸馏水替代样品)的吸光度。
分别测定不同浓度样品的清除率,以清除率为纵坐标,样品浓度为横坐标,绘制曲线,回归方程为Y=4.1002X+20.299,R2为0.9934,以此为依据计算半抑制浓度IC50,采用VC、Trolox为阳性对照。
1.2.5.4 脂质过氧化抑制能力的测定 采用β-胡萝卜素漂白试验[14]进行,并做适当调整,取0.8 mgβ-胡萝卜素溶解于10 mL氯仿中,向其中加入80 mg亚油酸以及800 mg吐温80,40 ℃下真空浓缩去除氯仿,加入200 mL蒸馏水制成乳浊液。取5 mL上述制备好的乳浊液,加入1 mL不同浓度样品溶液,以1.0 mL去离子水代替样品作为对照组,混合均匀后,在470 nm波长处测定吸光度作为零时刻的吸光度。然后将反应液置于50 ℃下水浴保温2 h。再次测定470 nm 波长处吸光度。脂质氧化抑制率根据公式(5)进行计算。
式(5)
分别测定样品不同浓度的抑制率,以抑制率为纵坐标,样品浓度为横坐标,绘制曲线,回归方程为Y=2.9023X-1.0039,R2为0.9248,以此为依据计算半抑制浓度IC50,采用BHT和Trolox为阳性对照。
1.3 数据处理
实验结果以“平均数±标准差”表示,差异分析采用SPSS软件13.0版的One-Way ANOVA分析方法,多重比较采用Bonferroni及Duncan检验。
2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇体积分数对余甘子果渣多酚提取量的影响 不同体积分数乙醇溶液对余甘子果渣多酚提取量的影响同见图1,当乙醇体积分数在40%~60%范围内,多酚提取量随着乙醇体积分数的升高逐渐提高,乙醇体积分数60%时多酚提取量达到最大为132.42 mg/g;乙醇体积分数超过70%时,多酚提取量开始显著下降(p<0.01),乙醇体积分数为90%时,多酚提取量下降到106.14 mg/g。溶剂提取方法主要是依据相似相容的原理,浸提溶剂的极性是影响天然多酚提取量的重要因素[15],60%~70%体积分数乙醇的极性与余甘子果渣多酚极性相似,多酚提取量较高。60%乙醇体积分数的多酚提取量最高,但与50%、70%的多酚提取量十分相近,差异不显著(p>0.01),因此为增加因素水平间的显著性,从而提高响应面模型的显著性,宜以70%为中心,选择50%、70%、90%三个水平进行后续优化。
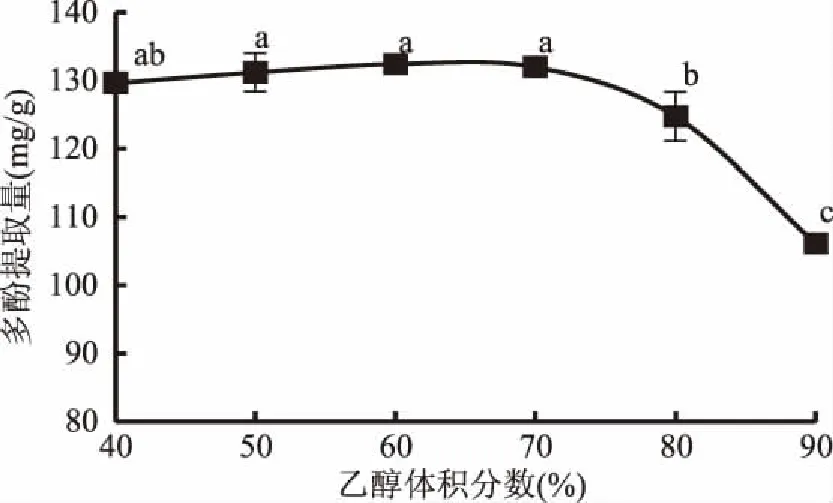
图1 乙醇体积分数对余甘子果渣多酚提取量的影响Fig.1 Effects of ethanol volume fraction on extaction amount of polyphenols注:图中不同字母表示各数据差异显著(p<0.01),图2~图4同。
2.1.2 提取温度对余甘子果渣多酚提取量的影响 提取温度对多酚提取量的影响见图2,当提取温度从40 ℃升至60 ℃时,多酚提取量也随之升高,60 ℃后,随着温度的升高多酚提取量有所下降,温度升高到90 ℃时多酚提取量最低。温度升高可增加提取物的溶解度和扩散系数,降低溶剂的黏度,但也会引起酚类化合物的降解,降低多酚提取量[16]。从显著性分析可看出,虽然不同温度的多酚提取量有差异,但差异显著性不大,且无明显的转折点,表明其对多酚提取量的影响不显著,后续试验将不再对此因素进行优化,60 ℃时多酚提取量相对较高,为124.31 mg/g,因此可确定60 ℃为最佳的提取温度。
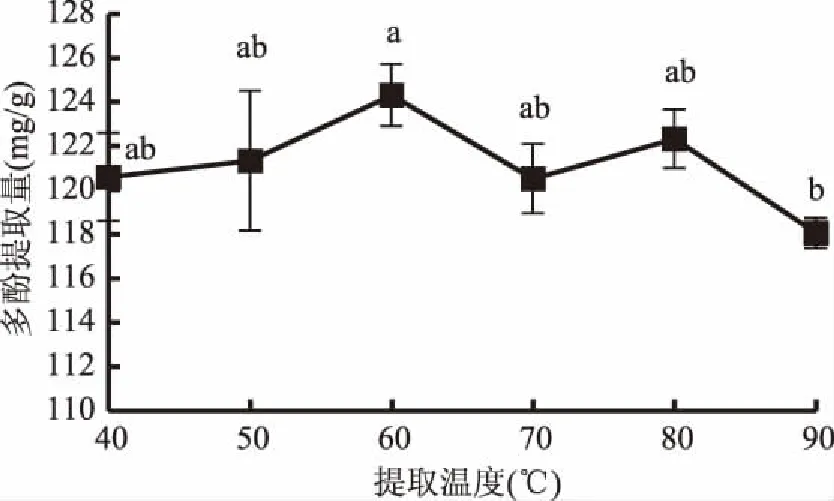
图2 提取温度对余甘子果渣多酚提取量的影响Fig.2 Effects of temperature on extaction amount of polyphenols
2.1.3 提取时间对余甘子果渣多酚提取量的影响 提取时间对多酚提取量的影响见图3,提取时间为2 h的多酚提取量与提取1、4、5 h的多酚提取量存在显著差异(p<0.01),提取时间为2 h时的多酚提取量大于1 h的提取量,提取时间大于2 h,多酚提取量随提取时间延长而降低。提取时间为2 h时,多酚提取量最高,因此选择1、2、3 h三个水平进行进一步优化。
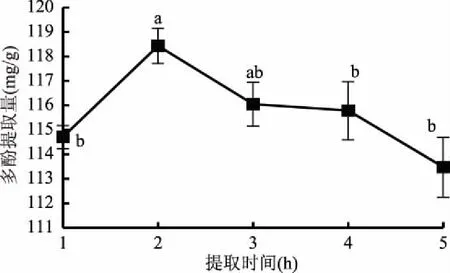
图3 提取时间对余甘子果渣多酚提取量的影响Fig.3 Effects of extraction time on extaction amount of polyphenols
2.1.4 料液比对余甘子果渣多酚提取量的影响 料液比对多酚提取量的影响见图4,随着料液比的增加,多酚提取量出现不断升高的趋势,料液比为1∶25 g/mL时达到最大值,随后开始下降,当料液比达1∶35 g/mL后多酚提取量趋于平稳。料液比为1∶25 g/mL的多酚提取量与1∶15、1∶30、1∶35、1∶40 g/mL料液比的多酚提取量相比,存在显著差异(p<0.01),当料液比为1∶25 g/mL时,多酚提取量最高达到135.91 mg/g,因此选择1∶15、1∶25、1∶35 g/mL三个因素进行进一步优化。
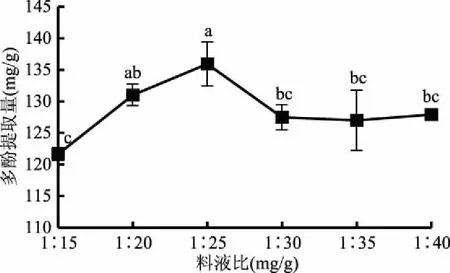
图4 料液比对余甘子果渣多酚提取量的影响Fig.4 Effects of ratio of material to solvent on extaction amount of polyphenols
2.2 响应曲面试验结果与分析
2.2.1 响应曲面回归模型的建立与分析 在单因素试验的基础上,综合考虑各因素对多酚提取量影响的显著性,确定最佳提取温度为60 ℃,选择以乙醇体积分数(X1)、提取时间(X2)、料液比(X3)为自变量,多酚提取量(Y)为响应值,设计三因素三水平的Box-Behnken试验,试验方案及结果见表2。
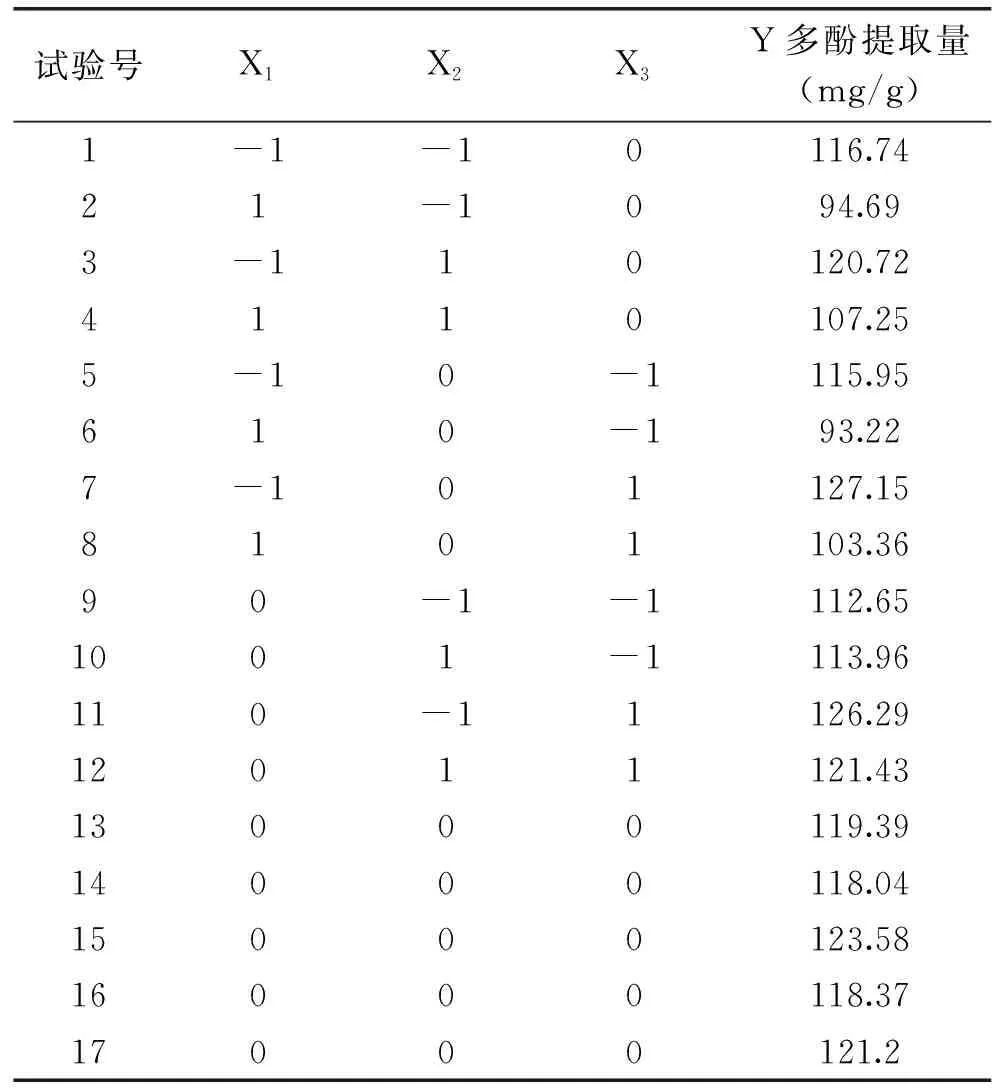
表2 Box-Behnken试验方案及结果Table 2 Box-Behnken experimental design and results
采用Design-Expert 8.0.6对试验结果进行优化分析,得到二次多元回归方程为:
Y=3.94+0.023X1+7.74×10-3X2+0.011X3+1.14×10-3X1X2+1.38×10-5X1X3-1.27×10-3X2X3-2.19×10-4-5.96×10-3-7.84×10-5
对回归方程进行方差分析,结果见表3。
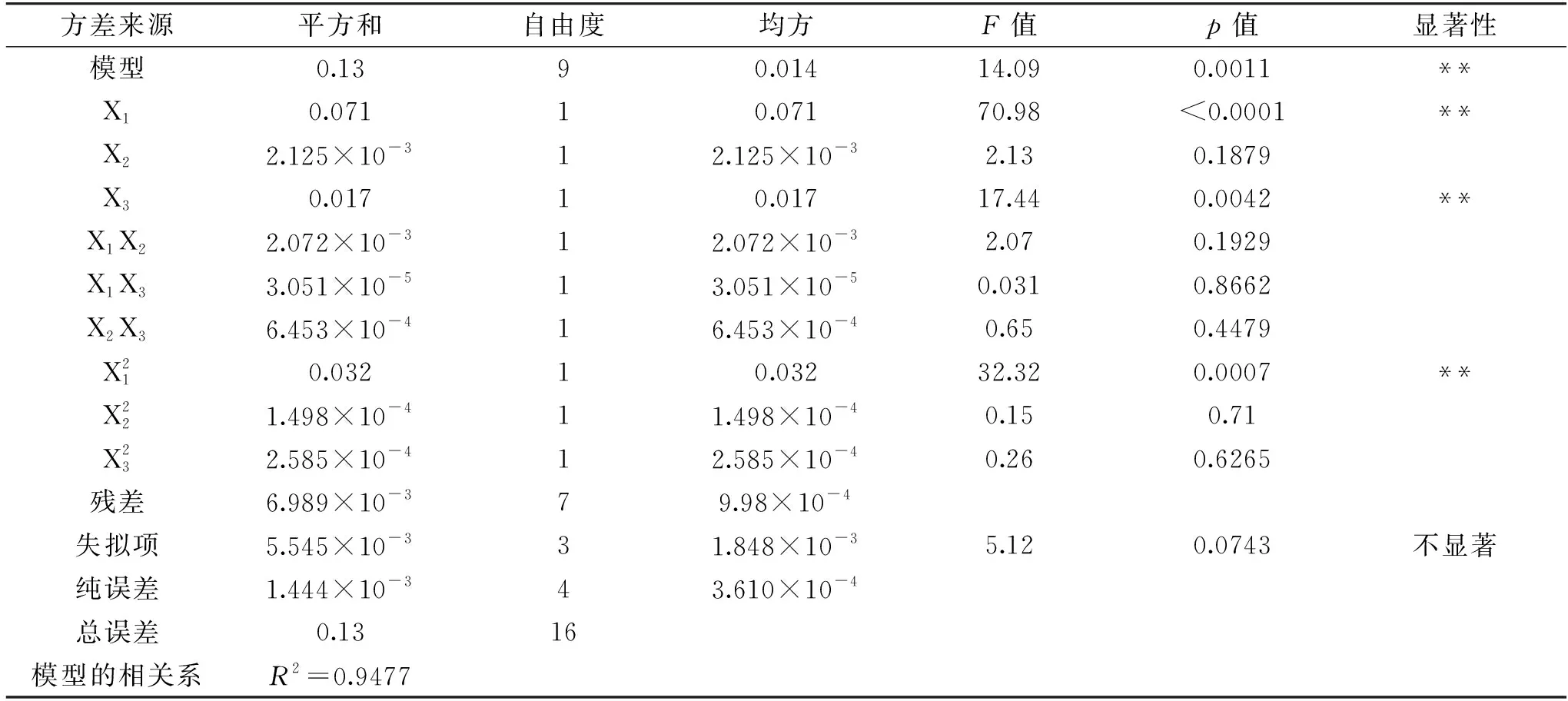
表3 回归模型方差分析表Table 3 The variance analysis of regression model
从表3可以看出,模型p<0.01,说明该模型差异极显著,该模型的R2=0.9477表示模型与实际实验拟合程度好,也说明回归模型能解释94.77%响应值的变化。该模型的失拟项p=0.0743>0.05,没有显著意义,说明数据中没有异常的点,模型是可靠的,能对实验结果进行预测和分析。由F值和显著性可知,余甘子果渣多酚提取量的影响因素主次顺序为乙醇体积分数>料液比>提取时间,乙醇体积分数和料液比均达到极显著的影响(p<0.01),其中乙醇体积分数的一次项和二次项均为极显著,表明其为最主要的影响因素。
2.2.2 任意两因素交互作用的分析 任意两因素交互作用的响应曲面见图5。其中A、B、C各图是由响应值和各试验因子间构成的立体曲面图,显示了乙醇体积分数、提取时间和料液比中任意一个变量取0水平时,其余两个变量对余甘子果渣多酚提取量的影响。
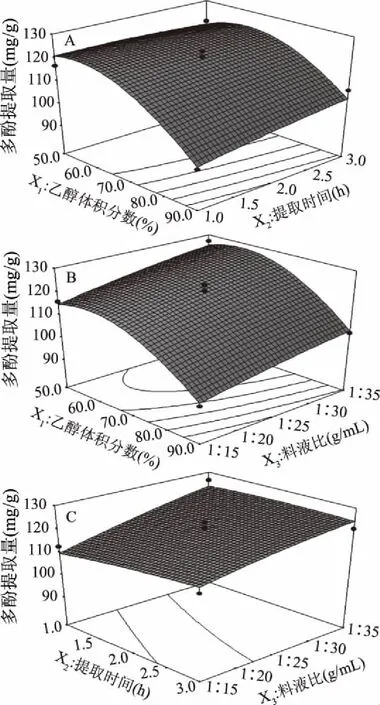
图5 任意两变量对多酚提取量影响的响应曲面图Fig.5 Response surface plots for the effects of any two variables on extaction amount of polyphenols
图5A是料液比为1∶25 g/mL时,乙醇体积分数和提取时间对多酚提取量的交互作用。由图可见,提取时间一定时,随着乙醇体积分数的增大,多酚提取量先有一点缓慢上升的趋势,随后开始明显下降;乙醇体积分数大约在65%~90%的范围时,多酚提取量随提取时间的延长有所提高,当乙醇体积分数大约在50%~65%的范围内,随提取时间的延长,多酚提取量的变化趋于平缓,表明乙醇体积分数的变化对提取时间与多酚提取量的相关性存在一定的影响,两者存在交互作用。
图5B是提取时间为2 h时,乙醇体积分数和料液比对多酚提取量的交互作用。由图可知,当料液比一定时,随着乙醇体积分数的增大,多酚提取量的先略有上升然后快速下降;当乙醇体积分数一定时,多酚提取量与料液比呈正相关关系,与单因素试验中的变化不完全一致,可见两因素之间具有一定的交互作用。
图5C是乙醇体积分数为70%时,提取时间和料液比对多酚提取量的交互作用。当提取时间一定时,多酚提取量随料液比的增加而提高;当料液比在大约1∶15~1∶25 g/mL的范围内,随提取时间增加,多酚提取量也随之提高,而当料液在大约1∶25~1∶35 g/mL的范围内,多酚提取量随提取时间延长的变化逐渐趋于平缓,可见料液比的变化对提取时间与多酚提取量的关系存在一定影响,两因素间存在交互作用。
2.2.3 优化提取工艺及验证试验 通过回归模型的预测,得到余甘子果渣多酚的最佳提取工艺为:提取温度60 ℃,乙醇体积分数为58%、提取时间为1.33 h,料液比为1∶33 g/mL,多酚提取量最大为127.31 mg/g;为了便于操作,将提取条件略做调整为:提取温度60 ℃,乙醇体积分数为60%、提取时间为80 min,料液比为1∶33 g/mL,在此条件下进行了3次平行验证试验,结果多酚提取量为126.25 mg/g(RSD=1.39%,n=3),与预测值的相对标准偏差仅0.59%,说明了回归模型的可靠性,采用该模型优化的工艺参数是可行的。
余甘子果渣提取液经真空浓缩、冷冻干燥,得到余甘子果渣多酚提取物,经分析测定,提取物多酚含量为350.19 mg/g(RSD=0.91%,n=3)。
余甘子多酚及其抗氧化活性是余甘子多种生理功能的主要活性物质[1,5-7],一些文献报导了余甘子果实多酚提取工艺的试验研究[17-22],大部分研究中均采用溶剂提取法,溶剂有乙醇、甲醛、丙酮等,多酚得率可达到2.05%~5.48%(以鲜果计)[20-22]、3.87%~21.8%(以干粉计)[17-19],提取物的多酚含量可达到24.7%~36.3%。唐仕荣等[23]采用亚临界水萃取工艺对余甘子的多酚进行了研究,多酚得率为17.08%。本文的试验结果显示,作为余甘子生产废弃物的果渣中多酚提取量及提取物中多酚含量,与上述研究结果相比均为较高水平,表明余甘子果渣较高的利用价值,可对其进行深入研究开发。
2.3 多酚提取物抗氧化活性评价
采用ORAC、FRAP、ABTS及β-胡萝卜素漂白抑制等体外抗氧化试验,对余甘子果渣多酚提取物的抗氧化活性进行了评价,结果见表4。
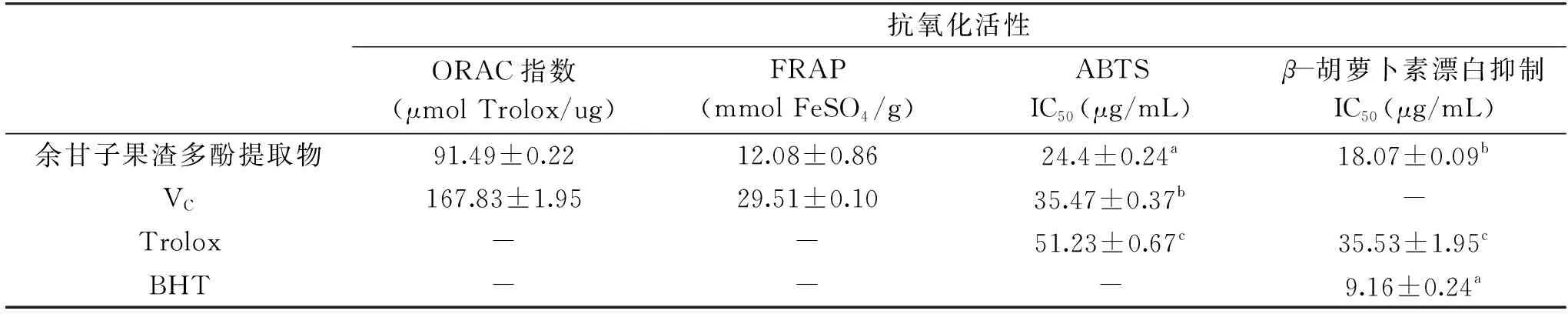
表4 余甘子果渣多酚提取物抗氧化活性Table 4 The antioxidant activities of extractive from emblica pomace
从表4结果可见,余甘子果渣多酚提取物作为一种粗提物,其ORAC指数已达到的VC50%以上,表明其具有较高的抗氧化活性;提取物具有一定的铁离子还原能力,而且达到了阳性对照VC还原能力的40%以上;提取物对ABTS+·自由基的半抑制浓度IC50显著低于(p<0.01)阳性对照VC和Trolox,表明其清除ABTS+·自由基的能力显著高于这两个阳性对照;提取物对β-胡萝卜素漂白抑制的IC50与阳性对照Tolox和BHT存在显著差异(p<0.01),提取物的IC50高于常用的脂类抗氧化剂BHT,但未达到BHT的2倍,而且显著(p<0.01)低于Tolox,表明其也具有较高的脂质氧化抑制能力。
体外抗氧化能力评价方法按作用机制可分为:清除生物体内活性氧自由基、基于氢原子转移(HAT)和基于电子转移(SET)的方法。一种评价方法只是对某一方面抗氧化能力的测定,没有一种抗氧化方法可以对一个物质的抗氧化能力进行完全合理的评价,需要同时从不同方面选择多个方法进行分析[24]。本文根据不同反应机理选择的4种评价方法结果表明,从余甘子果渣中得到的多酚提取物在抗氧化能力指数、铁离子还原能力、自由基清除能力和脂质过氧化抑制能力等方面都表现出较显著的抗氧化活性。
在余甘原汁的生产过程中,剩余果渣量几乎是原汁的2倍,原汁经冷冻干燥得到约10%的原汁干燥物,果渣干燥得率约为38%,根据我们的前期研究[8]可知,余甘原汁干燥物中多酚含量为235.6 mg/g,FRAP还原能力为9.21 mmol FeSO4/g,清除ABTS的半抑制浓度(IC50)为32.64 μg/mL,β-胡萝卜素漂白抑制试验的半抑制浓度(IC50)为121.17 μg/mL,由此可以发现,余甘子加工生产中,废弃的果渣中所含多酚类物质总量是原汁产品的4倍左右,并且果渣提取物的多酚含量及抗氧化活性大大高于原汁干燥物,进一步说明了对余甘子果渣进行研究开发的重要性。目前本项目组正在进行果渣提取物的分离纯化、组成成分及功能活性的试验研究,旨在为余甘子产业的发展开辟新的途径。
3 结论
通过单因素试验和Box-Behnken响应曲面试验优化,得到余甘子果渣多酚提取的最佳工艺条件:提取温度60 ℃,乙醇体积分数60%、提取时间80 min,料液比1∶33 g/mL,在此条件下三次平行验证试验结果多酚提取量为126.25 mg/g,与预测值的相对标准偏差仅为0.55%。提取物中多酚含量为350.19 mg/g,体外抗氧化活性评价表明余甘子果渣多酚提取物在抗氧化能力指数、铁离子还原能力、自由基清除能力和脂质过氧化抑制能力等方面都表现出较显著的抗氧化活性。
